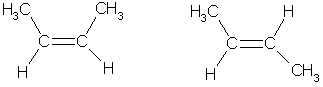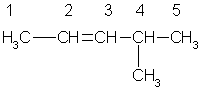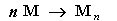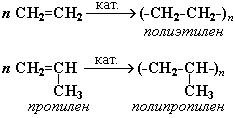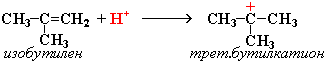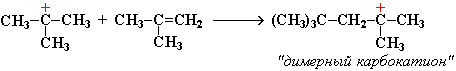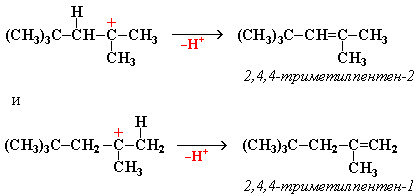Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Строение. Изомерия и номенклатураСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Простейшими непредельными (ненасыщенными) соединениями являются углеводороды, содержащие одну или несколько двойных связей. Алкены, содержащие две двойные связи, называются диенами, содержащие три двойные связи — триенами и т.д. Соединения с несколькими двойными связями имеют общее название полиены. Алкенами называются непредельные углеводороды, молекулы которых содержат одну двойную связь. Первый представитель этого класса — этилен СН2 = СН2, в связи с чем алкены также называют этиленовыми углеводородами. Ближайшие гомологи этилена:
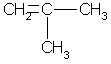
Простейший алкен с разветвленным углеродным скелетом:
2-метил пропен Общая формула гомологического ряда алкенов СnН2n. Она совпадает с общей формулой циклоалкана, поэтому алкены и циклоалканы являются межклассовыми изомерами. При отщеплении атома водорода от молекул алкенов образуются непредельные радикалы обшей формулы CnH2n-1, простейшие из которых — винил (этенил) иаллил (пропенил):
Атомы углерода при двойной связи находятся в состоянии sp2-гибридизации. Три σ-связи, образованные гибридными орбиталями, располагаются в одной плоскости под углом 120° друг к другу; π-связь образована при перекрывании негибридных 2р-орбиталей соседних атомов углерода. При этом атомные р-орбитали перекрываются не в межъядерном пространстве, а вне его. Поэтому такое "боковое" перекрывание менее эффективно, чем осевое, и, следовательно, π-связь является менее прочной, чем σ-связь. Дополнительное π-связывание двух атомов углерода приводит к тому, что уменьшается расстояние между ядрами, поскольку двойная связь является сочетанием σ- и π-связей. Длина двойной связи С=С составляет 0.133 нм, что существенно меньше длины одинарной связи (0,154 нм). Энергия двойной связи (606 кДж/моль) меньше удвоенного значения энергии одинарной связи (347-2 = 694 кДж/моль); это обусловлено меньшей энергией π-связи. Структурная изомерия алкенов обусловлена изомерией углеродного скелета (например, бутен-1 и 2-метилпропен) и изомерией положения двойной связи.Пространственная, или цис-транс-изомерия обусловлена различным положением заместителей относительно плоскости двойной связи. Если каждый из атомов углерода при связи С=С связан с двумя разными заместителями, то эти заместители могут располагаться по одну сторону от плоскости двойной связи (цис-изомер) или по разные стороны (транс-изомер), например:
цис-бутен-2 транс-бутен-2 Эти два изомера нельзя перевести друг в друга без вращения вокруг двойной связи С=С, а это вращение требует разрыва π-связи и затраты большого количества энергии. Поэтому цис- и транс-изомеры представляют собой разные индивидуальные вещества, которые отличаются друг от друга физическими и химическими свойствами. Алкены, у которых хотя бы один из атомов углерода при связи С=С имеет два одинаковых заместителя, не имеют цис-транс-изомеров. В алкенах с неразветвленной углеродной цепью нумерацию начинают с того конца, ближе к которому находится двойная связь. В названии соответствующего алкана окончание -ан заменяется на -ен. В разветвленных алкенах выбирают главную цепь так, чтобы она содержала двойную связь, даже если она при этом и не будет самой длинной. Перед названием главной цепи указывают номер атома углерода, при котором находится заместитель, и название этого заместителя. Номер после названия главной цепи указывает положение двойной связи, например:
4метилпентен -2 Физические свойства. пентан имеет температуру кипения 36 °С, а пентен-1 — 30 °С. При обычных условиях алкены С2 - С4 — газы. С5 – С15 — жидкости, начиная с C16 — твердые вещества. Алкены не растворимы в воде, хорошо растворимы в органических растворителях. способы их получения: 1. Основным промышленным источником алкенов служит крекинг алканов, входящих в состав нефти:
2. Другой промышленный способ получения алкенов - дегидрирование алканов:
3. В лабораторных условиях алкены получают по реакциям отщепления (элиминирования), при которых от соседних атомов углерода отщепляются два атома или две группы атомов, и образуется дополнительная π-связь. К таким реакциям относятся следующие. 1) Дегидратация спиртов происходит при их нагревании с водоотнимающими средствами, например с серной кислотой при температуре выше 150 °С:
2) Отщепление галогеноводородов проводят при действии спиртовых растворов щелочей на моноалкилгалогениды:
При отщеплении Н2O от спиртов, НВr и HCl от алкилгалогенидов атом водорода преимущественно отщепляется от того из соседних атомов углерода, который связан с наименьшим числом атомов водорода (от наименее гидрогенизированного атома углерода). Эта закономерность носит название правила Зайцева. 3) Дегалогенирование происходит при нагревании дигалогенидов, имеющих атомы галогена у соседних атомов углерода, с активными металлами: CH2Br-CHBr-CH3 + Mg → СН2=СН-СН3 + MgВr2. Полимеризация. Полимеризация – реакция образования высокомолекулярного соединения (полимера) путем последовательного присоединения молекул низкомолекулярного вещества (мономера) по схеме:
Число n называется степенью полимеризации. Реакции полимеризации алкенов идут в результате присоединения по кратным связям:
Димеризация алкенов – образование димера (удвоенной молекулы) в результате реакции присоединения. В присутствии минеральной кислоты (донора протона Н+) происходит присоединение протона по двойной связи молекулы алкена. При этом образуется карбокатион:
Этот карбокатион присоединяется к следующей молекуле алкена с образованием "димерного карбокатиона":
"Димерный карбокатион" стабилизируется путем выброса протона, что приводит к продуктам димеризации алкена – смеси изомерных диизобутиленов (2,4,4-триметипентена-2 и 2,4,4-триметилпентена-1):
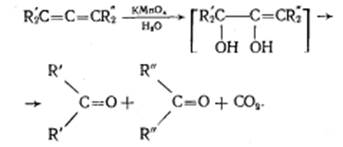
Этот процесс протекает при обработке изобутилена (2-метипропена) 60% серной кислотой при температуре 70°С. Образовавшаяся в результате смесь диизобутиленов подвергается гидрированию с целью получения "изооктана" (2,2,4-триметилпентана), который применяется для улучшения антидетонационной способности бензина ("изооктан" – стандарт моторного топлива с октановым числом 100). Подобно реакции димеризации алкенов происходит их полимеризация, только процесс не останавливается на стадии образования димера, а идет дальше и включает в себя множество стадий присоединения молекул алкена к растущему карбокатиону. Реакции окисления: Кумулированные диены легко окисляются водным раствором перманганата калия в нейтральной или слабощелочной среде, а также раствор перманганата калия в уксусной кислоте или пиридине вызывают расщепление до карбонильных соединений.
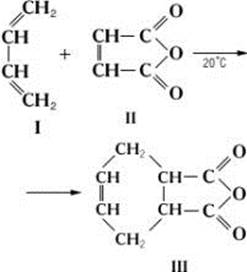
Реакцию димеризации диенов можно рассматривать как частный случай диенового синтеза – соединение 2-х молекул в одну (димер) Диеновый синтез, реакция 1,4-присоединения диеновых углеводородов с сопряжёнными двойными связями (диенов) к ненасыщенным соединениям (диенофилам). В результате Диеновый синтез образуются шестичленные циклы, содержащие двойную связь между вторым и третьим атомами углерода исходного диена. Типичный пример Диеновый синтез — получение ангидрида тетрагидрофталевой кислоты (III) из бутадиена-1,3 (I) и малеинового ангидрида (II):
Диенофилами обычно служат соединения, содержащие этиленовую или ацетиленовую связь, активированную электроотрицательной группой (— CO —, — COOR, — CN, — NO2 или др.). С такими диенофилами Диеновый синтезосуществляют простым смешением или нагреванием реагентов при 100—120°С. При отсутствии активирующей группы в диенофиле для Диеновый синтез необходимы жёсткие условия. В качестве диенофилов можно применять также карбонильные соединения, например гексафторацетон (CF3)2C = О, нитрозосоединения, например нитрозобензол C6H5— N = О, азосоединения, например гексафторазометан CF3 — N = N — CF3 и др. Роль диенов могут выполнять гетероциклические соединения, например фуран. Диеновый синтез широко применяют в синтетической органической химии, в том числе для синтеза стероидов.
15.Химические свойства алкенов: реакции присоединения:
1) Галогенирование. Алкены обесцвечивают бромную воду: СН2=СН2 + Вr2 → ВrСН2-СН2Вr. Эта реакция является качественной на двойную связь. 2)Гидрирование. Присоединение водорода происходит под действием металлических катализаторов:
3)Гидрогалогенирование. СН3-СН=СН2 + НВr СН3-СНВr-СН3. Продукты реакции определяются правилом Марковникова. 4)Гидратация. При взаимодействии алкенов с водой в присутствии минеральных кислот (серной, фосфорной) образуются спирты. Минеральные кислоты выполняют роль катализаторов и являются источниками протонов. Присоединение воды также идет по правилу Марковникова: СН3-СН=СН2 + НОН → СН3-СН(ОН)-СН3.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-07; просмотров: 524; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.78.215 (0.011 с.) |