Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Окисление в альдоновые, дикарбоновые и урановые кислотыСодержание книги
Похожие статьи вашей тематики
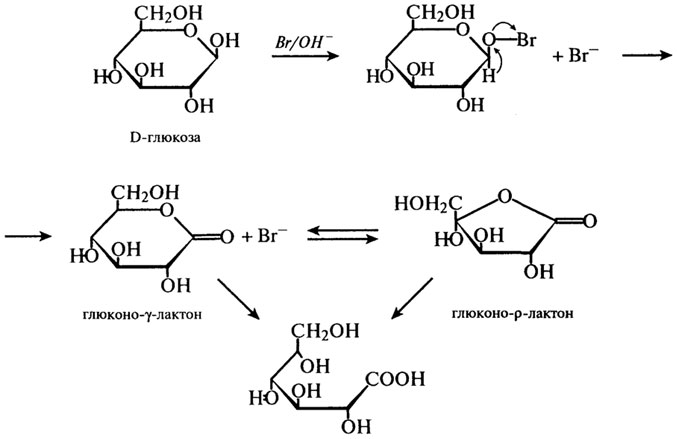
Поиск на нашем сайте Действие окислителей. Способность альдоз к окислению также имеет значение для пищевых продуктов. При определенных условиях возможно окисление в альдоновые кислоты, причем β-форма окисляется быстрее, чем α-форма. Продуктом окисления является ρ-лактон, который находится в равновесии с γ-лактоном и свободной формой альдоновой кислоты (см. 3.26). Последняя форма превалирует при рН 3.
Глюконо-ρ-лактон может присутствовать в пищевых продуктах в умеренно кислой среде, когда имеет место медленная реакция, например, при получении некоторых молочных продуктов. При действии более сильных окислителей (например, азотной кислоты) образуются дикарбоновые кислоты. Окисление в уроновые кислоты возможно только при защите карбонильной группы (см. 3.27).
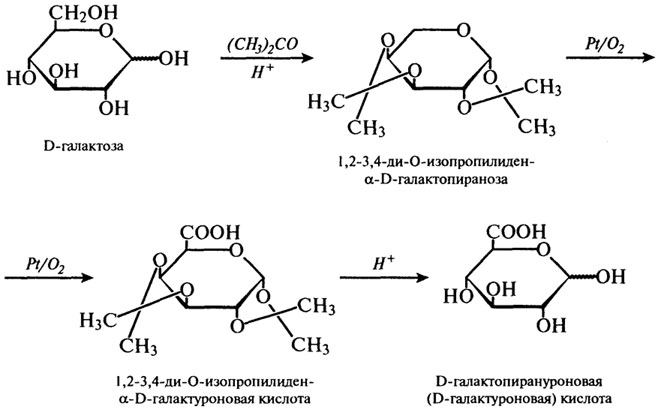
Один из промышленных способов получения глюкуроновой кислоты – окисление при гидролизе крахмала – приведен на рис. 3.28.
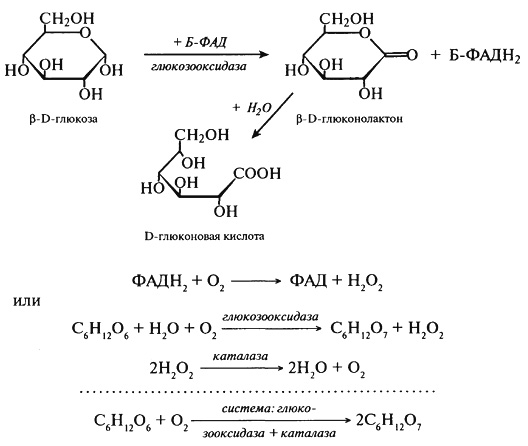
Уроновые кислоты распространены в природе. Некоторые их них являются структурными компонентами полисахаридов, имеющих важное значение в пищевых процессах, таких как гелеобразование и загустевание – это пектин (D-галактуроновая кислота), альгиновая кислота из морских водорослей (D-маннуроновая кислота, α-гулуроновая кислота). Окисление, катализируемое ферментами. Здесь прежде всего следует сказать об окислении глюкозы под воздействием глюкозооксидазы. С точки зрения применения в пищевых технологиях представляет интерес система глюкозооксидаза–каталаза. Глюкозооксидаза (β-D-глюкоза:О2-оксидоредуктаза) обладает исключительной специфичностью по отношению к глюкозе. Ее действие показано на схеме, приведенной на рис. 3.29.
Эта реакция является эффективным методом удаления кислорода из напитков (соков, пива), поскольку кислород участвует в образовании пероксидов и веществ, приводящих к изменению цвета и запаха продуктов. В табл. 3.9 и 3.10 представлены данные, характеризующие эффективность удаления кислорода из соков и пива. Данные по использованию гидросульфита (представленные для сравнения в табл. 3.10) показывают, что эффективность применения глюкозооксидазы несравненно выше – количество кислорода уже через неделю хранения в этом случае значительно меньше, чем в случае применения гидросульфита. Применение глюкозооксидазы дает возможность ингибировать протекание реакции Майяра. Таблица 3.9. Применение глюкозооксидазы (добавлена перед закупоркой бутылок) для удаления кислорода из соков (за 30 ч)
Таблица 3.10. Действие глюкозооксидазы при хранении пива
160:: 161:: 162:: 163:: Содержание 163:: 164:: Содержание Процессы брожения Брожение – процесс (в котором участвуют углеводы), используемый в ряде пищевых технологий: во время тестоприготовления при изготовлении хлеба, в производстве пива, кваса, спирта, вина и других продуктов. Спиртовое брожение осуществляется благодаря жизнедеятельности ряда микроорганизмов. Наиболее типичными организмами спиртового брожения являются дрожжи рода Saccharomyces. Суммарно спиртовое брожение может быть выражено следующим уравнением: С6H12 O6 = 2CO2 + 2C2H5OH Это суммарное уравнение не отражает того факта, что обычно, кроме главных продуктов брожения – этилового спирта и углекислого газа, всегда в незначительном количестве образуются некоторые другие вещества, например, янтарная, лимонная кислота, а также смесь амилового, изоамилового, бутилового и других спиртов, уксусная кислота, дикетоны, уксусный альдегид, глицерин и ряд других соединений, от наличия ничтожных количеств которых зависит специфический аромат вина, пива и других спиртных напитков. Разные сахара сбраживаются дрожжами с различной скоростью. Наиболее легко подвергаются сбраживанию глюкоза и фруктоза, медленнее – манноза, еще медленнее – галактоза; пентозы дрожжами не сбраживаются. Из дисахаридов хорошим субстратом спиртового брожения являются сахароза и мальтоза. Однако оба сахара сбраживаются лишь после предварительного гидролиза на составляющие их моносахариды ферментами α-гликозидазой и β-фруктофуранозидазой дрожжей. В присутствии кислорода спиртовое брожение прекращается и дрожжи получают энергию, необходимую для их развития и жизнедеятельности, путем кислородного дыхания. При этом дрожжи тратят сахар значительно экономнее, чем в анаэробных условиях. Прекращение брожения под влиянием кислорода получило название "эффект Пастера". Другой вид брожения, важный для пищевых технологий, это молочнокислое брожение, при котором из одной молекулы гексозы образуются две молекулы молочной кислоты: С6Н12О6 = 2СН3-СНОН-СООН Молочнокислое брожение играет очень большую роль при производстве молочнокислых продуктов (простокваши, ацидофилина, кефира, кумыса), при изготовлении кваса, хлебных заквасок и "жидких дрожжей" для хлебопечения, при квашении капусты, огурцов, при силосовании кормов. Все микроорганизмы, вызывающие молочнокислое брожение, разделяются на две большие группы. К первой группе принадлежат микроорганизмы, подобные Streptococcus lactis, являющиеся истинными анаэробами и сбраживающие гексозы в точном соответствии с вышеприведенным суммарным уравнением молочнокислого брожения. Их называют гомоферментативными молочнокислыми бактериями. Вторую группу образуют гетероферментативные молочнокислые бактерии, которые, кроме молочной кислоты, образуют значительные количества других продуктов, в частности, уксусной кислоты и этилового спирта. Характерным представителем второй группы молочнокислых бактерий является микроб Bacterium lactis aerogenes, образующий молочную, уксусную кислоты, этиловый спирт, углекислый газ, водород и метан. В частности, заметное содержание молочной и уксусной кислот в ржаном тесте (и ржаном хлебе) объясняется тем, что при брожении его, наряду со спиртовым брожением, происходит также молочнокислое брожение, при котором накапливаются как молочная, так и уксусная кислоты. 163:: 164:: Содержание 164:: 165:: Содержание
|
||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 549; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.108 (0.006 с.) |