Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Белки картофеля, овощей и плодовСодержание книги
Поиск на нашем сайте Относительно низкое содержание азотистых веществ в картофеле (около 2%), овощах (1,0-2,0%) и плодах (0,4- 1,0%) свидетельствует о том, что данные виды пищевого растительного сырья не играют значительной роли в обеспечении белком продуктов питания (табл. 2.11). Исключение составляет картофель, который, несмотря на невысокое содержание белка, как источник азотистых соединений имеет более существенное значение. Если учесть, что потребление картофеля в среднем составляет 330 г в день, то с данным видом продукта удовлетворяется 6-8% общей суточной потребности человека в белке. Количество белкового азота в клубнях картофеля обнаруживается в 1,5-2,5 раза больше, чем небелкового, тогда как в овощах и плодах, наоборот - менее 50% (например, в капусте 40%, винограде 7%). Небелковый азот картофеля представлен аминным (67-130 мг%) и нитратным азотом с аммиаком, которые от общего азота в клубнях составляют 18-31 и 10- 15%, соответственно. Сорта картофеля в большей степени отличаются по содержанию небелкового азота, чем белкового, и прежде всего по количеству свободных аминокислот. Среди них преобладают аланин, лизин, гистидин, глутаминовая кислота и фенилаланин. Таблица 2.11. Содержание белка в овощах и плодах (в % на сухую массу)
Белки картофеля являются биологически ценными белками, так как содержат все незаменимые аминокислоты. По отношению к белкам куриного яйца биологическая ценность белков картофеля равна 85%, по отношению к идеальному белку - 70%. Первыми лимитирующими аминокислотами белков картофеля являются метионин и цистеин, второй - лейцин. Белки картофеля отличаются по растворимости и компонентному составу, определяемому электрофорезом. Большая часть белков картофеля (70%) представлена глобулинами, меньшая (30%) - альбуминами. Различия в электрофоретической гомогенности суммарных белков являются признаком сорта и используются в селекционной практике при выведении новых сортов картофеля с высокой урожайностью, устойчивостью к болезням и вредителям. Среди овощных культур большим содержанием белка отличаются зеленый горошек (28,3-31,9%) и сахарная кукуруза (10,4-14,9% в расчете на сухой вес). Основную долю в зеленом горошке составляют глобулины (вицилин и легулин), в кукурузе - спирторастворимый зеин. У зеленого горошка одновременно отмечается высокое содержание альбуминов, которое в 2-3 раза выше, чем в зрелом горохе гладкозерных сортов. В процессе созревания горошка белки интенсивно накапливаются при снижении экстрактивного азота. В молочно-восковой стадии спелости в горошке содержится в 2,5-3 раза меньше глютелинов, чем при полной зрелости, количество более подвижного вицилина преобладает над легу-лином. К концу созревания, наоборот, количество вицилина снижается, а легулина увеличивается. По сравнению с зерновой кукурузой овощная кукуруза содержит значительно больше альбуминов, глобулинов и проявляет тенденцию к меньшему содержанию щелочерастворимых белков. Содержание зеина составляет 21,1-37,2% от общего белка, что значительно меньше, чем в кукурузе других ботанических групп (41-58%). Особенность фракционного соста-иа зеленого горошка и кукурузы благоприятно отражается на их аминокислотном составе. Значительную долю аминокислот горошка составляют лейцин с изолейцином (15,4% от общего количества), фенилаланин (7,1 %), валин с метионином (5,2%), аргинин (10,5%) и треонин (5,2%). Для белков сахарной кукурузы характерно высокое содержание лейцина и изо-лейцина- 15,1%, аргинина 12,4%, глутаминовой кислоты 17,3%,аланина, глицина, серина 9,0%, гистидина 4,2%, лизина 1,1%. Высокое содержание в зеленом горошке и сахарной кукурузе лизина и аргинина объясняется повышенным количеством альбуминов, а в кукурузе - и пониженным содержанием биологически неполноценного зеина. При различных температурных воздействиях белки обеих культур ведут себя по-разному. Нагрев зеленого горошка в течение 1 мин в воде при 98- 100°С уменьшает растворимость глобулинов на 80%, альбуминов - на 24% и увеличивает количество щелочерастворимой фракции (на 61 %). Замораживание при температуре -30...-196°С не оказывает существенного влияния на растворимость и компонентный состав белков. В процессе длительного хранения замороженного, но предварительно прогретого горошка изменяется фракционный состав и происходит денатурация белков. Состав азотистых веществ и изменение его при хранении и переработке представляет определенный интерес и у перца и баклажан. Зрелые баклажаны обладают большим содержанием белковых веществ, чем перец: 1,55% и 0,76% соответственно, и более высоким уровнем отношения белковый/небелковый азот - 0,94/0,89. Более высокая способность баклажан к биосинтезу азотистых соединений подтверждается более высоким содержанием у них ДНК, РНК, фосфора и серы (в мг/г сухого вещества): Баклажаны Перец РНК................................. 0,27-0,32..... 0,13-0,31 ДНК................................. 0,21-0,36..... 0,14-0,22 Фосфор.............................. 5,5-7,2............ 2,5-7,1 Сера................................... 2,2-2,9............ 0,9-2,5 Баклажаны более устойчивы к увяданию по сравнению с перцем, что связывают с большим накоплением в них белковых веществ. Азотистые вещества картофеля, овощей и плодов имеют существенное значение для формирования питательных и органолептических свойств продуктов (вкуса, аромата, цвета, консистенции), стойкости при хранении и сохранности витаминов. Так, свободные аминокислоты принимают участие в реакциях, связанных с образованием аромата (реакции Майяра), нитраты в избыточных количествах ухудшают стойкость при хранении, а действие, например, пектолитических ферментов к концу созревания плодов обуславливает их размягчение. Некоторые из азотистых соединений выполняют роль ингибиторов протеаз и амилаз. Ферменты, являясь белками, оказывают значительное влияние на потребительские свойства пищевых продуктов и полуфабрикатов, принимая участие в процессах созревания, дыхания при хранении сочного сырья и его переработке. Прежде всего это относится к оксидоредукта-зам и гидролазам (см. гл. 8). Сохранность овощей и плодов в процессе хранения зависит от активности анаэробных дегидрогеназ (алкогольде-гидрогеназы, дегидрогеназ яблочной, янтарной, лимонной кислот) и кис-лородактивирующих оксидоредуктаз. Способы хранения плодов и овощей предусматривают подавление активности указанных ферментов (исключение доступа кислорода, понижение температуры и т.д.). Нежелательным процессом при хранении является реакция окисления ненасыщенных жирных кислот, L-молочной кислоты, аскорбиновой кислоты, лизина, фенолов, протекающих с участием соответственно липоксиге-назы, лактатоксидазы, аскорбатоксидазы, лизинооксигеназы, о-дифенол-оксидазы. Гидропероксиды, образующиеся в результате действия, например липоксигеназы, самостоятельно осуществляют окисление фенолов, а образующиеся при этом хиноны участвуют в процессах распада аскорбиновой кислоты, аминокислот, взаимодействуют с белками и углеводами, вызывая ухудшение органолептических (потемнение, изменение вкуса, запаха), технологических (набухание, размягчение) свойств и потерю пищевой и биологической ценности (деструкцию незаменимых аминокислот, жирных кислот, витаминов, снижение усвояемости, переварива-емости). Из гидролаз в овощах, плодах и картофеле обнаружены (З-глюкозида-за, р-фруктофуранозидаза, полигалактуроназа, пектинлиаза, пектатлиа-за, протеолитические и другие ферменты. Инактивация ферментов в результате тепловой обработки при консервировании, сушке и получении натуральных соков из плодов, овощей и ягод предотвращает порчу и сохраняет цвет, вкус и аромат сочного сырья. В клубнях картофеля, семенах японской редиски, корнях турнепса, зеленом горошке, томатах содержатся белки-ингибиторы животных про-теиназ, в первую очередь трипсина и химотрипсина. По содержанию ингибиторов сочное растительное сырье занимает третье место после бобовых и злаковых. Наиболее хорошо изучены ингибиторы ферментов клубней картофеля. Ингибитор химотрипсина картофеля относится к "арги-ниновому" типу, то есть в участке, который вступает во взаимодействие с активным центром фермента, содержится аргинин. Помимо ингибиторов трипсина и химотрипсина в картофеле обнаружены полипептиды, действующие как ингибиторы карбоксипептидаз А и Б. 76:: 77:: 78:: 79:: Содержание 79:: 80:: 81:: 82:: 83:: 84:: 85:: 86:: Содержание Белки мяса и молока Мясо, молоко и получаемые из них продукты содержат необходимые организму белки, которые благоприятно сбалансированы и хорошо усваиваются. Белки мышечной ткани мяса животных полноценны, по сбалансированности аминокислот говядина, баранина и свинина мало отличаются друг от друга. Белки соединительной ткани и хрящей являются неполноценными. В организме человека и животных белки мышц выполняют сократительную функцию, белки соединительной ткани и хрящей - структурную. Функции всех этих видов белков основаны на их фибриллярной природе. Содержание белка в мясных продуктах колеблется от 11 до 22%. Главными мышечными белками являются миозин и актин, молекулярная функция которых заключается в обеспечении механизма мышечного сокращения и расслабления при участии АТФ. Миозин по массе составляет 55% мышечного белка и представляет собой гексамер с молекулярной массой 460 кД. Гексамер включает фибриллярную часть (две переплетенные а-спирали с молекулярной массой 200 кД, заканчивающиеся глобулярными "головками"), тяжелые цепи и две пары легких цепей (молекулярная масса 15-27 кД). Миозин обладает АТФ-гидро-лизующей активностью и способностью связываться с нерастворимым F-актином. Актин - это мономерный глобулярный белок с молекулярной массой 43 кД (G-актин), на долю которого приходится 25% общей массы мышечного белка. В присутствии магния G-актин подвергается нековалентной полимеризации с образованием двойной спиральной цепочки, получившей название F-актина. Мышечное сокращение заключается в повторяющихся присоединениях и отсоединениях глобулярной "головки" миозина от нити F-актина. Гидролиз АТФ запускает цикл ассоциации и диссоциации актина и миозина в пяти реакциях данного процесса (рис. 2.16).
Сущность же процесса расслабления мышцы заключается в отделении миозиновой (АТФ) головки от F-актина. В мышечных клетках содержится глобулярный водора створимый хромопротеид миоглобин, имеющий в качестве простетической группы гем-циклический тетрапиррол, присутствием которого объясняется красный цвет этого белка. Тетрапирролы состоят из четырех молекул пиррола, связанных четырьмя а-метиленовыми мостиками с образованием плоской кольцевой структуры. В центре плоского кольца находится один атом железа в ферро-состоянии (Fe2+), окисление которого приводит к потере биологической активности миоглобина.
Биологическая функция миоглобина заключается не в транспортировании кислорода, как у гемоглобина, а в его запасании. В условиях кислородного голодания (например, при физической нагрузке) кислород высвобождается из комплекса с миоглобином и поступает в митохондрии мышечных клеток, где осуществляется синтез АТФ (окислительное фосфорил ирование). На примере миоглобина хорошо изучена взаимосвязь функции глобулярного белка и его структуры. Миоглобин состоит из одной полипептидной цепи с молекулярной массой 17 кД, включающей 153 остатка аминокислот. Примерно 75% остатков образуют восемь правых α-спиралей, уложенных в компактную сферическую молекулу. В местах изгиба полипептидной цепи расположены остатки пролина, серина, треонина, которые не способны к образованию α-спирали. На поверхности молекулы находятся полярные остатки, а внутри - неполярные, если не считать двух остатков гистидина, принимающих участие в связывании кислорода. Присоединение кислорода к миоглобину сопровождается смещением атома железа, а вместе с ним гистидина, и ковалентно связанных других остатков аминокислот в направлении плоскости гемового кольца. В результате эта область белковой молекулы принимает новую конформацию. Миоглобин, не связанный с кислородом, называют дезоксимиогло-бином (Mb), оксигемированный Mb называют оксимиоглобином (МЬО2). Окраска мясопродуктов зависит от содержания миоглобина, состояния тема и белковой части макроглобулы. Окисление Fe2+в миоглобине до Fe3+приводит к изменению окраски пигмента от ярко-красного до темно-коричневого, так как образующийся метмиоглобин (MetMb) теряет способность связывать молекулярный кислород. Тепловая денатурация глобина также приводит к потере способности гемового пигмента связывать кислород и ухудшает цвет изделий. Кислород миоглобина может замещаться такими лигандами, как оксид азота, оксид углерода и др., поэтому данное свойство белка мышечной ткани мяса используется для получения интенсивной окраски мясопродуктов. Нитрит (NO), применяемый для этой цели, вступая в реакцию с миоглобином, образует нитрозомиоглобин, переходящий при нагревании в устойчивый пигмент красного цвета нитрозомиохромоген:
Миоглобин и его производные имеют разные спектральные характеристики, поэтому для их идентификации при оценке качества мяса применяют спектрофотометрические методы анализа. Наиболее распространенным белком в животном мире является коллаген - главная макромолекула кожи, сухожилий, кровеносных сосудов, костей, роговицы глаза и хрящей. Он обеспечивает внеклеточную структуру в соединительной животной ткани, существуя не менее чем в пяти различных типах. Главной особенностью коллагеновых молекул является трехспиральная структура, каждая а-цепь (субъединица) которой представляет левозакрученную спираль. В спирали на каждый виток приходится по три аминокислотных остатка. Три левые а-спира-ли закручиваются в правые суперспирали, которые в свою очередь объединяются в фибриллы. Еще одной характерной особенностью молекулы коллагена является наличие в ее составе в качестве третьего остатка тройной спирали а-цепи глицина. Повторяющуюся структуру можно представить как 1ли-X--Y, где X, Y - другие аминокислоты. Около 100 Х- и 100 Y-положений в коллагене занято пролином и 4-гидроксипролином, соответственно (см. Аминокислоты и их некоторые функции в организме). В некоторых Х-положениях содержится 3-гидроксипролин, а в Y - 5-гидроксилизин. Остатки "жестких" аминокислот увеличивают стабильность тройной спирали. По количеству оксипролина определяют степень развариваемости коллагена при оценке качества мяса. Коллаген - внеклеточный белок, но он синтезируется внутри клетки в виде молекул-предшественников, проходя через эндоплазматический ретикулум и комплекс Гольджи. В результате процесса посттрансляционной модификации тройная спираль коллагена стабилизируется между внутрицепочными дисульфидными связями, о-гликозидными связями между остатками сахаридов и гидроксилизина и перекрестным связыванием цепей и спиральных молекул фибрилл через Шиффовы основания (см. гл. 3) и альдольную конденсацию. Близкий по свойствам к коллагену, в эластичных фибриллах соединительной ткани обнаружен белок эластин, содержащийся в связках и стенках кровеносных сосудов. Этот белок богат глицином, аланином и лизином, но беден пролином. Отличительной особенностью эластина является наличие в его структуре поперечных связей необычного характера. Альдегидные группы, возникшие в результате окисления аминогрупп боковых цепей остатков лизина и оксилизина, взаимодействуют с аминогруппой лизина при помощи реакций альдольной конденсации, дегидратации и окисления, образуя десмозин и изодесмозин. Все четыре аминогруппы и карбоксильные группы участвуют в образовании пептидных связей. Мясо, содержащее много соединительной ткани, остается жестким и после тепловой обработки; усвояемость коллагена и эластина в нем очень низкая. Однако при необходимости усиления двигательной функции кишечника целесообразно использование продуктов, богатых соединительной тканью. В диетах щадящего режима применяют желатин - продукт неполного гидролиза коллагена. По аминокислотному составу желатин неполноценен, но желеобразные продукты из него перевариваются без напряжения секреции пищеварительных органов. Молоко - это гетерогенная система, в которой в качестве дисперсной фазы выступают эмульгированные жировые глобулы и коллоидные мицеллы казеина, а в роли дисперсионной среды - раствор белков, лактозы, солей и витаминов. Общее содержание белков в молоке колеблется от 2,9 до 3,5%. Среди них выделяются две основные группы: казенны и сывороточные белки (табл. 2.12). В молоке содержится более 20 ферментов (ксантиноксидаза, пероксидаза, каталаза, липаза, холинэстераза, Таблица 2.12. Состав и молекулярные характеристики белковых компонентов молока
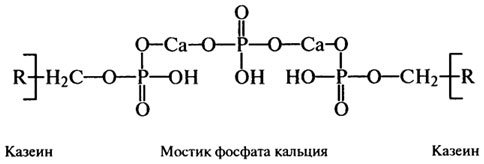
α-амилаза, лизоцим, протеаза и др.), а также гормоны (пролактин, окси-тоцин, кортикостероиды, тироксин, трииодтиронин и др.) и белки в составе оболочек жировых шариков. Основными белками молока являются казенны, которые легко перевариваются и являются источниками незаменимых аминокислот, кальция, фосфора и ряда физиологически активных пептидов. Так, при действии в желудке на k-казеин химозина высвобождаются глико- и фосфопептиды, которые регулируют секрецию желудочного сока, моделируют физико-химические свойства белков (растворимость, вязкость, заряд, денатурацию), осуществляют защиту от про-теолиза и влияют на проницаемость мембран клеток. Важнейшими физиологическими функциями обладают и сывороточные белки. Иммуноглобулины выполняют защитную функцию, лактоферрин и лизоцим (фермент) являются носителями антибактериальных свойств, а лактоферрин и β-лактоглобулин выполняют транспортную роль, перенося в кишечник микро- и макроэлементы, витамины и липиды. α-Лактальбумин необходим для синтеза лактозы в молоке из УДФ-галактозы и глюкозы. Для большинства компонентов казеина, α-лактальбумина, β-лактоглобулина и компонентов протеозо-пептонной фракции расшифрованы первичные и некоторые фрагменты вторичной, третичной и четвертичной структуры. Так, молекулы казеина имеют небольшое количество α-спиралей - 1-6% (тогда как, например, а-лактальбумин состоит из 26% α-спирали, β-конформации) и только остальное количество белка представляет собой неупорядоченную структурную организацию. При образовании четвертичной структуры казеина большая роль отводится гидрофобным взаимодействиям и фосфат-кальциевым мостикам и меньшая - электростатическим и водородным связям. Фосфаткальциевые мостики являются основой казеинаткальциевого фосфатного комплекса, в виде которого и содержится казеин в молоке:
Кальций в составе комплекса выполняет роль структурообразовате-ля, создавая мостик между серинфосфатными группами двух молекул казеина, а остатки фосфорной кислоты усиливают кислые свойства белка, обусловленные присутствием в полипептидах β- и γ-карбоксильных групп аспараги новой и глутаминовой кислот. Казеин из молока осаждается при рН 4,6-4,7, когда на его молекулах наступает равенство положительных и отрицательных зарядов. Осажденный казеин практически не растворяется в воде, но растворяется в слабощелочной среде и растворах солей щелочных металлов и минеральных кислот. Нерастворимый казеин обладает способностью связывать воду в достаточно больших количествах (более 2 г на 1 г белка), что очень важно для устойчивости частиц белка в сыром, пастеризованном или стерилизованном молоке. Гидрофильные свойства казеина усиливаются при взаимодействии его с р-лактоглобулином, которое наблюдается в процессе тепловой обработки молока, и от них зависят структурно-механические свойства сгустков, образующихся при кислотном свертывании или получении сырной массы при созревании сыров. Промышленные казенны получают из обезжиренного молока действием кислот, кисломолочной сыворотки, введением солей кальция, химозина или других ферментов. В зависимости от способа получения различают казеинат натрия, казеинат кальция, кислотный, сычужный казеин и копреципитат с разными функциональными свойствами. Для регулирования последних часто используют неполный ферментативный гидролиз или смешение с растительными белками и их совместную сушку. При производстве новых форм белковой пищи (аналогов мясных и рыбных продуктов) большое значение имеет гелеобразование казеина, его взаимодействие с веществами небелковой природы, образование стойких эмульсий и явление синерезиса. Белки молока характеризуются высокой биологической ценностью, они содержат в избыточных количествах лизин и триптофан с одновременным недостатком серосодержащих аминокислот (см. Пищевая и биологическая ценность белков). Белки сыворотки содержат незаменимые аминокислоты в значительно больших количествах, чем казеин, включая лизин, треонин, триптофан, метионин и цистеин. На долю сывороточных белков от общего количества белков в молоке приходится 0,5-0,8%. β-Лактоглобулин устойчив в кислой среде желудка к действию пепсина, поэтому расщепляется только в кишечнике трипсином и химотрипсином. В процессе пастеризации молока белок денатурируется, образуя комплексы с к-казеином, и осаждается вместе с ним при кислотной и сычужной коагуляции. Податливость данного комплекса действию сычужного фермента понижается. α-Лактальбумин не осаждается в изоэлектрической точке (рН 4,6), не свертывается под действием сычужного фермента и термостабилен в силу большого количества дисульфидных связей. Иммуноглобулины по химической природе являются гликопротеидами. Они выполняют свою функцию, вызывая агглютинацию микроорганизмов и других чужеродных клеток. Выделены три основные группы иммуноглобулинов: G, А и М. Среди них имеются мономеры и полимеры, состоящие из тяжелых и легких полипептидных цепей с молекулярной массой 50 кД и 25 кД, соответственно. Различают два основных типа молочной сыворотки: сладкую, образующуюся при производстве сыров, и кислую, получаемую при осаждении творога и казеинов. Для применения молочной сыворотки в качестве добавок в хлебопекарной, кондитерской промышленности, для производства смесей для детского питания ее концентрируют методами сушки, ультрафильтрации, электродиализом и осаждением белка в виде комплексов с полиэлектролитами. Для получения изолятов, концентратов и копреципитатов применяют термоденатурацию с последующим осаждением белка в ИЭТ (рН 4,5-4,6) и комплексообразование с анионными полисахаридами (КМЦ, альги-наты и пектины). Эти способы позволяют выделять до 70-90% полноценного белка молочной сыворотки и варьировать его функциональные свойства. 79:: 80:: 81:: 82:: 83:: 84:: 85:: 86:: Содержание 86:: 87:: 88:: 89:: 90:: 91:: Содержание 2.7. НОВЫЕ ФОРМЫ БЕЛКОВОЙ ПИЩИ. Основным направлением научно-технического прогресса в области производства продовольствия в последние три десятилетия является интенсификация процессов приготовления пищи с одновременным приданием ей комплекса свойств, отражающих требования науки о здоровом питании. Новые пищевые производства в качестве приоритетных включают технологии получения белковых продуктов. Эти технологии основываются на фундаментальных и прикладных знаниях в области пищевой, физической, биологической, биоорганической химии, генетики, молекулярной биологии, биофизики и ряда технических дисциплин. Объективные причины создания принципиально новых технологий получения белковых компонентов пищи следующие: рост численности населения, осознание людьми того, что ресурсы планеты не безграничны, необходимость выпуска пищевых продуктов с составом, соответствующим современному образу жизни, и возможность использования накопленных человеком теоретических знаний в прикладных целях. Отличительной особенностью технологий производства белковых продуктов является возможность целенаправленного использования отдельных фракций белков и комплексной переработки сырья с одновременным получением других полезных пищевых ингредиентов (крахмала, масла, пектина, фосфатидов и т. д.). Новые формы белковой пищи - это продукты питания, получаемые на основе различных белковых фракций продовольственного сырья с применением научно обоснованных способов переработки и имеющие определенный химический состав, структуру и свойства, включая биологическую ценность. Объективной количественной оценкой создания и развития отрасли производства растительных белковых продуктов (фракций) является наличие сельскохозяйственного сырья, высокопроизводительного оборудования (экстракторов, сепараторов, центрифуг, сушилок и т. д.) и конкурентоспособных технологий. К потенциальным сырьевым источникам относят: зернобобовые (соя, горох, чечевица, люпин, фасоль, нут); хлебные и крупяные культуры (пшеница, тритикале, рожь, овес, ячмень, кукуруза) и побочные продукты их переработки (отруби, сечка, мучка, зародыш); масличные (подсолнечник, лен, рапс, кунжут); псевдозлаковые (амарант); овощи и бахчевые (картофель, тыква); вегетативная масса растений (люцерна, клевер, люпин, сахарная свекла, зеленый табак); продукты переработки фруктов и ягод (косточки абрикоса, сливы, вишни, кизила, винограда и т. д.); кедровые и другие виды орехов. Не менее важными факторами, определяющими выбор сырьевых источников, являются: количество и состав белка, биологическая ценность, возможность удаления антипитательных веществ, функциональные свойства, способность к хранению, возможность глубокого фракционирования с получением как основных (белковых), так и побочных продуктов питательной (жир, крахмал) или лечебно-профилактической (пектин, сорбит, ксилит, лецитин, антоцианы, витамины, глюкозо-фруктозные сиропы и т. д.) ценности. Производства по выпуску пищевых белков строят вблизи от биохимических или кормовых заводов с целью получения ряда дополнительных ингредиентов (дрожжи, ферментные препараты, сухая мезга и т. д.) или организовывают специализированные цеха на действующих предприятиях. Традиционными источниками для производства белковых продуктов являются соя и пшеница. Продукты из соевых белков подразделяются на три группы, отличающиеся по содержанию белка: мука-крупа, концентраты, изоляты. На базе указанных видов белковых продуктов организуется производство и маркетинг текстурированной муки, концентратов и изолятов. Выпускаются модифицированные и специальные белковые продукты. Соевая мука и крупа производятся на мельничном оборудовании путем измельчения до определенного размера частиц обезжиренных или необезжиренных семян с последующим их просеиванием. В муке и крупе содержится 40-54% (N х 6,25) белка от общей массы продукта. Разные виды муки (крупы) отличаются по содержанию жира, размеру частиц и степени тепловой обработки. От интенсивности теплового воздействия зависят КРА, КДБ, активность ферментов липоксиге-назы, уреазы и ингибиторов протеаз. Соевые белковые концентраты изготавливаются из очищенных и обезжиренных соевых бобов (белых лепестков) путем удаления растворимых в воде небелковых компонентов (олигосахаридов, ферментов, минеральных веществ). Концентраты содержат 65-70% белка на сухое вещество (N х 6,25). Соевые белковые изоляты являются наиболее очищенной формой белковых продуктов, так как содержат не менее 90% белка на сухое вещество. Белок экстрагируется из измельченного белого лепестка слабощелочным раствором (рН 8-11) с последующим осаждением в изоэлектрической точке (4,2-4,5) и отделением в виде творожистой массы от олигосахаридов. Белковая масса промывается, нейтрализуется до рН 6,8 и сушится. Назначение текстурированных белковых продуктов заключается в придании пищевым изделиям волокнистой или многослойной (кускообразной) структуры. После гидратации такие белковые продукты по внешнему виду и структуре напоминают мясо, птицу или морские продукты, выступая при этом в роли аналогов традиционных пищевых продуктов. Многослойная мясоподобная структура соевых белковых продуктов может формироваться с помощью термопластической экструзии. Основные стадии процесса включают: дозирование сырья → кондиционирование (увлажнение, нагревание) → варочный процесс → ламинарное течение (ориентация молекул белков) → формирование волокон → разрезание продукта на кски → сушка. В основе экструзии лежит процесс реструктуризации белка, заключающийся в том, что под влиянием температуры, увлажнения и механического воздействия макромолекулы его формируют вязкопластичную массу, выстраивающуюся в направлении сдвига, с образованием новых поперечных связей. В результате образуется многослойная объемная жевательная структура, пригодная для использования в качестве наполнителей или аналогов. Особые соевые продукты представлены соевым соусом, тофу (соевым творогом), соевым молоком, мисо (соевой пастой) и другими видами. Модифицированные белки (частично или полностью гидроли-зованные) получают из белковых продуктов с применением протеолитических ферментных препаратов (пепсин, папаин, бромелаин) или кислотного гидролиза. Такие белки используются как функциональные и вкусовые добавки к пище. Из пшеницы или пшеничной муки методом водной экстракции небелковых и растворимых белковых компонентов получают сухую пшеничную клейковину. Так как клейковина является скоропортящимся продуктом, то важное место в технологическом процессе производства клейковины занимает сушка. Во-первых, влажность готового продукта не должна превышать 10%, а во-вторых, клейковина должна быть нативной, или "витальной". Первое условие необходимо в целях успешного хранения, а второе - для обеспечения широкого использования клейковины как технофункционального ингредиента. В клейковине содержится белка не менее 75-80% (N х 5,7), жира - 0,5-1,5%, клетчатки - 1,5%, зольность - 0,8-1,2%. Несмотря на то, что в индустрии пищевых белков разработано и внедрено огромное количество технологий, существуют перспективные направления, которые заключаются в получении белковых продуктов повышенной пищевой и биологической ценности из нетрадиционного сырья, фракционировании белков на компоненты с разными молекулярными массами (например, 7S и 11S белки сои), физико-химическими, функциональными и фармакологическими характеристиками и разработке на их основе нового поколения белковых добавок (композитов) с полифункциональными свойствами и многоцелевого назначения. Растительный белок зерновых и других культур в общей массе уступает животному по содержанию незаменимых аминокислот (лизина, треонина и триптофана). Поэтому уже сегодня по всему миру широко разрабатываются и внедряются в жизнь специальные программы питания, предусматривающие применение растительных белков или лимитирующих аминокислот для взрослого населения, школьников и детей. Оптимальный баланс незаменимых факторов питания обеспечивается путем правильного подбора и сочетания различных видов белков (эффект взаимного обогащения^. Дополнение в пищу, например, сои является прекрасным методом восполнения недостатки лизина в пшенице, кукурузе и рисе. За счет правильного подбора составляющих в смесях из хлебных, бобовых и масличных культур можно значительно повысить КЭБ, за эталон которого принимают показатель для казеина (2,5). Смеси из хлебных культур с соевыми продуктами комплементарны по аминокислотному составу уже при соотношении 50:50, однако идеальным считают - 30:70. В зависимости от соотношения белковых составляющих различают эффекты истинного и простого обогащения. Эффект истинного обогащения наблюдается в том случае, если скор для каждой незаменимой аминокислоты в белке создаваемого продукта не менее 1,0, а простого - если значения аминокислотного скора композиции хотя и меньше 1,0, но выше, чем значения данного показателя для белков каждого продукта в отдельности. Сбалансированность аминокислотного состава в белковых продуктах положительно отражается на их усвояемости. Если усвояемость белков растений по сравнению с казеином составляет 60-80%, то усвояемость белков, находящихся в составе концентрированных белковых продуктов с большим количеством незаменимых аминокислот, - 80- 100%.Так, усвояемость взрослым человеком соевых белковых концентратов и изолятов, как и белков молока, находится в пределах 91-96%, сухой пшеничной клейковины - 91%, а белковой муки из пшеничных отрубей - 94%. Данный показатель возможно повысить до 97-99% смешиванием их с лимитирующими аминокислотами. Например, добавление 0,5-1,5% метионина к белковым продуктам из сои приближает их по питательной ценности к идеальному белку, а добавление триптофана в пищу вызывает образование в организме человека антител и повышает его иммунитет. В табл. 2.13 показано влияние добавок аминокислот на качество зернового корма, оцениваемое по КЭБ. В производстве продуктов и кормов уже давно применяют добавки лимитирующих аминокислот, производство которых в мире представляет собой крупнотоннажную специализированную отрасль. Более 98% производства (по данным ФАО) приходится на метионин, лизин и триптофан. Основными способами получения аминокислот являются методы микробиологического (лизин, треонин, валин) и химического (метионин, триптофан, фенилаланин) синтеза, однако часть дефицитных аминокислот можно получать с применением ферментативных методов (метионин), экстракцией (цистин, тирозин) и генной инженерии (лизин, треонин). Употребление аминокислот в пищу требует тщательного контроля со стороны медиков и специалистов по питанию, так как здесь необходимы особые методы их потребления и приемы введения. Лимитирующие аминокислоты, находясь в составе пищи и не участвуя в полостном пищеварении, либо быстро поступят в кровеносную систему, либо останутся в кишечнике, где под влиянием микрофлоры станут объектом образования токсичных продуктов. Разница во времени поступления в кровь свободных аминокислот и аминокислот, образовавшихся при переваривании белков пищи, будет способствовать протеканию негативных ферментативных превращений дезаминирования, декарбоксилирования и т.д. Свободные аминокислоты, не принимая участие в синтезе белков тела, могут стать источником токсичных биогенных аминов и аммонийных солей. Наиболее высокой токсичностью обладают продукты Таблица 2.13. Влияние добавок аминокислот на КЭБ зерновых культур
дезаминирования триптофана, тирозина, гистидина. Так, гистамин и серотонин, образующиеся при декарб
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 890; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.62 (0.019 с.) |