Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Спиртные напитки и пивоварениеСодержание книги
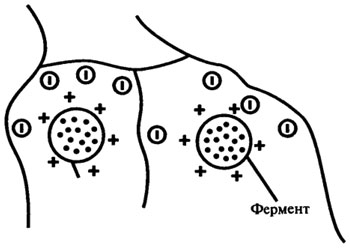
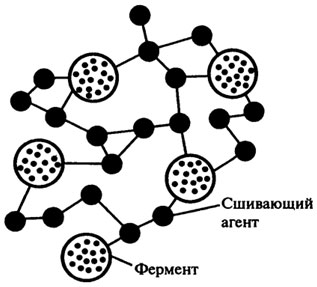
Поиск на нашем сайте Производство спиртных напитков. Производство спиртных напитков из крахмалсодержащего сырья практикуется почти во всех странах мира. Основными видами сырья являются картофель и рожь в Европе, картофель и пшеница в России, кукуруза и рожь в США, рис и бататы на Востоке, тапиока в тропических странах. Крахмал, как основной компонент сухих веществ сырья, из которого и образуется спирт, непосредственно дрожжами не сбраживается. Поэтому его необходимо гидролизовать до сбраживаемых сахаров, для этого требуется применение ферментов. Применяемый издавна зерновой солод, как источник амилолитичес-ких ферментов, обеспечивает достаточно глубокое осахаривание и выбраживание только за трое суток. Необходимо отметить, что зерновой солод не только выполняет задачу гидролиза крахмала до сбраживаемых сахаров, но и является источником легкоусвояемого азотистого питания для дрожжей, т. к. в процессе солодоращения, под действием протеиназ, в нем накапливается значительное количество аминокислот (до 32% от общего азота). Активность протеиназ в процессе солодоращения возрастает примерно в 40 раз. Зерновой солод обладает и цитолитической активностью, обеспечивая определенную степень гидролиза клеточных стенок растительного сырья и тем самым улучшая контакт крахмала с амилолитическими ферментами. Таким образом, применяемый в спиртовом производстве зерновой солод выполняет три основные функции: осуществляет гидролиз крахмала до сбраживаемых Сахаров; является источником азотистого питания для дрожжей и при осахаривании крахмалистого сырья производит частичное разрушение клеточных стенок сырья. Однако скорость осахаривания крахмала при использовании солода остается достаточно низкой, что затрудняет интенсификацию процесса брожения. Применение ферментных препаратов микробного происхождения дает возможность значительно повысить концентрацию необходимых ферментов в среде и обеспечить глубокий гидролиз крахмала за сравнительно короткий период. Кроме стадии осахаривания ферментные препараты, обладающие сильной разжижающей активностью (α-амилаза), применяются на стадии водно-тепловой обработки сырья с целью смягчить режим разваривания, снизить вязкость замесов и облегчить их дальнейшую транспортировку. Применяя ферментные препараты на стадии приготовления сусла для дрожжегенерации, необходимо обеспечить интенсивный гидролиз белков с целью обогащения ценным азотистым питанием дрожжевого сусла. Таким образом, для спиртового производства, перерабатывающего крахмалсодержащее сырье, необходимо применение ферментных препаратов с амилолитическим, протеолитическим и цитолитическим действием. При замене солода культурами микроорганизмов или препаратами ферментов необходимо, чтобы полученный спирт обладал высокими дегустационными качествами и не содержал вредных примесей. Пивоварение. При производстве пива по обычной технологической схеме необходимые ферментные системы для подготовки зернового сырья и перевода экстрактивных веществ в растворимое состояние на стадии затирания образуются в процессе солодоращения. Основными ферментами, образующимися в процессе солодоращения и имеющими наиболее существенное значение в технологии пивоварения, являются: амилолитические ферменты, разжижающие и осахаривающие крахмал; протеолитические ферменты, расщепляющие белки ячменя до пептидов различной молекулярной массы и свободных аминокислот; цитолитические ферменты, гидролизующие некрахмальные полисахариды, растворяющие клеточные стенки эндосперма зерна, благодаря чему облегчается доступ амилаз и протеаз к соответствующим субстратам. Каждый из перечисленных процессов должен пройти с определенной глубиной, чтобы обеспечить нормальное протекание фильтрации затора, брожения сусла, осветление и фильтрацию пива, а также создание определенных физико-химических свойств (пенообразование, прозрачность, стойкость при хранении) и вкусовых качеств готового продукта. Применение ферментных препаратов микробного происхождения (амилоризин ПХ, П10Х, амилосубтилин Г10Х, Г20Х, протосубтилин Г10Х, цитороземин ПХ) с целью замены солода несоложенным ячменем позволяет интенсифицировать процесс, избежать потерь ценных компонентов сырья на дыхание и образование проростка, в целом повысить рентабельность пивоваренного производства. Кроме отечественных препаратов, в настоящее время широко используются ферментные препараты различных зарубежных фирм. Предназначенные для замены ферментов солода ферментные препараты микробного происхождения должны по характеру своего действия соответствовать ферментам солода и значительно превосходить их по активности. Ферменты, используемые для борьбы с холодной мутью. К образованию холодной мути в бутылочном пиве приводит рост микрорганизмов; такое биологическое помутнение предотвращается пастеризацией пива или стерильной фильтрацией при заполнении бутылок в асептических условиях. Небиологическое помутнение пива может происходить при его продолжительном хранении; этот процесс ускоряется при действии света, тепла, кислорода, в присутствии следов железа или меди, а также при одновременном воздействии этих факторов. Состав мути зависит от преобладающего действия того или иного из этих факторов. Основными составляющими холодной мути являются: белки — 40 — 76%; танин — 17 — 55%; углеводы — 3 — 13%. Холодная муть состоит из очень тонкого осадка, который образуется при выдержке пива при температурах ниже 10°С. Для борьбы с холодной мутью могут быть использованы растительные ферменты — папаин, фицин, бромелаин, а также грибные (продуцируемая микроскопическими грибами рода Aspergillus, Penicillium, Mucor, Amylomyces) и бактериальные (продуцируемая В. subtilis) протеазы. Но наиболее широко для этой цели применяется лишь папаин или комплексные препараты, включающие папаин и другие протеазы, что объясняется относительно высокой термостабильностью препаратов папаина, сохраняющих свою активность после пастеризации. 335:: 336:: 337:: Содержание 337:: 338:: 339:: 340:: 341:: 342:: 343:: 344:: Содержание ИММОБИЛИЗОВАННЫЕ ФЕРМЕНТЫ В различных пищевых технологиях долгое время применялись лишь препараты свободных ферментов, срок использования которых — один производственный цикл. Однако достижения молекулярной биологии, биохимии и энзимологии привели к тому, что в настоящее время строение и функции многих ферментов изучены очень детально и это позволило создать теоретическую базу для производства ферментов пролонгированного действия или иммобилизованных ферментов, т. е. фиксированных или связанных ферментных препаратов. Сущность иммобилизации ферментов заключается в присоединении их в активной форме тем или иным способом к инертной матрице (обычно это нерастворимый полимерный носитель). Иммобилизацию фермента можно определить и как включение молекулы фермента в какую-либо изолированную фазу, которая отделена от фазы свободного раствора, но способна обмениваться находящимися в ней молекулами субстрата, эффектора или кофактора. Фаза фермента обычно нерастворима в воде и часто представляет собой высокомолекулярный гидрофильный полимер, например, целлюлозу, полиакриламид, сефарозу и т. п. Принципы и способы иммобилизации. Включение фермента в изолированную фазу осуществляют различными способами: фермент может быть ко валентно связан с этой фазой, адсорбирован на ней или физически включен в нее. Возможны следующие способы иммобилизации фермента. 1. Ковалентное связывание. Молекула фермента ковалентно связывается с нерастворимым полимером. Полимер может быть в виде порошка или в форме пленки. Иногда молекулы фермента соединяются ковалентными связями друг с другом или с каким-либо инертным белком; при этом образуется нерастворимый, но активный полимерный фермент (рис. 8.11). 2. Электростатическое связывание. Этот способ иммобилизации основан на использовании электростатических или других нековалентных механизмов связывания (рис. 8.12). 3. Сополимеризация с помощью многофункциональных реагентов. Связывание молекул фермента с белками (например, с альбумином) или друг с другом осуществляется за счет использования определенных реагентов. В качестве такого многофункционального реагента часто используют глутаровый альдегид, гелеобразующее действие которого известно давно. В этом способе необходимо избегать взаимодействия реагента с активным центром фермента и ингибирования последнего (рис. 8.13).
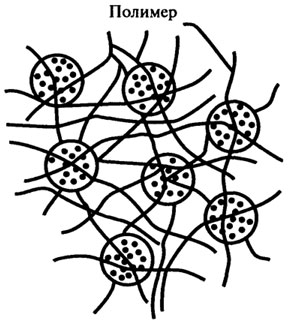
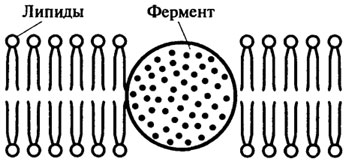
4. Включение в полимер. В этом способе фермент не прикреплен к полимеру, но удерживается внутри него, поскольку последний образует вокруг фермента сетеобразную матрицу (рис. 8.14). Ячейки этой матрицы настолько малы, что молекула фермента не может освободиться из сети, но в то же время достаточно велики для проникновения низкомолекулярных субстратов. Примером такого способа иммобилизации могут служить: а) включение в липосомы, когда фермент находится в водном растворе, окруженном фосфолипидным барьером (рис. 8.15); б) гидрофобное взаимодействие, когда фермент "погружен" в гидрофобную часть двойного липидного слоя (рис. 8.16).
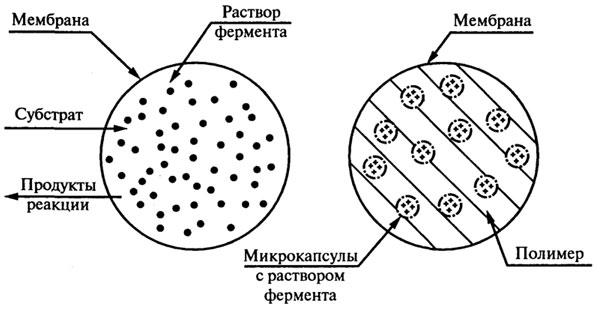
5. Инкапсулирование. Включение фермента в органическую или неорганическую капсулу, которая представляет собой полупроницаемую мембрану (рис. 8.17). Выбор способа иммобилизации. Искусство иммобилизации ферментов заключается в правильном выборе подходящего метода. Этот выбор
определяется целым рядом факторов, многие из которых невозможно выявить до тех пор, пока метод не будет опробован. Первичный отбор осуществляется обычно эмпирическим путем. Сначала нужно решить, необходим ли для прикрепления фермента какой-либо специфический носитель, не будет ли процедура иммобилизации инактивировать фермент и сможет ли иммобилизованный фермент действительно функционировать в тех условиях, при которых его предстоит использовать. Поэтому для успешной иммобилизации следует по возможности принять во внимание следующие факторы: — фермент должен быть стабильным в условиях протекания реакции; — реагенты, образующие поперечные сшивки, не должны взаимодействовать с химическими группировками активного центра. В связи с этим поперечно-сшивающий реагент должен быть как можно больших размеров, что будет препятствовать его проникновению в активный центр; — всегда, когда это осуществимо, необходимо тем или иным способом защищать активный центр фермента (например, обработка тиоловых ферментов глутатионом или цистеином); — процедура промывания для удаления "непришитого" фермента не должна оказывать вредного влияния на иммобилизованный фермент; — полимерная матрица не должна являться субстратом для иммобилизованного фермента; — необходимо, наконец, учитывать механические свойства носителя, особенно его механическую прочность и физическую форму. Процесс иммобилизации фермента можно продемонстрировать на примере связывания глюкоамилазы с носителем — ацетил этил целлюлозой. Носитель выдерживают сутки в дистиллированной воде для набухания. Далее к набухшей ацетилэтилцеллюлозе добавляют сначала натрий-ацетатный буфер с рН 5,5, а затем раствор очищенного фермента; после перемешивания к смеси добавляют поперечно-сшивающий агент — глутаровый альдегид. Через несколько часов полученный препарат промывают последовательно натрий-ацетатным буфером и раствором хлористого натрия для удаления несорбированного на носителе фермента. Иммобилизованный таким образом фермент хранится под слоем воды или буфера при 3 — 5°С. В настоящее время разработаны методы иммобилизации множества ферментов. Один и тот же фермент можно иммобилизировать несколькими методами. Например, глюкозоизомеразу из S. phaeochromogenes можно иммобилизовать на различных носителях: пористом алюминии, ДЭАЭ-целлюлозе, ДЭАЭ-крахмале и др. Лактатдегидрогеназу можно включить в гель, прикрепить к носителю поперечной сшивкой; аспарагиназу — прикрепить к носителю сорбционным путем или химической (ковалентной) связью. В табл. 8.4 представлены некоторые методы иммобилизации для различных ферментов. Влияние иммобилизации на ферментативную активность. Иммобилизация часто приводит к резким изменениям основных параметров ферментативной реакции: максимальной скорости (Vmax); константы Михаэлиса (Кт); оптимума рН и температуры, а также отношения к ингибиторам. Степень и природа этих изменений зависят не только от используемого метода иммобилизации, но и от типа ферментативной реакции. Большое влияние на ферментативную активность может оказывать полимерная матрица, причем это влияние может проявляться как в виде воздействия на микроокружение фермента, так и непосредственно на саму молекулу фермента. Кроме того, сами условия иммобилизации (значение рН, присутствие свободных радикалов, окисляющих агентов и т. п.) могут приводить к частичной или полной инактивации фермента. При рассмотрении влияния иммобилизации на ферментативную активность одним из важных является вопрос об эффективных кинетических параметрах. Параметры Кт и Vmax, используемые для характеристики каталитических свойств ферментов в разбавленных растворах (см. разд. 8.2), не могут быть применены в их строгом математическом значении для характеристики иммобилизованных ферментов, т. к. наблюдаются существенные отклонения от гиперболической субстратной кривой, описываемой уравнением Михаэлиса — Ментен, и искривления прямолинейных графиков в двойных обратных координатах (уравнение Лайнуивера — Берка). Таблица 8.4. Иммобилизация некоторых ферментов известными методами [М. Е. Бекер. Введение в биотехнологию, 1978]
По этой причине в случае иммобилизованных ферментов лучше заново определить физический смысл данных кинетических параметров. Ранее с этой целью использовался параметр "кажущаяся" Кm, но позднее было предложено пользоваться двумя константами: Kw и Vs. Vs — самая высокая скорость, которую можно достичь (теоретически) в данной системе, т. е. когда фермент полностью насыщен субстратом. Следовательно, этот параметр отражает исходные свойства иммобилизованного фермента, но на него могут влиять диффузионные ограничения. Kw — такая концентрация субстрата, при которой скорость реакции равна Vs/2. Этот параметр отражает реальные свойства субстрата и зависит от эффекта распределения и диффузионных ограничений. Величина Кm (кажущаяся) не может отражать истинного положения, т. к. варьирует в зависимости от выбранного диапазона концентраций субстрата. Например, ограничение диффузии субстрата сильнее проявляется при низких концентрациях субстрата, а эффект распределения более выражен при низких ионных силах. От этих двух факторов зависит видимая легкость связывания фермента с субстратом, и поэтому они оказывают существенное влияние на параметр Кm (кажущаяся). Необходимо также учитывать и возникновение кооперативных эффектов в поведении иммобилизованных ферментов в ответ на изменение концентрации субстрата. Иммобилизованные ферменты (в отличие от аллостерических, которые проявляют или только положительную, или только отрицательную кооперативность) способны обнаруживать оба вида кооперативности в зависимости от рН и микроокружения. Кооперативные эффекты имеют важное значение, т. к. позволяют выявить как значительные изменения скорости реакций в небольшом диапазоне концентраций субстрата, так и малые изменения скорости реакции в других, очень широких диапазонах концентраций субстрата. Применение иммобилизованных ферментов. Иммобилизованные ферменты как катализаторы многоразового действия можно использовать, в основном, для трех практических целей: аналитических, лечебных и препаративных. При решении вопроса о целесообразности использования системы с иммобилизованным ферментом следует руководствоваться следующими критериями: эффективностью, стоимостью и возможностью осуществить процесс с помощью другой системы. В случае препаративного (промышленного) применения основную роль играет стоимость, а также возможность автоматизации процесса. Несмотря на большие потенциальные возможности использования иммобилизованных ферментов в производстве, в настоящее время реализованы лишь немногие, например: — разделение D- и L-аминокислот, основанное на использовании плесневой аминоацилазы (Н. Ф. 3.5.1.14), иммобилизованной на ДЭАЭ-сефадексе; — получение сиропов с высоким содержанием фруктозы с использованием глюкозоизомеразы (Н.Ф.5.3.1.18), иммобилизованной на целлюлозном ионообменнике; — возможно использование иммобилизованных ферментов при производстве сыров, стабилизации молока и удалении лактозы из молочных продуктов. 337:: 338:: 339:: 340:: 341:: 342:: 343:: 344:: Содержание 344:: 345:: 346:: 347:: 348:: Содержание 8.5. ФЕРМЕНТАТИВНЫЕ МЕТОДЫ АНАЛИЗА Ферментативный анализ представляет собой один из основных аналитических инструментов в международной и отечественной практике научных исследований, современного производственного и сертификационного контроля качества продуктов питания, пищевого сырья и биологических материалов. Ферментативный анализ является составной частью энзимологии и аналитической химии и служит для специфического определения веществ с помощью высокоочищенных препаратов ферментов. В основе ферментативного анализа лежат природные биохимические процессы обмена веществ, которые воспроизводятся in vitro: реакция фермента с субстратом, причем в качестве субстрата выступает анализируемое вещество пробы. Основными преимуществами применения ферментативных методов в научных исследованиях, при разработке новых пищевых технологий и биотехнологических процессов, а также при анализе качества, идентификации и установления фальсификации продуктов питания и пищевого сырья являются: 1. Высокая специфичность и достоверность результатов. Высокоспецифичные ферментативные методы анализа дают, как правило, более достоверные результаты, чем неспецифические химические методы. Специфичность действия ферментов, основанная на комплементарное™ пространственной конфигурации активного центра и субстрата является гарантом достоверности и надежности ферментативного метода при исследовании отдельных соединений в многокомпонентных смесях, имеющих сложный состав и строение, таких, какими и являются пищевые продукты. При разработке ферментативных методов и подборе реагентов, в первую очередь, выбирают ферменты с наибольшей специфичностью действия, для которых подбираются оптимальные условия проведения анализа. Кроме того, при разработке методов ферментативного анализа отдельных компонентов продуктов питания обычно используют несколько ферментов, которые последовательно функционируют в данной системе. 2. Простые способы подготовки проб, которые исключают потерю исследуемых компонентов. Основная задача, которую необходимо выполнить при подготовке пробы, — по возможности наиболее полно сохранить для анализа исследуемый компонент без его количественной потери или изменения структуры. В некоторых случаях возможен прямой анализ пробы без ее предварительной подготовки (например, при абсолютной специфичности фермента к исследуемому веществу и отсутствии в пробе каких-либо мешающих факторов). Обычно же для ферментативного анализа используются простые и хорошо известные способы подготовки проб, такие как: разбавление, фильтрация (центрифугирование), нейтрализация (подкисление), экстракция, обезжиривание, осветление, обесцвечивание. Только в определенных случаях применяют специальные способы подготовки проб, например, при определении водонерастворимых соединений (холестерин, лецитин, крахмал), нестабильной L-аскорбиновой кислоты в твердых материалах и др. 3. Простая и быстрая процедура измерений, которая исключает использование дорогостоящего оборудования. В большинстве ферментативных определений используют фотометрические способы измерения результатов. Для этого все компоненты искусственной тестовой системы, например, буфер, коферменты, активаторы, вспомогательные ферменты и пробу смешивают в фотометрической кювете. После измерения начальной оптической плотности добавляют стартовый фермент, который инициирует реакцию. В конце реакции (через определенный промежуток времени) повторно измеряют оптическую плотность тестовой системы. Из разницы оптических плотностей в начале и в конце реакции по уравнению закона Ламберта — Бера рассчитывают концентрацию С (г/л) искомого соединения. C =
где (E 2 - E 1) опыт — разница конечной и начальной оптической плотности в кювете с пробой; (E 2 - E 1) контроль— разница конечной и начальной оптической плотности в кювете без пробы; V — общий объем реакционной смеси, мл; М — молярная масса искомого соединения, г/моль; F — фактор разведения пробы; ε — молярный коэффициент экстинкции (например, кофермента НАДФ/НАД при λ = 340 нм, ε = 6,3 л/ммоль ∙ см); d — толщина кюветы, см; v — объем пробы, добавляемый в кювету, мл. В большинстве ферментативных методов прямому фотометрическому контролю доступно измерение таких вспомогательных компонентов тестовой системы, как коферментов НАД+/ПАДН или НАДФ+/НАДФН. Количество восстановленных или окисленных коферментов прямопропорционально количеству искомого соединения. Система конечных значений с фотометрическим измерением результата настолько надежна, что Таблица 8.5. Применение ферментативных методов для анализа различных компонентов пищевых продуктов [А. Ю. Колесное. Ферментативный анализ в пищевой промышленности, 1996. № 11]
служит в качестве стандарта для оценки других методик. Для проведения ферментативного анализа используется стандартное оборудование, которое имеется практически в любой производственной лаборатории: спектрофотометры или фотометры с интервалом измерений от 325 до 800 нм; кюветы для фотометрических измерений, мерные пипетки и дозаторы, весы, центрифуга, рН-метр, водяной термостат, фильтры и т. п. 4. Высокая чувствительность метода и хорошая воспроизводимость результатов. Высокая чувствительность позволяет использовать ферментативные методы для определения следовых количеств веществ. Например, в продуктах питания могут быть определены следующие концентрации компонентов (г/л): этанол — 0,001; ацетоальдегид — 0,001; лимонная кислота — 0,002; глицерин — 0,001; D-глюкоза — 0,002; D-сорбит — 0,001; лактоза — 0,005; нитраты — 0,001. Кроме вышеперечисленных достоинств ферментативных методов анализа можно назвать и универсальность применения, высокую надежность и устойчивость к мешающим факторам, низкие затраты на проведение анализа (время, оборудование, расходуемые материалы), а также использование безопасных реактивов. Области применения ферментативного анализа на практике многообразны. Это и производственный контроль, и контроль качества готовой продукции, а также контроль сырья, анализ состава пищевого продукта с целью установления их свойств и соответствия законодательным нормам, оценка гигиенического статуса, идентификация и установление фальсификации. В табл. 8.5 приведены некоторые группы продуктов питания, а также их компоненты, для анализа которых разработаны специфические ферментативные методы. По словам одного из основоположников ферментативного анализа Г. Бергмана: " Ферментативный анализ, как принцип, свободен от недостатков и ошибок, т. к. он представляет систему для измерений, которую успешно использует живая клетка уже в течение миллионов лет". Контрольные вопросы 1. Каковы химическая природа и особенности ферментов как биологических катализаторов? 2. Что изучает кинетика ферментативных реакций? 3. Как влияет концентрация субстрата и фермента на скорость ферментативной реакции? 4. Как определяются основные кинетические параметры ферментативной реакции: V0; Vmax; Ks; Km? Почему именно V0 (начальная скорость) является мерой количества фермента? 5. Что такое ферментные препараты и каково их отличие от ферментов? 6. Какие ферменты наиболее широко применяются в пищевой промышленности? 7. По каким критериям оцениваются ферментные препараты с точки зрения их использования в той или иной пищевой технологии? 8. В чем заключаются особенности подхода при характеристике ферментов пищевого сырья и исследовании поведения ферментов (ферментных препаратов) в режиме определенной пищевой технологии? 9. Что такое иммобилизованные ферменты? 10. Каковы основные области применения ферментативного анализа на практике? Перечислите основные преимущества ферментативных методов исследования пищевых продуктов. 344:: 345:: 346:: 347:: 348:: Содержание 349:: 350:: 351:: 352:: 353:: 354:: 355:: 356:: 357:: Содержание ГЛАВА 9.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 403; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.108 (0.017 с.) |