
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опыт 5. Взаимодействие концентрированной серной кислотыСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
С металлами а) Взаимодействие концентрированной серной кислоты с медью. В пробирку поместить 1-2 кусочка медной стружки и прилить 5-10 капель концентрированной серной кислоты. Пробирку осторожно нагреть. Влажную синюю лакмусовую бумагу поднести к выделяющемуся газу. Отметить изменение окраски лакмусовой бумаги. По запаху (осторожно) определить, какой газ выделяется. Запись данных опыта. Написать уравнение реакции и указать, какой элемент в молекуле серной кислоты является окислителем? б) Взаимодействие концентрированной серной кислоты с цинком. В пробирку поместить кусочек цинка и налить 5-10 капель концентрированной серной кислоты. Пробирку слегка подогреть. К выделяющемуся газу над пробиркой поднести фильтровальную бумагу, смоченную раствором ацетата или нитрата свинца. Объяснить появление темного пятна на этой бумаге. Запись данных опыта. Описать наблюдаемые явления. Написать уравнения реакций взаимодействия концентрированной серной кислоты с цинком с образованием: а) оксида серы (IV); б) серы; в) сероводорода. Опыт 6. Неустойчивость тиосульфата натрия в кислой среде Внести в пробирку 5-6 капель раствора тиосульфата натрия Na2S2O3 и 3-4 капли 2 н серной кислоты. Запись данных опыта. Отметить выпадение серы. По запаху определить, какой газ выделился. Привести графическую формулу тиосульфата натрия. Написать уравнение реакции взаимодействия тиосульфата натрия с серной кислотой. Указать окислитель и восстановитель.
КОНТРОЛЬНЫЕ ВОПРОСЫ 1 В какой степени окисления сера может быть: а) только окислителем, б) только восстановителем, в) окислителем и восстановителем? Написать соответствующие электронные формулы. Привести примеры реакций. 2 Чем отличаются аллотропные видоизменения серы? 3 Какие вещества будут получаться при взаимодействии FeS: а) с хлороводородной кислотой, б) с концентрированной азотной? Написать соответствующие уравнения. 4 Написать графическую формулу тиосульфата натрия, указать степень окисления серы с этом соединении и объяснить его неустойчивость в кислой среде. 5 Почему сероводород проявляет только восстановительные свойства? 6 Можно ли в качестве осушителя для сероводорода, бромоводорода и иодоводорода применить концентрированную серную кислоту? Ответ мотивировать, написать соответствующие уравнения реакций.
7 Дописать уравнения реакций и расставить коэффициенты: а) H2S + HNO3(конц) = б) K2Cr2О7 + Na2S + H2SO4 = S + Cr2(SO4)3 +... в) Na2S2О3 + Zn + HCI (разб.) = S2- +... г) H2SO3 + KMnO4 = Mn2+ +... д) FeSO4 + K2S2O8 = Fe3+ +... 8 Составить уравнение гидролиза следующих солей: (NH4)2S, Na2SO3, K2SO4. Какая из солей не подвержена гидролизу? 9 Почему в производстве серной кислоты для растворения оксида серы(VI) используют не воду, а серную кислоту? Галогены Галогены — фтор, хлор, бром, иод — расположены в главной подгруппе седьмой группы периодической системы элементов. В атомах галогенов на внешнем энергетическом уровне находится по семь электронов (s2p5), и они могут присоединять один электрон, превращаясь в отрицательные ионы I. Отрицательную степень окисления галогены имеют в соединениях с водородом и металлами. Однако атомы галогенов, кроме фтора, могут проявлять и положительные степени окисления +1. +3, +5, +7. Это объясняется электронным строением атомов. Атом фтора имеет следующее электронное строение: F 1s22s22p5. Не имея d-подуровня и являясь наиболее электроотрицательным элементом, фтор может только принимать один электрон на 2р-подуровень, поэтому фтор бывает одновалентным, а степень его окисления всегда -1. Электронное строение атома хлора отличается от рассмотренного атома фтора: Cl 1s22s22p63s23p5. У атома хлора один неспаренный электрон на 3р-подуровне, и хлор в невозбужденном состоянии одновалентен. В возбужденном состоянии электроны с 3s-и Зр-подуровней переходят на Зd-подуровень, и валентность у хлора и его аналогов, кроме фтора, может быть + 1, +3, +5, +7. Различие в электронном строении атомов является причиной ряда особенностей в физических и химических свойствах фтора по сравнению с остальными галогенами. Так, фтороводородная кислота HF — слабая кислота; НС1, HBr, HI — сильные кислоты, причем сила их возрастает с ростом положительного заряда ядра атома галогена. Растворимость малорастворимых солей уменьшается в ряду AgCl, AgBr, Agl; в отличие от них AgF хорошо растворим в воде. Галогены являются энергичными окислителями, например:
Окислительная способность их уменьшается при переходе от фтора к иоду вследствие возрастания радиуса атома. Более активные галогены вытесняют менее активные, например:
2I- + Cl2 = I2 + 1Cl-. Фтор при обычной температуре и давлении представляет собой газ светло-желтого цвета, обладающий резким раздражающим запахом. Он очень ядовит, вызывает воспаление слизистых оболочек и сильные ожоги кожи. Получают фтор электролизом расплава фторида кальция — основного природного соединения фтора. Фтор — самый активный неметалл, при обычных условиях энергично разлагает воду: 2F2 + 2H2O=4HF + O2. С водородом фтор образует фтороводород — ядовитый газ с резким запахом. Раствор фтороводорода в воде образует фтороводородную кислоту, техническое название ее плавиковая кислота. Хлор — желто-зеленый газ с резким запахом, ядовитый, поражает дыхательные пути. Предельно допустимой концентрацией хлора в воздухе считается 0,001 мг/л, высокая концентрация вызывает тяжелые заболевания. Поэтому опыты получения или изучения свойств хлора проводят под тягой. Хлор приблизительно в 2,5 раза тяжелее воздуха. Кипит хлор при температуре -34 °С, жидкий хлор имеет желтый цвет, при его охлаждении образуется твердая масса желтого цвета. Растворимость хлора в воде при температуре 8 °С максимальная, она составляет 3,4 л хлора в 1 л воды. Получаемый раствор — желто-зеленого цвета. Называется хлорной водой. Физический процесс растворения сводится к простой гидратации молекул хлора. Образованный при обычной температуре гидрат хлора имеет формулу С12.8Н2О. Химический процесс взаимодействия между хлором и водой ведет к образованию хлорноватистой и хлороводородной кислот. Свежеприготовленный раствор хлора в воде содержит в своем составе СI2, НСI, НСIО. Ввиду неустойчивости хлорноватистой кислоты (НСIО = НСI + '/2О2), через некоторое время в растворе остается только НСI. Разложение хлорной воды ускоряется при повышении температуры, под действием ультрафиолетовых лучей, в присутствии активных восстановителей. Поэтому хранят ее в холодном месте, в темных, герметично закрытых склянках. Хлорная вода обесцвечивает красители, что обусловлено наличием атомарного кислорода, образующегося при взаимодействии хлора с водой:
В промышленности хлор получают электролизом поваренной соли. В химическом отношении хлор является очень активным элементом, но менее активным, чем фтор. Хлор соединяется почти со всеми элементами. Исключение составляют кислород, азот и углерод, соединения которых с хлором могут быть получены лишь косвенным путем. Особенно энергично хлор реагирует с металлами. Так, расплавленный металлический натрий сгорает в хлоре ослепительно ярким светом, образуя хлорид натрия. Медь, железо, олово и другие металлы, предварительно нагретые, также горят в хлоре, образуя соответствующие соли.
NaCI + H2SO4 = NaHSO4 + НСI. Это бесцветный газ с резким запахом, ядовитый, на воздухе дымит вследствие образования с парами воды капелек тумана, сильно раздражает дыхательные пути, хорошо растворяется в воде. Хлороводородная кислота относится к сильным кислотам, для нее характерны все реакции кислот: окрашивание индикаторами, взаимодействие с металлами, оксидами металлов, гидроксидами, солями.
Соли хлороводородной кислоты — хлориды. По растворимости они делятся на растворимые и малорастворимые. К растворимым относят хлориды щелочных и щелочноземельных металлов, хлориды цинка, меди, кобальта, железа(III). К малорастворимым — хлориды серебра, свинца, ртути и др. Известны и кислородные соединения хлора, некоторые из них имеют практическое применение, такие, как КClО3, СаОСl2, NaClO и др. Хлорноватистая кислота НСlО в свободном состоянии неизвестна, она существует только в растворах. Это слабая и неустойчивая кислота. Разложение ее ускоряется под влиянием нагревания, света, в присутствии катализаторов. При пропускании хлора в раствор щелочи, нагретый до 100 °С, образуются хлораты — соли хлорноватой кислоты НСlО3: 3Сl2 + 6КОН=ЗКСl + ЗКСlO+2Н2О, 3КСlO = КСlОз + 2КСl. Суммируем: 3СI2 + 6КОН = 5КСI + КСIО3 + ЗН2О. При нагревании до 400 °С в присутствии катализатора из хлоратов образуются перхлораты — соли хлорной кислоты НСIO4. 4КСIOз = ЗКСIO4 + КС1. В водных растворах хлорная кислота — самая устойчивая из всех кислородных кислот хлора; она же является и самой сильной кислотой. Безводная хлорная кислота дымит на воздухе, при нагревании взрывается. Бром — красно-бурая тяжелая жидкость. Бром обладает резким, неприятным запахом, ядовит. При 20 °С в 1 л воды растворяется 35,5 г брома, при этом образуется бромная вода, являющаяся смесью гидрата Вг2 8Н2O и кислот НВгО и НВг. Бром лучше растворяется в органических растворителях, например в сероуглероде CS2, хлороформе СНСI3, этиловом эфире (C2H5)2O, бензоле С6Н6, бензине, керосине, чем в воде. Иод представляет собой твердое вещество, образующее ромбические кристаллы в виде чешуек темно-серого цвета с металлическим блеском; пары иода имеют фиолетовую окраску. Иод обладает характерным неприятным запахом. Иод плохо растворяется в воде, в 1 л воды при 20 °С растворяется 0,3 г иода. В качестве индикатора для определения иодида применяют раствор крахмала. С крахмалом иод образует адсорбционные окрашенные соединения синего цвета, окраска которых исчезает при нагревании до 80 °С. Эта реакция настолько чувствительна, что дает возможность обнаруживать даже следовые количества иода. Подобно брому, иод также хорошо растворяется в органических растворителях. В растворителях, которые содержат в своем составе кислород, например Н2О, СНзОН, С2Н5ОН, (С2Н5)2О, (СНз)2СО и др., иод растворяется, образуя коричневый раствор. Эта окраска раствора указывает на образование сольватов. В растворителях, которые не содержат кислорода (например, СНСI3, CS2, ССI4, бензин и др.), иод растворяется, образуя растворы, окрашенные в фиолетовый цвет. Цвет иода в этих растворителях объясняется молекулярным состоянием его в растворах.
Бром и иод непосредственно соединяются со многими металлами и некоторыми неметаллами. Галогеноводороды НВг и HI — газообразные соединения, водные растворы которых являются кислотами, причем сила их возрастает с ростом положительного заряда ядра атома. Бром и иод в свободном состоянии получаются путем окисления НВг и HI и их солей различными окислителями. Бромоводород и иодоводород могут быть получены, как и хлороводород, при действии серной кислоты на их соли. Большинство солей НВг и HI хорошо растворимы в воде. Малорастворимы соли AgBr, AgI, HgI2. Галогениды серебра AgCI и AgBr растворяются в растворе аммиака вследствие комплексообразования: AgCl+2NH3=[Ag(NH3)2]Cl. ЛАБОРАТОРНАЯ РАБОТА
|
||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 793; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.220.89.112 (0.011 с.) |

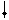 C12 + H2S = 2HC1 + S..
C12 + H2S = 2HC1 + S..
 Cl2 + H2O HCl + HCIO; НСIO НС1 + О.
Cl2 + H2O HCl + HCIO; НСIO НС1 + О. С водородом хлор образует хлороводород. Его получают прямым синтезом (H2 + CI2 = 2HCl) или при нагревании концентрированной серной кислоты с кристаллическим хлоридом натрия:
С водородом хлор образует хлороводород. Его получают прямым синтезом (H2 + CI2 = 2HCl) или при нагревании концентрированной серной кислоты с кристаллическим хлоридом натрия:


