
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Уфимский государственный нефтянойСодержание книги
Поиск на нашем сайте
УФИМСКИЙ ГОСУДАРСТВЕННЫЙ НЕФТЯНОЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
Лабораторный практикум по общей и неорганической химии для студентов специальности 320700 «Охрана окружающей среды и рациональное использование природных ресурсов»
Уфа 2004 В учебно-методическом пособии кратко описаны кинетика химических реакций, гидролиз растворов, комплексные соединения, окислительно-восстановительные и электрохимические процессы; приведены обзор свойств некоторых химических элементов и их соединений, а также руководство к выполнению лабораторных работ по данным темам. Пособие предназначено для студентов специальности 320700 «Охрана окружающей среды и рациональное использование природных ресурсов».
Составитель Бахонина Е.И., ассистент
Рецензент Елхова В.Д., доц., канд. техн. наук
ÓУфимский государственный нефтяной технический университет, 2004 ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ОБЩЕЙ ХИМИИ ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ Химическая кинетика – раздел химии, задача которого – объяснение качественных и количественных изменений химических процессов, происходящих во времени. Основным понятием в химической кинетике является понятие о скорости химической реакции: Скорость химической реакции определяется количеством вещества, прореагировавшего в единицу времени в единице объема. Если при неизменных объеме и температуре концентрация одного из реагирующих веществ уменьшилась от с1 до с2 за промежуток времени от t1 до t2, то в соответствии с определением скорость реакции равна n = -(c2-c1)/(t2-t1) = - Dc/Dt. Знак «-» в правой части уравнения обозначает следующее. По мере протекания реакции (t2-t1 > 0) концентрация реагентов убывает, следовательно, с2-с1<0, а так как скорость реакции всегда положительна, то перед дробью следует поставить знак «-». Обычно концентрации реагентов выражают в моль/л, а скорость реакции – в моль/(л.с). Скорость реакции зависит от природы реагирующих веществ и от условий, в которых реакция протекает. Важнейшим из них являются: концентрация. Температура и присутствие катализатора. Природа реагирующих веществ оказывает решающее влияние на скорость реакции. Так, например, водород с фтором реагирует очень энергично уже при комнатной температуре, тогда как с иодом значительно медленнее даже при нагревани и. Количественно зависимость между скоростью реакции и молярными концентрациями реагирующих веществ описывается основным законом химической кинетики – законом действующих масс. Состояние, в котором скорость обратной реакции становится равной скорости прямой реакции, называется химическим равновесием.
mA + nB pC + qD
согласно закону действующих масс скорости прямой реакции V1 и обратной V2 соответственно запишутся следующим образом: V1 = k1[A]m[B]n, V2 = k2[C]p[D]q. В момент достижения состояния химического равновесия скорости прямой и обратной реакции равны, т.е. k1[A]m[B]n = k2[C]p[D]q, или K = k1/k2 = ([C]p[D]q /([A]m[B]n), где К – константа равновесия, представляющая собой отношение констант скорости прямой и обратной реакций. В правой части уравнения стоят те концентрации взаимодействующих веществ, которые устанавливаются при равновесии – равновесные концентрации. Принцип Ле-Шателье (смещения равновесия). Состояние химического равновесия при неизменных внешних условиях теоретически может сохраняться бесконечно долго. В реальной действительности, при изменении температуры, давления или концентрации реагентов, равновесие может «сместиться» в ту или иную сторону протекания реакции. Изменения, происходящие в системе в результате внешних воздействий, определяются принципом подвижного равновесия – принципом Ле-Шателье. ЛАБОРАТОРНАЯ РАБОТА КОНТРОЛЬНЫЕ ВОПРОСЫ 1 Что называется скоростью химической реакции? В каких единицах она измеряется? 2 В чем различие реакций, происходящих в гомогенных системах и гетерогенных системах? 3 Почему при повышении концентрации реагирующих веществ и температуры скорость реакции увеличивается? 4 Какое состояние реакционной химической системы называется химическим равновесием? Почему химическое равновесие называют подвижным (динамическим)? 5 Какие методы ускорения течения реакций существуют? Что называется катализом? 6 Какова роль катализатора в химической реакции? Влияет ли катализатор на состояние химического равновесия? ГИДРОЛИЗ СОЛЕЙ Обменная реакция веществ с водой, при которой происходит изменение концентрации водородных ионов, т.е. рН раствора, называется гидролизом. Взаимодействие с водой протекает часто ступенчато, с различной глубиной, с образованием комплексов в зависимости от условий и природы реагирующих веществ. Гидролизу подвергаются разные вещества: соли, галогенангидриды, карбиды, углеводы, белки, жиры и т.д. Осахаривание крахмала, гидролиз древесины, получение мыла и другие важные производства основаны на гидролизе. Весьма важное значение имеет гидролиз солей. Он протекает только в тех случаях, когда из ионов соли и ионов воды может образовываться хотя бы одно слабодиссоциирующее или очень мало растворимое вещество. Образование такого вещества сопровождается связыванием одного из ионов воды, смещением равновесия диссоциации воды и изменением рН раствора. В зависимости от характера солей различают три основных вида их гидролиза: 1) гидролиз солей; образованных слабым основание и сильной кислотой: NH4, CuCI2, AI2(SO4)3, SnCI2 и др. гидролиз таких солей идет по катиону (рН<7):
Если катион многозарядный, то в результате гидролиза образуется чаще всего не слабое основание, а основная соль. Гидролиз идет ступенчато:
В растворе накапливаются ионы H+ , которые препятствуют прохождению гидролиза по II и тем более по III ступени; 2) гидролиз солей, образованных слабой кислотой и сильным основанием: Na2CO3, KCN, Na2SO3, KNO2 и др. (рН>7):
Соли, образованные сильным основанием и слабой многоосновной кислотой, гидролизуется ступенчато с образованием кислых солей.
Гидролиз идет, в основном, только по I ступени, т.к. появившиеся гидроксид-ионы препятствуют прохождению гидролиза по II ступени, т.е. смещают равновесие второй реакции влево; 3) гидролиз солей, образованных слабым основанием и слабой кислотой. Соли этого типа легче других подвергается гидролизу, т.к. одновременно связываются ионы Н+ и ОН-. В зависимости от зарядности катиона и аниона при гидролизе таких солей могут образовываться слабое основание и слабая кислота, слабая кислота и основная соль, слабое основание и кислая соль.
При гидролизе солей, образованных слабым основанием и слабой кислотой, рН раствора может быть равен 7, если образуется кислота и основание одинаковые по силе. Некоторые из солей, образованные очень слабым основанием и очень сильной кислотой, подвергаются необратимому гидролизу. Например, полному гидролизу подвергаются сульфиды и карбонаты трехзарядных катионов (AI3+, Fe3+, Cr3+). Поскольку гидролиз принадлежит к числу обратимых процессов, то положение его равновесия может быть смещено в ту или иную сторону изменением концентрации веществ, участвующих в реакции, а также температуры раствора. Так, разбавляя раствор, т.е. увеличивая в нем относительную концентрацию воды, на основании принципа Ле Шателье можно увеличить степень гидролиза. Наоборот, приливая кислоту в растворы, имеющие кислую реакцию, или щелочь в растворы с щелочной реакцией, можно получить степень гидролиза. С повышением температуры раствора степень гидролиза соли увеличивается. Таким образом, для того, чтобы соли не повергались гидролизу, их необходимо хранить при более низкой температуре и в более высокой концентрации. ЛАБОРАТОРНАЯ РАБОТА Цинка (II) В раствор хлорида цинка (II) опустите кусочек цинка и нагрейте. Объясните выделение водорода. Напишите уравнения происходящих реакций. КОНТРОЛЬНЫЕ ВОПРОСЫ 1 Что называется гидролизом солей? 2 Какие соли подвергаются гидролизу? Обосновать. 3 Когда гидролиз солей происходит ступенчато? Привести примеры. 4 Что представляет собой степень гидролиза? От чего она зависит? 5 В каких случаях происходит смещение равновесия гидролиза? 6 Когда достигается максимальная степень гидролиза? РЕАКЦИИ Во многих химических реакциях происходит перемещение электронов от одних частиц к другим. Такие реакции называют окислительно-восстановительными. Для характеристики состояния элементов в соединениях введено понятие степени окисления. Число электронов, смещенных от атома данного элемента или к атому данного элемента в соединении, называют степенью окисления. Положительная степень окисления обозначает число электронов, которые смещаются от данного атома, а отрицательная степень окисления – число электронов, которые смещаются к данному атому. Из этого определения следует, что в соединениях с неполярными связями степень окисления элементов равна нулю. Примерами таких соединений служат молекулы, состоящие из одинаковых атомов (N2, H2, CI2) Большинство элементов могут проявлять разную степень окисления в соединениях. При определении их степени окисления пользуются правилом, согласно которому сумма степеней окисления элементов в электронейтральных молекулах равна нулю, а в сложных ионах – заряду этих ионов. Любая окислительно восстановительная реакция состоит из процессов окисления и восстановления. Окисление – это отдача электронов веществом, т.е. повышение степени окисления элемента. В качестве примера рассмотрим реакцию окисления цинка: Zn0 – 2e- = Zn2+ . Как видно, степень окисления цинка повышается от 0 до +2. Вещества, отдающие свои электроны в процессе реакции, называют восстановителями. Восстановление – это смещение электронов к веществу или понижение степени окисления элемента. Например реакция восстановления иона Н+ 2Н+ + 2е- = Н20 Вещество, принимающее электроны, называется окислителем. В данной реакции окислителем будет ион Н+. В результате реакции степень окисления элемента понижается. Поэтому можно сказать, что вещество из окисленной формы превращается в восстановительную. Раздельное протекание реакций окисления и восстановления происходит лишь в электрохимических процессах. В химических окислительно-восстановительных реакциях окисление и восстановление взаимосвязаны. Реакции, в которых окислители и восстановители представляют собой различные вещества, называют межмолекулярными:
С + О2 = СО2. В некоторых реакциях окислителями и восстановителями могут быть атомы одной и той же молекулы. Такие реакции называют внутримолекулярными. Обычно это реакции разложения веществ, например:
N2Н4 = N2 + 2Н2. В данной реакции степень окисления азота увеличивается (окисление), а степень окисления водорода уменьшается (восстановление). Разновидностью окислительно-восстановительных реакций является диспропорционирование (самоокисление – самовосстановление), при котором происходит окисление и восстановление атомов или ионов одного и того же элемента, например:
3Н2МnО4 = 2НМnО4 + МnО2 + 2Н2О.
В окислительно-восстановительных реакциях наряду с окислителями и восстановителями могут участвовать ионы или молекулы среды. Например, в реакции окисления сульфита калия перманганатом калия участвует серная кислота:
2К2SО3 +2КМnО4 + 3Н2SО4 = 6К2SО4 + 2МnSО4 +3Н2О.
ЛАБОРАТОРНАЯ РАБОТА Простых веществ а) Налить в пробирку 2-3 мл раствора нитрата ртути (II) и опустить в раствор медную полоску. Что происходит? Составить уравнение реакции, указать окислитель и восстановитель. Сделать вывод о сравнительной активности меди и ртути. Полоску, покрытую ртутью, сдать преподавателю! б) К 2-3 каплям раствора иодида калия прилить 5-6 капель раствора серной кислоты и 2-3 капли раствора иодата калия KJO3.Отметить изменение окраски раствора. Добавьте в полученную смесь несколько капель крахмала. Какое вещество определяют крахмалом? Составьте уравнение реакции, определите окислитель и восстановитель. Сделайте вывод об окислительно-восстановительных свойствах иода в разных степенях окисления. КОНТРОЛЬНЫЕ ВОПРОСЫ
1 Что называется степенью окисления? 2 Какие вещества являются окислителями, восстановителями? 3 Какие типы окислительно-восстановительных реакций существуют? Привести примеры. 4 Каким соединениям присуща окислительно-восстановительная двойственность? 5 Методом электронного баланса подберите коэффициенты в окислительно-восстановительных реакциях:
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Комплексными соединениями называются определенные химические соединения, образованные сочетанием отдельных компонентов и представляющие собой сложные ионы или молекулы, способные к существованию как в кристаллическом, так и в растворенном состоянии. В молекуле комплексного соединения один из атомов, обычно положительно заряженный, занимает центральное место и называется комплексообразователем, или центральным атомом. В непосредственной близости к нему расположены (координированы) противоположно заряженные ионы или нейтральные молекулы, называемые лигандами. Коплексообразователь и лиганды составляют внутреннюю сферу комплексного соединения. Общее число s-связей, образуемых комплексообразователем с лигандами, называется координационным числом центрального иона. По числу s-связей, образуемых лигандом с комплексообразователем лиганды делятся на моно -, ди - и более дентатные лиганды. За пределами внутренней сферы комплексного соединения находится его внешняя сфера, содержащая положительно заряженные ионы (если внутренняя сфера комплексного соединения заряжена отрицательно) или отрицательно заряженные ионы (если комплексный ион заряжен положительно); в случае незаряженной внутренней сферы внешняя сфера отсутствует. Ионы, находящиеся во внешней сфере, связаны с комплексным ионом, в основном, силами электростатического взаимодействия и в растворах легко отщепляются подобно ионам сильных электролитов. Лиганды, находящиеся во внутренней сфере комплекса, связаны с комплексообразователем ковалентными связями, и их диссоциация в растворе осуществляется, как правило, в незначительной степени. Поэтому с помощью качественных химических реакций обычно обнаруживаются только ионы внешней сферы. В формулах комплексных соединений внутреннюю сферу отделяют от внешней квадратными скобками. Названия комплексных солей образуют по общему правилу: сначала называют анион, а затем – катион в родительном падеже. При этом в названии аниона употребляется корень латинского наименования комплексообразователя, а в названии катиона – его русское наименование в родительном падеже. Название комплексного катиона составляют следующим образом: сначала указывают числа (используя греческие числительные: ди, три, тетра, пента, гекса и т.д.) и названия отрицательно заряженных лигандов с окончанием «о» (CI- - хлоро,SO42- -сульфато, ОН- - гидроксо и т.п.); затем указывают числа и названия нейтральных лигандов, причем вода называется аква, а аммиак – аммин; последним называют комплексообразователь, указывая степень его окисленности (в скобках римскими цифрами после названия компексообразователя). Название комплексного аниона составляют аналогично названию катиона и заканчивают суффиксом «ат». Названия нейтральных комплексных частиц образуют так же, как и катионов, но комплексообразователь называют в именительном падеже, а степень его окисленности не указывают, так как она определяется электронейтральностью комплекса. Например, [Pt(NH3)2CI2] – дихлордиамминплатина. По принадлежности к определенному классу соединений различают: Комплексные кислоты – H2[SiF6], H[AuCI4]; Комплексные основания – [Ag(NH3)2]OH, [Co(En)3](OH)3; Комплексные соли – K2[HgJ4], [Cr(H2O)6]CI3. По природе лигандов. Если лигандом является вода, комплексы называются аквакомплексами: [Co(H2O)6]SO4, [Cu(H2O)4](NO3)2. Комплексы, образованные аммиаком, - аммиакаты: [Ag(NH3)2]CI, [Cu(NH3)2]CI, [Cu(NH3)4]SO4, [Co(NH3)6]CI2. оксалатные, карбонатные, цианидные, галогенидные и другие комплексы, содержащие в качестве лигандов анионы различных кислот, называют ацидокомплексами. Например, K4[Fe(CN)6] и K2[HgJ4] – цианидный и иодидный ацидокомплексы. Соединения с ОН-группами в виде лигандов называют гидроксокомплексами, например: K3[AI(OH)6]. По знаку заряда комплекса различают: Катионные комплексы – [Co(NH3)6]CI3, [Zn(NH3)4]CI2; Анионные комплексы – Li[AIH4], K2[Be(CO3)2]; Нейтральные комплексы – [Pt(NH3)2CI2], [Co(NH3)3CI3]. Нейтральные комплексы не имеют внешней сферы. Более сложными являются бикомплексы, состоящие из комплексных катионов и анионов, например [Co(NH3)6][Fe(CN)6].
ЛАБОРАТОРНАЯ РАБОТА
Опыт 1. Свойства некоторых аквакомплексов (кристаллогидратов) В фарфоровые тигли поместите 1–2 микрошпателя кристаллогидратов CuSO4·5Н2О, CoCl2·6H2O, CrCl3·6H2O, NiSO4·7H2O. Нагревайте кристаллогидраты на плитке, перемешивая их время от времени стеклянной палочкой. Обратите внимание на изменение цвета кристаллов. После того, как тигли остынут, добавьте в них 1–2 капли воды и вновь отметьте изменение окраски раствора. Объясните, почему изменяется окраска исследуемых веществ при нагревании и при растворении. Напишите уравнения реакций. КОНТРОЛЬНЫЕ ВОПРОСЫ
1 Что такое комплексообразователь, лиганд, внутренняя и внешняя сфера комплексного соединения? 2 Как определяется степень окисления и координационное число комплексообразователя? 3 Как классифицируются комплексы по характеру заряда и природе лигандов? 4 Как составляются название комплексных соединений? 5 Даны комплексные соединения: K2[ZnCl4], [Zn (OH2 )4]Cl2, K2[Zn(OH)4], [Ni (NH3)6]Cl2, [Pt(NH3)4Cl2] [Cr(NH3)3 (ОН2)3]Cl3, K3[FeF6]. а) отметьте внутреннюю и внешнюю сферу комплексных соединений, комплексообразователь и лиганды; б) определите заряд комплексного иона, степень окисления и координационное число комплексообразователя; в) какие из соединений содержат катионный комплекс, какие – анионный и какие комплексы электронейтральны; г) приведите названия соединений. 6 Что характеризует константа нестойкости комплексного соединения? Напишите выражение константы нестойкости для комплексного соединения К4[Fe(СN)6]. Как можно сместить равновесие диссоциации комплексного иона в правую сторону? Каковы последствия этого смещения? 7 Какова природа химической связи во внутренней сфере комплексного соединения? 8 Как можно по числу свободных валентных орбиталей комплексообразователя определить его координационное число и возможный тип гибридизации валентных орбиталей? КОРРОЗИЯ МЕТАЛЛОВ Коррозия, т.е. самопроизвольное разрушение металлов и сплавов в результате химического или электрохимического взаимодействия металлов со средой, относится к гетерогенным процессам. Различают газовую и электрохимическую коррозию. Газовая коррозия – коррозия металлов при высокой температуре газов. Важным фактором, определяющим скорость газовой коррозии (разрушение металла на единице поверхности в единицу времени), является сплошность образующихся пленок. При соотношении Защита от газовой коррозии осуществляется легированием элементами, способствующими образованию пленок с высокими защитными свойствами, покрытиями и т.п. При электрохимической коррозии на поверхности металлов и сплавов протекают одновременно два процесса: анодный – процесс окисления металлов: Ме = Меn+ + ne-
2Н+ + 2е- = Н2 или восстановления молекул кислорода, растворенного в электролите: О2 + 2Н2О + 4е- = 4ОН- Ионы или молекулы, которые восстанавливаются при протекании катодного процесса, называются деполяризаторами. В зависимости от характера катодного процесса различают коррозию с водородной и кислородной деполяризацией. Электрохимическая коррозия может протекать только в том случае, когда равновесный электродный потенциал катодной реакции больше равновесного электродного потенциала анодной реакции. На технических сплавах катодный и анодный процессы могут протекать раздельно на разных участках поверхности. Участки с более отрицательным потенциалом называются анодными, на них протекает анодный процесс, а участки с более положительным потенциалом – катодными, на них протекают катодные процессы. Катодные и анодные участки образуют коррозионные гальванические элементы, работа которых во многих случаях определяет скорость и характер коррозии. Возникновение коррозионных гальванических элементов в большинстве случаев объясняется структурной неоднородностью (гетерогенностью) сплавов. Так, например, в углеродистых сталях роль катодных участков выполняет карбид железа – цементит, а роль анодных участков – остальная поверхность стали. Коррозионные элементы образуются также при контакте металлов с различными потенциалами. В этих случаях металл с более отрицательным потенциалом разрушается (работает анодом), а на металле с более положительным потенциалом протекает катодный процесс. Образующиеся при коррозии с кислородной деполяризацией трудно растворимые гидроксиды металлов уменьшают скорость коррозии. Изменение рН среды может приводить к растворению пленки гидроксидов, в результате чего скорость коррозии увеличивается. Так, например, при коррозии цинка образуется Zn(OH)2, который обладает амфотерными свойствами – растворяется в кислой и щелочной среде. Поэтому скорость коррозии цинка увеличивается как при уменьшении, так и при увеличении рН. Для защиты от электрической коррозии применяются металлические и неметаллические покрытия, протекторная и катодная защита внешним током. Металлические покрытия в зависимости от соотношения электродных потенциалов покрытия и основного металла разделяются на анодные, когда потенциал покрытия более отрицательный, чем основного металла, и катодные, электродный потенциал которых более положительный. При нарушении анодного покрытия, например, цинкового покрытия на стали, образуется пара Fe-Zn, в которой цинк работает анодом, а железо катодом и не разрушается. При нарушении катодного покрытия, например медного покрытия на стали, образуется пара Fe-Cu, в которой железо работает анодом и разрушается. Протекторная защита состоит в том, что к защищаемой детали, работающей в воде или почве, присоединяется металл с более отрицательным электродным потенциалом (протектор), в результате чего в паре железо-протектор железо работает катодом и не корродирует. При катодной защите внешним током защищаемая деталь присоединяется к катоду внешнего источника тока, а к аноду – дополнительный электрод. При этом защищаемая деталь работает катодом и не корродирует.
ЛАБОРАТОРНАЯ РАБОТА
Опыт 2. Образование микрогальванопар Поместите кусочек гранулированного цинка в пробирку и прилейте несколько мл разбавленной серной кислоты. Обратите внимание на медленное выделение водорода. Прилейте в пробирку несколько капель раствора сульфата меди. Что наблюдается? Объясните результат опыта. КОНТРОЛЬНЫЕ ВОПРОСЫ 1 Как происходит атмосферная коррозия луженого и оцинкованного железа при нарушении покрытия? Составьте электронные уравнения анодного и катодного процессов. 2 Какое покрытие металла называется анодным и какое – катодным? Назовите несколько металлов, которые могут служить для анодного и катодного покрытия железа. Составьте электронные уравнения анодного и катодного процессов, происходящих при коррозии железа, покрытого медью, во влажном воздухе и в кислой среде. Железное изделие покрыли никелем. Какое это покрытие – анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в хлороводородной (соляной) кислоте. 3 Какие продукты коррозии образуются в первом и во втором случаях? 4 Составьте электронные уравнения анодного и катодного процессов с кислородной и водородной деполяризацией при коррозии пары магний-никель. Какие продукты коррозии образуются в первом и во втором случаях? 5 В раствор хлороводородной (соляной) кислоты поместили цинковую пластинку и цинковую пластинку, частично покрытую медью. В каком случае процесс коррозии цинка происходит интенсивнее? Ответ мотивируйте, составив электронные уравнения соответствующих процессов. 6 Почему химически чистое железо более стойко против коррозии, чем техническое железо? Составьте электронные уравнения анодного и катодного процессов, происходящих при коррозии технического железа во влажном воздухе и в кислой среде. 7 Если гвоздь вбить во влажное дерево, то ржавчиной покрывается та его часть, которая находится внутри дерева. Чем это можно объяснить? Анодом или катодом является эта часть гвоздя? Составьте электронные уравнения соответствующих процессов. 8 Железные бочки применяют для транспортировки концентрированной серной кислоты, но после освобождения от кислоты бочки часто совершенно разрушаются вследствие коррозии. Чем это можно объяснить? Что является анодом и что катодом? Составьте электронные уравнения соответствующих процессов.
Химия элементов Подгруппа МЕДи К побочной подгруппе первой группы относятся медь (Cu), серебро (Ag) и золото (Au). Медь и ее аналоги являются предпоследними d -элементами, атомы которых содержат полностью заполненный электронами d -подуровень. Резкие отличия металлов подгруппы меди от щелочных металлов обусловлены наличием в их атомах электронной конфигурации d 10 и возможным при возбуждении переходом электронов из d - в р -подуровень. Поэтому Cu, Ag и Au способны проявлять переменную степень окисления от +1 до +3 и +5 у золота. Это единственные элементы, степень окисления которых выше номера их группы. Более высокие значения ионизационных потенциалов и меньшие радиусы атомов меди, серебра и золота, чем для щелочных металлов, обусловливают более слабые металлические свойства элементов подгруппы меди. Для золота степень окисления +3 весьма характерна, для серебра типична степень окисления +1, для меди +2. Медь, серебро и золото – блестящие металлы красного (Cu), белого (Ag) и желтого (Au) цвета, обладающие исключительной пластичностью и ковкостью. Элементы подгруппы меди превосходят все остальные металлы по величине электрической проводимости и теплопроводности. Медь, серебро и золото малоактивны, они с трудом окисляются, а ин ионы (Mn+) легко восстанавливаются. При наличии в воздухе сероводорода может образоваться на серебре черный налет Ag2S. На поверхности меди во влажном воздухе с участием диоксида углерода образуется карбонат гидроксомеди (II) (CuOH)2CO3. Разбавленная серная кислота на медь и серебро не действует. Реакция с соляной кислотой может протекать только при участии окислителя, например: 2Cu + 4HCI + O2 = 2CuCI2 + 2H2O. Медь и серебро взаимодействуют с азотной и концентрированной серной кислотами с образованием солей Cu (II) и Ag (I). Золото с этими кислотами не взаимодействует, но реагирует с горячей концентрированной селеновой кислотой: 2Au + 6H2SeO4 = Au2(SeO4)3 + 3H2O. Лучшим растворителем золота является раствор соляной кислоты, насыщенный хлором, и «царская водка». Оксиды и гидроксиды. Медь образует оксиды: черный CuO и красные Cu2O и Cu2O3 (малоустойчивый) Кислородом медь окисляется при 500 оС до CuO; выше 800 оС оксид меди (II) разлагается на Cu2O и O2. Оксид Cu2O3 можно получить действием окислителей на Cu(OH)2: при нагревании Cu2O3 разлагается на CuO и O2. Оксид серебра (I) Ag2O получается при действии щелочей на растворы солей серебра: 2AgNO3 + 2 NaOH = Ag2O + 2NaNO3 + H2O. Оксид серебра (II) образуется при окислении серебра озоном. Оксид золота (III) Au2O3 (коричневый) может быть получен при осторожном нагревании гидроксида Au(OH)3 до 150 оС. Этот оксид выше 160 оС разлагается на Au и O2. Оксиды элементов подгруппы меди в воде не растворяются. С концентрированными растворами щелочей Cu2O и Ag2O взаимодействуют с образованием гидрокомплексных соединений. Гидроксид меди (II) амфотерен. При нагревании Cu(OH)2 легко переходит в CuO. С кислотами гидроксид меди (II) и оксид CuO образуют аквакомплексные соединения. С концентрированными щелочами Cu(OH)2 дает куприты синего цвета: Cu(OH)2 + 2NaOH = Na2[Cu(OH)4]. Гидроксид меди (II) взаимодействует с водным раствором аммиака, образуя аммиакат меди синего цвета: Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2. Оксид Au2O3 и гидроксид Au(OH)3 – амфотерные соединения с преобладанием кислотных свойств. Так Au(OH)3 легко взаимодействует с избытком щелочей и образованием ауратов: Au(OH)3 + NaOH = Na[Au(OH)4]. Гидроксид Au(OH)3 осаждают из раствора AuCI3 или H[AuCI4] щелочью (без избытка):
Au(OH)3 – «золотая кислота», вещество красно-бурого цвета, при просушивании над Р2О5 переходит в желто-красный порошок НАuO2. Соли меди (II) нерастворимы в воде и легко окисляются кислородом воздуха. Для них характерна также реакция диспропорционирования:
Голубой цвет солей Cu(II) в разбавленных растворах обусловлен наличием аквакомплексных ионов [Cu(H2O)4]. Медь образует галогенидные комплексы при добавлении HCI, HBr или LiCI, LiBr к растворам солей меди (II): CuCI2 + 2HCI = H2[CuCI4]. Растворимые соли меди гидролизуются с образованием малорастворимых основных солей: 2CuSO4 + 2H2O = (CuOH)2SO4 + H2SO4; 2CuSO4 + 2Na2CO3 + H2O = (CuOH)2CO3 + CO2 +2Na2SO4. Распространены соли серебра (I); AgO3 хорошо растворяется, трудно растворимы галогениды – AgCI (белый), AgBr и AgI (светло-желтые). Нитрат серебра служит исходным продуктом для приготовления остальных соединений серебра. Поэтому их широко используют для нанесения светочувствительных слоев на фотобумаге, пленке и т.д. Все соли серебра легко восстанавливаются с выделением металлического серебра. Основным веществом для получения соединений золота является коричнево-красный AuCI3, получаемый при действии избытка хлора на порошок золота при нагревании. Медь применяется в виде металла, многочисленных сплавов и соединений. Около 40 % всей добываемой меди идет на изготовление электрических проводов и кабелей. Из меди изготовляют нагревательные аппараты. Сплавы меди с другими металлами широко применяются в машиностроительной промышленности, в электротехнике, в судостроении, энергетической промышленности. Соединения меди находят широкое применение в химической промышленности, стекольной промышленности (для окраски стекол), сельском хозяйстве. Из солей меди вырабатывают различные минеральные краски. В химической промышленности серебро используют для производства предметов лабораторного оборудования, устойчивых к действию щелочных растворов. Галогениды серебра потребляет фотопромышленность. Серебро используется для приготовления медицинских препаратов. Золото применяют в электронике и электротехнике для изготовления электрических контактов, электродов.
Лабораторная работа Из растворов Погру
|
||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 270; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.227.140.100 (0.02 с.) |

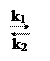 Состояние химического равновесия обратимых процессов количественно характеризуется константой равновесия. Так, для обратимой реакции, которую в общем виде можно записать как
Состояние химического равновесия обратимых процессов количественно характеризуется константой равновесия. Так, для обратимой реакции, которую в общем виде можно записать как NH4NO3 + H2O NH4OH + HNO3
NH4NO3 + H2O NH4OH + HNO3 NH4+ + NO3- + H-OH NH4OH + H+ + NO3-
NH4+ + NO3- + H-OH NH4OH + H+ + NO3- NH4+ + H-OH NH4OH + H+
NH4+ + H-OH NH4OH + H+ AICI3 + H-OH AIOHCI2 + HCI
AICI3 + H-OH AIOHCI2 + HCI AI3+ + H-OH AIOH2+ + H+ (I ступень)
AI3+ + H-OH AIOH2+ + H+ (I ступень) AIOH2+ + H-OH AI(OH)2+ + H+ (II ступень)
AIOH2+ + H-OH AI(OH)2+ + H+ (II ступень) AI(OH)2+ + H2O AI(OH)3 + H+ (III ступень)
AI(OH)2+ + H2O AI(OH)3 + H+ (III ступень) KCN + H-OH HCN + KOH
KCN + H-OH HCN + KOH K+ + CN- + H-OH HCN + K+ + OH-
K+ + CN- + H-OH HCN + K+ + OH- CN- + H-OH HCN + OH-
CN- + H-OH HCN + OH- Na2CO3 + H-OH NaHCO3 + NaOH
Na2CO3 + H-OH NaHCO3 + NaOH CO32- + H-OH HCO3- + OH- (I ступень)
CO32- + H-OH HCO3- + OH- (I ступень) HCO3- + H-OH H2CO3 + OH- (II ступень)
HCO3- + H-OH H2CO3 + OH- (II ступень) (NH4)2S + H2O NH4OH + NH4HS
(NH4)2S + H2O NH4OH + NH4HS 2NH4+ + S2- + H-OH NH4OH + NH4+ + HS-
2NH4+ + S2- + H-OH NH4OH + NH4+ + HS- а) K2S + KМnO4 + Н2SO4 S + MnSO4 + K2SO4 + H2O
а) K2S + KМnO4 + Н2SO4 S + MnSO4 + K2SO4 + H2O б) Zn + K2CrO7 + H2SO4 ZnSO4 + Cr2(SO4) + H2SO4 + H2O
б) Zn + K2CrO7 + H2SO4 ZnSO4 + Cr2(SO4) + H2SO4 + H2O в) NaJ + KMnO4 + KOH J2 + K2MnO4 + NaOH
в) NaJ + KMnO4 + KOH J2 + K2MnO4 + NaOH пленки сплошные, а при
пленки сплошные, а при  пленки могут быть сплошными и тормозить процесс коррозии.
пленки могут быть сплошными и тормозить процесс коррозии. и катодный – процесс восстановления ионов водорода:
и катодный – процесс восстановления ионов водорода: AuCI3 + 3NaOH = 3NaCI + Au(OH)3 .
AuCI3 + 3NaOH = 3NaCI + Au(OH)3 . 2CuCI CuCI2 + Cu.
2CuCI CuCI2 + Cu.


