
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опыт 5. Гидролиз солей алюминияСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте В пробирку налить 2 мл дистиллированной воды и добавить 1-2 кристаллика или 2-3 капли раствора соли алюминия. Определить среду с помощью универсального лакмуса. Написать молекулярное и ионное уравнение первой ступени гидролиза. Почему гидролиз данной соли не идет до конца? Какие продукты получаются в результате реакции? Как можно уменьшить или усилить гидролиз этой соли?
Контрольные вопросы 1 Почему алюминий, являясь активным металлом, не реагирует с водой при обычных условиях? 2 Что такое пассивация металлов? Приведите примеры. 3 Может ли алюминий растворяться в водном растворе карбоната натрия? Объяснить. 4 Можно ли хранить кислые продукты в алюминиевой посуде? Объяснить. 5 Какие продукты образуются при сливании растворов нитрата алюминия и карбоната калия? Составить соответствующие уравнения реакций в молекулярном и молекулярно-ионном видах. 6 Написать молекулярные и молекулярно-ионные уравнения следующих превращений:
Al2O3 АЗОТ Азот — элемент V группы главной подгруппы периодической системы. Атом азота на внешнем энергетическом уровне содержит пять электронов в состоянии s2p3. Поэтому высшая степень окисления равна +5, низшая —3. Атом азота имеет следующее электронное строение:
В атоме азота три неспаренных электрона, поэтому он может проявлять валентность, равную трем. Из-за отсутствия d-подуровня на внешнем уровне его 2s-электроны распариваться не могут. Но эти 2s-электроны могут образовывать четвертую связь по донорно-акцепторному механизму. Азот — типичный неметалл, по электроотрицательности уступает лишь фтору и кислороду. Азот — бесцветный газ, без запаха и вкуса, немного легче воздуха, очень мало растворим в воде. В обычных условиях N2 не способен вступать в соединения; исключение составляет литий, который медленно соединяется с азотом с образованием нитрида Li3N. При нагревании азот реагирует со многими металлами и неметаллами, образуя нитриды. Из нитридов наибольшее значение имеет нитрид водорода— аммиак NH3. В лаборатории аммиак получают действием на соли аммония щелочей или нагреванием кристаллических солей аммония с гидроксидом или оксидом кальция: 2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3 +2H2O. Аммиак — бесцветный газ с резким раздражающим запахом, легче воздуха в 1,7 раза, очень хорошо растворим в воде Аммиак обладает только восстановительными свойствами, что обусловлено степенью окисления азота. Большая растворимость аммиака в воде обусловлена образованием водородных связей между их молекулами. Однако помимо гидратов аммиака образуются ионы аммония и гидроксид-ионы:
Гидроксид-ионы обусловливают щелочную реакцию раствора. При взаимодействии их с ионами NH4 снова образуются молекулы NH3 и H2O, соединенные водородной связью; т. е. равновесие смещено влево, и большая часть аммиака содержится в растворе в виде молекул NH3. Но водный раствор аммиака обычно обозначают NH4OH и называют гидроксидом аммония, а щелочную реакцию раствора аммиака объясняют диссоциацией молекул NH4OH:
Концентрация гидроксид-ионов в растворе аммиака мала, поэтому гидроксид аммония относится к слабым щелочам. С кислородом азот образует, несколько оксидов: N2O, NO, N2O3, NO2, N2O4, N2O5. Оксид азота(I) N2O — бесцветный газ со слабым приятным запахом, тяжелее воздуха, мало растворим в воде, лучше — в спирте, при нагревании легко разлагается на азот и кислород: 2N2O = 2N2 + O2. Оксид азота(II) N0 — бесцветный газ, ядовитый, немного тяжелее воздуха, малорастворим в воде, обладает как окислительными, так и восстановительными свойствами. Оксид азота(IV) NO2 — красновато-бурый, обладающий характерным запахом, очень ядовитый газ, NO2 является сильным окислителем, хорошо растворяется в воде, при этом образуются две кислоты — азотная и азотистая: 2NO2 + H2O = HNO3 + HNO2. Так как азотистая кислота неустойчива - 2HNO2 = NO + NO2 + H2O, то практически взаимодействие идет по уравнению: 3NO2 + H2O = 2HNO3 + NO. В присутствии воздуха выделяющийся оксид азота(II) окисляется до оксида азота(IV). Поэтому весь NO2 может быть практически переведен в азотную кислоту: 4NO2 + 2H2O + O2 = 4HNO3. Оксид азота(III) N2O3, или азотистый ангидрид — темно-синяя жидкость. Очень нестоек, легко разлагается: N2O3=NO + NO2. При растворении оксида азота (III) в воде образуется азотистая кислота
Азотистая кислота известна лишь в разбавленных водных растворах, относится к кислотам средней силы, проявляет окислительные и восстановительные свойства; в первом случае она восстанавливается обычно до NO, во втором — окисляется в азотную кислоту. Соли азотистой кислоты — нитриты — ядовиты, термически более устойчивы, чем нитраты, хорошо растворимы в воде (кроме AgNO2). Оксид азота(V) N2O5 — бесцветные, расплывающиеся на воздухе кристаллы. Неустойчив, медленно распадается: 2N2O5 = 4NO2 + O2. При растворении в воде образует азотную кислоту: N2O5 + H2O = 2HNO3.
Растворяясь в азотной кислоте, диоксид азота окрашивает ее в желтый цвет. Чтобы избежать этого частичного разложения, азотную кислоту хранят в склянках из темного стекла. По приведенному выше уравнению азотная кислота разлагается при кипячении. Чем концентрированнее кислота и чем выше температура нагревания, тем быстрее идет ее разложение. Азотная кислота является сильной кислотой и энергичным окислителем. По мере разбавления азотной кислоты ее окислительные свойства ослабляются, а кислотные усиливаются. Поэтому реакции многих металлов с разбавленной азотной кислотой протекают с вытеснением водорода, который расходуется на дальнейшее восстановление избытка азотной кислоты до смеси различных продуктов ее восстановления. Степень восстановления азотной кислоты зависит от ее концентрации и активности восстановителя. Чем сильнее разбавлена азотная кислота, тем дальше идет ее восстановление. Металлы, находящиеся в ряду напряжения после водорода, восстанавливают концентрированную азотную кислоту до NO2, а разбавленную — до NO. Более активные металлы (Zn, Mg, Ca и др.) восстанавливают концентрированную азотную кислоту до N2O, а сильно разбавленную — до NH3, который с избытком кислоты образует соли аммония. Металлы средней активности (Fe, Ni, Sn и др.) взаимодействуют с разбавленной азотной кислотой, восстанавливая ее до N0. Такие металлы, как Аu, Pt, Jr, Rh, Nb, Та, W, с азотной кислотой не реагируют. Чистое железо, алюминий и хром не растворяются в концентрированной азотной кислоте из-за пассивирования — образования на поверхности металла тонкой защитной пленки оксида.
В + 3HNO3 = Н3ВО3 + 3NO2. Она также взаимодействует с органическими соединениями. Нитрованием последних получают красители, взрывчатые вещества, лекарства. Соли азотной кислоты — нитраты, твердые кристаллические вещества, хорошо растворимые в воде, большинство из них — бесцветные, за исключением нитратов меди, никеля, кобальта и др. Нитраты при нагревании разлагаются, причем продукты разложения могут быть разными, в зависимости от положения металла соли в электрохимическом ряду напряжений. Соли металлов, стоящих в ряду напряжений левее магния, при разложении образуют нитриты и кислород; от магния до меди — оксиды металла, NO2 и кислород; после меди — свободный металл, NO2 и кислород.
ЛАБОРАТОРНАЯ РАБОТА
|
|||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 675; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.137 (0.007 с.) |







 Al Al2O3 AlCI3 Al(OH)3 K3[Al(OH)6] Al(NO3)
Al Al2O3 AlCI3 Al(OH)3 K3[Al(OH)6] Al(NO3)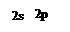
 N 1s22s22p3
N 1s22s22p3 NH3 + HOH [NH4]+ + [ОН]-.
NH3 + HOH [NH4]+ + [ОН]-. NH4OH NH4+ + OH-.
NH4OH NH4+ + OH-. N2O3 + H2O 2HNO2.
N2O3 + H2O 2HNO2. Безводная азотная кислота — бесцветная, дымящая жидкость с температурой кипения 86 °С. При обычной температуре азотная кислота под действием солнечного света частично разлагается:
Безводная азотная кислота — бесцветная, дымящая жидкость с температурой кипения 86 °С. При обычной температуре азотная кислота под действием солнечного света частично разлагается: 4HNO3 = 4NO2 +2H2O + O2.
4HNO3 = 4NO2 +2H2O + O2. Азотная кислота взаимодействует со многими неметаллами, окисляя их до соответствующих кислот. Например:
Азотная кислота взаимодействует со многими неметаллами, окисляя их до соответствующих кислот. Например: 3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO;
3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO;


