
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опыт 1. Восстановительные свойства сероводородаСодержание книги
Поиск на нашем сайте
В две пробирки внести следующие растворы: в первую – 5 капель перманганата калия и 2 капли 2н. Серной кислоты, во вторую – столько же дихромата калия и той же кислоты. В каждую из пробирок добавлять по каплям сероводородную воду до изменения окраски каждого раствора и его помутнения вследствие выделения серы. Запись данных опыта. Написать уравнения соответствующих реакций, учитывая,что МnО4—ион переходит в ион Мn2+, а Сr2О72- - ион – в Сr3+-иона. Опыт 2. Получение диоксида серы и его растворение в воде В две пробирки налить дистиллированную воду. В одну из них внести 2-3 капли индикатора – метилового оранжевого. Микроколбу или пробирку наполнить на 1/3 ее объема кристаллами сульфита натрия, добавить 6-8 капель 4н раствора серной кислоты и быстро закрыть пробкой с отводной трубкой (см. рис.). Выделяющийся газ пропустить в пробирки с индикатором и дистиллированной водой в течение 2-3 мин. Если выделение газа идет недостаточно энергично, пробирку осторожно подогреть. Полученный раствор SO2 в воде сохранить для опыта 3. На какие свойства водного раствора SО2 указывает окраска метилового оранжевого? Запись данных опыта. Написать уравнения реакций получения сернистого газа и его взаимодействия с водой.
  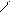 
Рисунок 1 – Лабораторная установка получения диоксида серы Опыт 3. Окислительные и восстановительные свойства Соединений серы (IV) а) Окислительные и восстановительные свойства SO2 В две пробирки, из которых одна с сероводородной, другая с иодной водой (по 3-5 капель), добавить по несколько капель полученного в опыте 2 водного раствора SO2. Отметить происходящие изменения в растворах. Запись данных опыта. Написать уравнения соответствующих реакций и указать, какие свойства проявляет диоксид серы в том и другом случае. б) Восстановительные свойства SO32--иона В пробирку, содержащую 5-6 капель раствора перманганата калия и 3-4 капли 2 н раствора хлороводородной кислоты, прибавить несколько кристалликов сульфита натрия. Отметить обесцвечивание раствора в связи с переходом иона MnO4- в ион Мn2+. В какое соединение при этом перешел сульфит натрия? Учитывая, что сульфит бария растворим в азотной кислоте, а сульфат бария нерастворим, убедиться в переходе иона SO32- в ион SO42-, для чего в полученный раствор добавить 1-2 капли 2 н азотной кислоты и столько же раствора хлорида бария. Какое соединение выпало в осадок? Отметить наблюдаемые явления и написать уравнения всех протекающих реакций. Опыт 4. Взаимодействие разбавленной серной кислоты С металлами В пять пробирок внести по 5-8 капель разбавленной серной кислоты и по 2-3 кусочка металла: в первую – магния, во вторую – цинка, в третью – алюминия, в четвертую – железа, в пятую – меди. В течении 2-3 минут наблюдать, с какими металлами разбавленная серная кислота взаимодействует при комнатной температуре. Пробирки, в которых реакции не протекают, слегка подогреть. Запись данных опыта. В каком случае реакция не идет? Почему? Написать уравнения протекающих реакций. Какой элемент в этих реакциях является окислителем?
|
||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 462; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.006 с.) |




