
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опыт 1. Взаимодействие металлического алюминия со щелочьюСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Поместить в пробирку немного алюминиевых стружек и добавить к нему 5-10 капель раствора щелочи. Легко ли алюминий растворяется в щелочи? Объяснить механизм реакции алюминия со щелочами. Написать уравнения реакций.
Опыт 2. Получение гидроксида алюминия и исследование его свойств В две пробирки поместить по 2-3 капли раствора соли алюминия и осторожно добавить в каждую по 1-3 капли 2н раствора едкого натра до образования осадка гидроксида алюминия. К полученному осадку прибавить в одну пробирку 3-4 капли раствора соляной кислоты, в другую - такое же количество раствора едкого натра. Что наблюдается в обоих случаях? Какой вывод о свойствах гидроксида алюминия можно сделать? Написать в молекулярном и ионном виде уравнения: а) реакции получения гидроксида алюминия; б) реакции взаимодействия гидроксида алюминия с кислотой и щелочью; в) схему равновесия диссоциации гидроксида алюминия. Как смещается равновесие диссоциации гидроксида алюминия при добавлении избытка кислоты? При добавлении избытка щелочи? Опыт 3. Гидролиз растворов солей алюминия. Определить рН водного раствора соли алюминия.Для этого нанести 1 каплю раствора соли на полоску универсального индикатора. Написать молекулярное и ионное уравнения первой ступени гидролиза. Почему гидролиз данной соли не идет до конца? Какие продукты получаются в результате реакции? Как можно уменьшить или усилить гидролиз соли алюминия?
Контрольные вопросы: 1. Составить электронную формулу атома алюминия, иона алюминия в в характерной степени окисления. 2. Написать уравнения реакций горения алюминия в кислороде; в хлоре; в парах серы. 3. Какие кислотно-основные свойства характерны для оксида и гидроксида алюминия? Составить уравнения соответствующих реакций. 4. Какие вещества и в какой последовательности образуются при постепенном прибавлении избытка раствора гидроксида натрия к раствору хлорида алюминия? Составить уравнения реакций в молекулярной и ионной форме. 5. Почему нельзя пользоваться алюминиевыми сосудами для хранения щелочных растворов? Привести уравнения реакций. 6. Почему алюминий, находясь в ряду электродных потенциалов левее водорода, не вытесняет его из воды, но легко вытесняет водород из водного раствора щелочи? 7. Какие вещества и в какой последовательности образуются при постепенном добавлении избытка раствора соляной кислоты на раствор алюмината натрия? 8. Как алюминий реагирует с разбавленными и концентрированными соляной и серной кислотами? Составить уравнения реакций. 9. Как алюминий реагирует с разбавленной и с концентрированной азотной кислотой? Составить уравнения реакций. 10.Чем объясняется высокая коррозионная устойчивость алюминия? Как влияют ионы ртути на коррозию алюминия? Составить уравнения реакций. 11.Написать уравнения реакций для следующих превращений: а) Al2O3 ® AlCl3 ® Al(OH)3 ® K3AlO3 ; б) K3AlO3 ® Al(OH)3 ® Al2O3 ® Al. 12. Написать уравнения реакций для следующих превращений: а) Al ® AlCl3 ® Al(OH)Cl2 ® Al(OH)3; б) K3AlO3 ® Al2(SO4)3 ® Al(HSO4)3 ® Al(OH)3. 13. Написать уравнения реакций гидролиза следующих солей: а) хлорида алюминия; б) сульфида алюминия. Какая реакция среды в водных растворах этих солей? 14. Как изменяется окраска лакмуса в водных растворах солей: нитрата алюминия; метаалюмината натрия; алюмокалиевых квасцов? Составить уравнения реакций. 15. Объяснить, почему при сливании растворов нитрата алюминия и сульфида натрия не образуется осадка сульфида алюминия. Что образуется? 16. Почему при действии сульфида натрия и карбоната натрия на водный раствор алюмокалиевых квасцов выпадает осадок одинакового состава? Составить уравнения реакций. 17. Какой процесс называется алюмотермией? Для чего он используется? 18. Каков состав термитной смеси? Для чего она используется? Составить уравнение реакции. 19.Написать уравнения реакций для следующих превращений: Al ® Al2S3 ® Al(OH)3 ® AlCl3 ® K[Al(OH)4] 20.Как получают алюминий в промышленности?
Олово. Свинец
Sn... 5s25p2 Pb... 6s26p2 Степень окисления элементов в нормальном состоянии +2, при возбуждении +4, поэтому известны два ряда производных олова и свинца. Отношение Sn и Pb к кислотам различно. Олово растворяется в соляной кислоте (в разбавленной медленно, а в концентрированной и при нагревании - быстро): Sn + 2HCl = SnCl2 + H2 Свинец при взаимодействии с HCl покрывается слоем PbCl2, препятствующим дальнейшему взаимодействию Pb с кислотой. Аналогично происходит взаимодействие свинца с разбавленной серной кислотой, но при концентрации кислоты выше 80% на поверхности металла образуется растворимая кислая соль Pb(HSO4)2. Разбавленная серная кислота на олово не действует. Горячая концентрированная серная кислота растворяет оба элемента по схеме Э + 4H2SO4 = Э(SO4)2 + 2SO2 + 4H2O В сильно разбавленной азотной кислоте олово медленно растворяется с образованием Sn(NO3)2. Концентрированная азотная кислота действует на Sn по схеме Sn + 4HNO3 = SnO2 + 4NO2 + 2H2O При действии HNO3 на свинец реакция протекает по схеме 3Pb + 8HNO3 = 3Pb(NO3)2 + 2NO + 4H2O Образующаяся соль Pb(NO3)2 не растворима в концентрированной азотной кислоте, и наоборот, хорошо растворима в воде, поэтому Pb хорошо растворяется в разбавленной азотной кислоте. Олово и свинец растворяются в щелочах с выделением водорода и образованием комплексных солей: Pb + 4KOH + 2H2O ® K4[Pb(OH)6] + H2 Для олова и свинца известны оксиды типов ЭО и ЭО2. В воде они почти не растворимы, поэтому отвечающие им гидроксиды получают действием щелочей на растворы соответствующих солей: SnCl4 + 4NaOH = 4NaCl + Sn(OH)4¯ Pb(NO3)2 + 2NaOH = 2NaNO3 + Pb(OH)2¯ По химическим свойствам все эти гидроксиды - амфотерные соединения. Изменения кислотных и основных свойств можно представить схемой: Усиление основных свойств
Pb(OH)2 Pb(OH)4
Гидроксиды H2SnO2 и H2PbO2 называют оловянистой и свинцовистой кислотами, а их соли - станнитами и плюмбитами. Гидроксиды H2SnO3 (H4SnO4) и H2PbO3 (H4PbO4) называют оловянной и свинцовой кислотами, а их соли - станнатами и плюмбатами. Ввиду слабости основных свойств гидроксидов Э(ОН)4 их соли подвергаются в растворах сильному гидролизу. Наибольшее значение из соединений этих элементов имеют галиды ЭГ4. Самое характерное свойство для них - склонность к реакции присоединения. Например, SnCl4 образует комплексы с HCl, H2O. Галиды ЭГ2 имеют ярко выраженный характер солей, гидролизуются значительно меньше, чем ЭГ4. Для Sn известны сульфиды SnS и SnS2, которые отличаются по своему отношению к сернистому аммонию. В то время как сульфид олова(II) с ним не взаимодействует, сульфид олова(IV) в растворе сульфида аммония образует аммонийную соль тиооловянной кислоты: (NH4)2S + SnS2 = (NH4)SnS3 Для характеристики окислительно – восстановительных свойств используют диаграммы Латимера. Диаграммы Латимера: а) для олова; -0,118
+0,154 -0,141
б) для свинца: -0,956
1,685 -0,356
1,456 - 0,126
Соединения олова и свинца характеризуются различными окислительно-восстановительными свойствами (см. диаграмму Латимера).Для олова более устойчивой является степень окисления (+4), соединения Sn+2 - восстановители, легко окисляются кислородом воздуха и другими окислителчми; для свинца - более устойчива степень окисления (+2), соединения свинца (+4) - чрезвычайно сильные окислители. Например, возможно окисление диоксидом свинца соединений марганца (II) до перманганат-иона: 5PbO2 + 2Mn(NO3)2 + 6HNO3 = 5Pb(NO3)2 + 2HMnO4 + 2H2O
Лабораторная работа №4 ВНИМАНИЕ! Все соединения свинца ядовиты! При работе с ними соблюдать особую осторожность! По окончании опытов с кислотами растворы слить в слив, а не растворившиеся металлы положить в специальную посуду!
Опыт 1. Отношение олова и свинца к кислотам (проводить в вытяжном шкафу!). а) растворение олова в кислотах В три пробирки положить по кусочку металлического олова и прилить по 5 капель кислот, в первую - соляной, во вторую - серной, в третью - азотной. Отметить наблюдения. Написать уравнения реакций в ионной и молекулярной формах. б) В три пробирки поместить по кусочку свинца и прилить по 5-8 капель растворов кислот: в первую - соляной, во вторую - серной, в третью - азотной. Нагреть пробирки на спиртовке. Во всех ли пробирках протекает реакция? После охлаждения растворов в каждую пробирку добавить 1-2 капли раствора KI. В какой из пробирок выпал осадок?
|
||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 998; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.174.45 (0.009 с.) |

 Олово и свинец - металлы IV А подгруппы периодической системы Д.И.Менделеева. Электронные формулы валентных электронов этих металлов:
Олово и свинец - металлы IV А подгруппы периодической системы Д.И.Менделеева. Электронные формулы валентных электронов этих металлов:
 Sn(OH)2 Sn(OH)4
Sn(OH)2 Sn(OH)4
 SnO2
SnO2
 Sn4+ Sn2+ Sn0
Sn4+ Sn2+ Sn0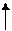 -0,96 -0,79
-0,96 -0,79
 [Sn(OH)6]2- [Sn(OH)6]4-
[Sn(OH)6]2- [Sn(OH)6]4-
 PbS
PbS

 PbSO4
PbSO4
 PbO2 Pb2+ Pb0
PbO2 Pb2+ Pb0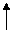 0,305 -0,538
0,305 -0,538 
 [Pb(ОН)6]2- [Pb(OH)4]2-
[Pb(ОН)6]2- [Pb(OH)4]2-


