
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опыт 7. Восстановительные свойства тиосульфата натрия.Содержание книги
Поиск на нашем сайте В две пробирки внести раздельно по 5-6 капель бромной и иодной воды. В обе пробирки добавить по несколько капель тиосульфата натрия до обесцвечивания растворов. Написать уравнения протекающих реакций, учитывая, что бром окисляет тиосульфат до сульфата, при этом в реакции участвует вода. (Выделяющаяся сера является продуктом побочной реакции.) Иод окисляет тиосульфат до тетратионата Na2S4O6. В какую степень окисления переходит при этом бром и иод? Может ли хлорная вода окислить тиосульфат натрия? Ответ мотивировать, используя окислительно-восстановительные потенциалы.
Опыт 8. Качественное определение ионов SO Получить у преподавателя сухую соль, растворить ее в дистиллированной воде и размешать стеклянной палочкой. Установить любыми известными вам реакциями, является ли данная соль сульфитом, сульфатом, тиосульфатом или сульфидом. (В каждом отдельном случае брать 5-6 капель исходного раствора.) Описать методику работы и наблюдаемые явления, на основании которых сделать вывод о присутствии или отсутствии каждого иона. Записать уравнения соответствующих реакций.
Контрольные вопросы 1.Написать электронные формулы атомов серы, селена и теллура в невозбужденном и возбужденном состояниях 2. В какой степени окисления сера может быть: а) только окислителем, б) только восстановителем? Написать соответствующие электронные формулы. Привести примеры реакций. 3. В какой степени окисления сера может быть окислителем и восстановителем? Привести примеры соответствующих реакций. 4. Написать уравнения ступенчатой диссоциации сероводородной кислоты. Как будет смещаться равновесие при прибавлении: а) хлороводородной кислоты, б) нитрата свинца (II), в) щелочи? 5. Какие вещества будут получаться при взаимодействии FeS: а) с хлороводородной кислотой, б) с концентрированной азотной кислотой? Написать соответствующие уравнения реакций. 6. Написать формулы: а) двух различных сульфидов, не растворимых в воде и растворимых в кислой среде; б) двух сульфидов, не растворимых в нейтральной и кислой среде. Составить уравнения реакций их получения и растворения в кислоте. 7. Написать уравнения реакций получения сернистого газа тремя различными способами. В каком состоянии гибридизации находится атом серы в молекуле SO2? Какова в связи с этим геометрическая структура молекулы? 8. Какие ионы получатся при пропускании SO2: а) в чистую воду, б) в воду, содержащую Cl2? Написать соответствующие уравнения в ионном виде. 9. Какая соль K2SeO3 или K2SO3 имеет большую степень гидролиза в водном растворе одинаковой концентрации? 10. Написать графическую формулу тиосульфата натрия, указать степени окисления серы в этом соединении и объяснить его неустойчивость в кислой среде. 11. Можно ли в качестве осушителя для сероводорода, бромоводорода и йодоводорода применить концентрированную серную кислоту? Ответ мотивировать, написать соответствующие уравнения реакций. 12. Написать в молекулярном и ионном виде уравнения реакций: а) (NH4)2S +FeCl2 ® б) H2S +FeCl3 ® в) H2SO4 (конц.) +Zn® 13. Дописать уравнения реакций и расставить коэффициенты: а) H2S + HNO3 (конц.) ® б)K2Cr2O7 + Na2S +H2SO4 ® S +Cr2 (SO4)3 +… в)Na2SO3 +Zn +HCl (разб.) ® г)H2SO3 +KMnO4 ® Mn2+ +… д)FeSO4 + K2S2O8 ® Fe3+ +… 14. Назовите аллотропные модификации серы. Каковы температуры фазовых переходов? 15. Составить молекулярные и сокращенные ионные уравнения реакции гидролиза сульфидов и сульфитов 16. Пользуясь электронными и электронно–ионными схемами, написать уравнения для следующих окислительно–восстановительных реакций: а) Na2SO3 +Cl2 +H2O® Na2SO4 +HCl б) Na2SO3 ®Na2SO4 +Na2S в)Hg +H2SO4 ®HgSO4 +SO2 +H2O. 17. Сернистый газ, получившийся при сжигании 179,2 л сероводорода, пропущен через 2 л 25%-ного раствора гидроксида натрия (плотность 1,28 г/см3). Каков остаток образовавшейся соли и какова ее концентрация в растворе? Ответ: Na2 SO3; 32,8%. 18.Составить уравнения реакций для следующих превращений: FeS ® SO2 ® H2SO3 ® BaSO4 ® BaS 19. Составить уравнения реакций для следующих превращений: SO2 ® SO3 ® H2SO4 ® H2S ® ZnS 20. Составить уравнения реакций для следующих превращений: S ® SO2 ® K2SO3 ® BaSO3 ® BaSO4
Галогены.
Конфигурация валентных электронов атомов галогенов …ns2np5. До полного завершения наружного валентного слоя не хватает одного электрона, поэтому валентное состояние в виде одноразрядных отрицательных галогенид-ионов наиболее устойчиво: I+e®I-. Вследствие большого сродства к электрону свободные галогены являются сильными окислителями. По ряду F2, Cl2, Br2, I2 уменьшается окислительная активность и возрастает восстановительная активность. Более сильный окислитель - Cl2 вытесняет иод из иодидов 2 KI + Cl2 ® 2 KCl + I2 Все галогены, кроме фтора, можно перевести в состояние со степенью окисления +1, +3, +5, +7. Отсутствие таких соединений у фтора объясняется особенностями строения его внешней электронной оболочки: Фтор с кислородом образует соединение OF2, кислород в этом соединении имеет степень окисления +2. Хлор, бром и иод с кислородом дают оксиды различного состава, кислородные кислоты и их соли. В ряду: НГО - НГО2 - НГО3 - НГО4 растет сила кислородсодержащих кислот. НClО4 - самая сильная минеральная кислота. В ряду Cl2 - Br2 - I2 растет восстановительная активность, поэтому каждый последующий член этого ряда может вытеснить предыдущий из кислородных соединений, например, I2 + 2 KClO3 ® Cl2 + 2 KIO3 В ряду HClO - HBrO - HIO самый сильный окислитель - кислота HClO. При растворении галогенов в воде происходят химические реакции F2 + H2O = 2HF + O; F2 + O = OF2. Хлор, бром, иод реагируют с водой с образованием двух кислот
Равновесие сдвинуто влево. В растворах щелочей равновесие смещается вправо и удается получить соли кислородсодержащих кислот Cl2 + 2 NaOH ® NaCl + NaClO + H2O При взаимодействии галогенов с горячими растворами щелочей получаются хлораты (соли HClO3), броматы (соли HBrO3) и иодаты (соли HIO3). 3 Г2 + 6 КОН = КГО3 + 5 КГ + 3 Н2О В водных растворах хлорноватистая кислота разлагается: 3 HClO = 2 HCl + HClO3 Ослабление окислительных свойств в направлении от хлорноватистой к хлорной кислоте можно объяснить большей устойчивостью перхлорат ионов в результате дополнительного p-связывания. Кислородные соединения галогенов окисляют в кислой среде и восстанавливаются при этом в отрицательно заряженные галогенид-ионы: ClO- + 2H+ + 2 e ® Cl- + H2O ClO2- + 4 H+ + 4 e ® Cl- + 2H2O ClO3- + 6 H+ + 6 e ® Cl- + 4 H2O ClO4- + 8 H+ + 8e ® Cl- + 4 H2O В тех случаях, когда восстановителем является галогенид-ион, восстановление кислородного соединения того же галогена протекает до свободного галогена: ClO3- + 6 H+ + 5 Cl- = 3Cl2 + 3 H2O При растворении газообразных галогеноводородов в воде образуются сильные галогеноводородные кислоты. В ряду HF - HCl - HBr - HI кислотные свойства возрастают, так как в этом ряду падает прочность связи молекул НГ вследствие увеличения атомного радиуса галогенов. Фтороводородная кислота является слабой. Указанная аномалия обусловлена большей прочностью связи и способностью HF образовывать ассоциации типа (HF)n, где n может быть равно 4. Различная восстановительная активность галогеноводородов обуславливает различное взаимодействие их с концентрированной серной кислотой: F- и Cl- - слабые восстановители и поэтому фториды и хлориды с серной кислотой вступают в реакции обмена: 2 KF + H2SO4 = K2SO4 + 2 HF 2 KCl + H2SO4 = K2SO4 + 2 HCl Br- и I- - сильные восстановители, они окисляются концентрированной серной кислотой до свободных Br2 и I2: 2 KBr + 2 H2SO4 = K2SO4 + Br2 + SO2 + 2 H2O 8 KI + 5 H2SO4 = 4 K2SO4 + 4 I2 + H2S + 4 H2O Галогены соединяются почти со всеми металлами, образуя галогениды металлов. В галогенидах щелочных и щелочноземельных металлов связи ионные. По мере уменьшения активности металлов связи в галогенидах становятся менее ионными и всё более ковалентными. Характер их меняется от типичных солей (NaCl) до кислотообразующих соединений (SnCl4, PCl5). Лабораторная работа №15
Все опыты проводить в вытяжном шкафу, так как все галогены и галогеноводороды очень ядовиты!
|
||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 800; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.009 с.) |

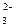 , SO
, SO 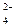 , S
, S 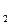 O
O 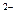 и их открытие.
и их открытие. Галогены - элементы с ярко выраженными неметаллическими свойствами. В газообразном состоянии они образуют двухатомные молекулы. Так как галогены обладают высокой химической активностью, в природе они находятся только в связанном состоянии.
Галогены - элементы с ярко выраженными неметаллическими свойствами. В газообразном состоянии они образуют двухатомные молекулы. Так как галогены обладают высокой химической активностью, в природе они находятся только в связанном состоянии.
 Г2 + H2O НГ + НОГ
Г2 + H2O НГ + НОГ


