
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Под общей редакцией профессора А.М. СыркинаСодержание книги
Поиск на нашем сайте ХИМИЯ ЭЛЕМЕНТОВ
УФА 2001 УФИМСКИЙ ГОСУДАРСТВЕННЫЙ НЕФТЯНОЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
ХИМИЯ ЭЛЕМЕНТОВ
Учебное пособие
Под общей редакцией профессора А.М. Сыркина
УФА 2001
ВВЕДЕНИЕ Общие рекомендации для подготовки к лабораторным занятиям
Выполнение лабораторных работ призвано способствовать более глубокому усвоению студентами теоретического курса, приобретению навыков в проведении химических экспериментов, умению обобщать полученные данные и кратко излагать их в виде отчета. Необходимым условием успешного качественного усвоения пройденного материала является самостоятельное и сознательное выполнение лабораторных работ. При этом важной и существенной частью работы является домашняя подготовка по учебникам, методическим пособиям и руководствам. При изучении химии элементов и их соединений следует обратить внимание на следующие вопросы. 1.Положение элемента в периодической системе; электронная конфигурация атома; валентные электроны; характерные степени окисления элемента. 2.Простые вещества: а) физические свойства модификаций простых веществ; б) химическая активность, положение в ряду стандартных окислительно-восстановительных потенциалов; в) взаимодействие с кислородом и другими неметаллами; взаимодействие с металлами; г) отношение к воде, к водным растворам кислот (НСl, НNО3, Н2SO4) и щелочей; д) нахождение в природе и получение простых веществ. 3. Характеристичные соединения: оксиды и гидроксисоединения (гидроксиды или кислоты): а) растворимость в воде, взаимодействие с водой, кислотно-основная диссоциация, константы диссоциации; б) взаимодействие с кислотами; в) взаимодействие со щелочами в водном растворе и при сплавлении; г) растворимость и гидролиз солей рассматриваемых гидроксидов или кислот. 4. Комплексные соединения элемента. 5. Окислительно-восстановительные свойства соединений элемента: а) диаграмма Латимера (диаграмма с указанием стандартных окислительно-восстановительных потенциалов электрохимических систем, образуемых элементом); б) окислительные свойства соединений; в) восстановительные свойства соединений; г) свойства соединений с двойственной окислительно-восстановительной способностью; д) диспропорционирование; е) влияние образования осадков и комплексов на окислительно-восстановительные свойства. 6. Термическая устойчивость соединений элемента. 7. Качественные реакции на характеристичные ионы. 8. Применение соединений элемента. С первых дней работы в лаборатории студент должен приучать себя к аккуратности и вниманию, отсутствие которых бывает причиной искажения результатов эксперимента, а также может привести к несчастным случаям. При выполнении практических работ все наблюдения следует записывать в специальную тетрадь – лабораторный журнал – непосредственно после каждого опыта. Не следует делать записи в черновиках и на отдельных листочках бумаги, так как они могут легко затеряться. По окончании опытов необходимо составить отчет о выполненной работе. Отчет следует начинать с названия и номера лабораторной работы, краткого изложения теории. Он должен содержать: - номер и название опыта - условия и особенности протекания реакции - схемы приборов; схемы, иллюстрирующие проводимый эксперимент - полученные результаты, наблюдаемые эффекты - уравнения, протекающих реакций в молекулярной и ионной формах - объяснения и выводы. Отчет может быть оформлен либо в описательной форме, либо в форме таблицы на двух развернутых страницах: Лабораторная работа № _____ Тема: ________________________________________________________ Опыт: ________________________________________________________
Основные правила безопасной работы в химической лаборатории - соблюдение порядка, чистоты, тишины, дисциплины; - выполнение только порученных преподавателем работ; - перед выполнением работы необходимо ознакомиться с заданием, оборудованием, реактивами; - работа выполняется на отведенном рабочем месте в спецодежде – халате; - в лаборатории запрещается работать одному, принимать пищу, курить, загромождать рабочее место, оставлять работающие приборы без присмотра, включать приборы, не относящиеся к данной работе; - реактивы, предназначенные для общего пользования, нельзя уносить на свое рабочее место; пипетки после отбора необходимого количества реактива следует немедленно возвращать в реактивную склянку; - остатки реактивов и продуктов реакции сливать только в специальный слив; категорически запрещается сливать их в раковину и общую канализацию; - следует экономно расходовать реактивы, электричество, воду; аккуратно и осторожно обращаться с химической посудой и приборами; - при нагревании растворов в пробирке необходимо пользоваться держателем, отверстие пробирки должно быть обращено внутрь вытяжного шкафа; - все опыты, связанные с применением или образованием ядовитых веществ, вредных паров и газов, а также концентрированных кислот и щелочей разрешается проводить только в вытяжном шкафу; - по окончании работы необходимо вымыть посуду, убрать рабочее место, выключить электронагревательные приборы, воду и вымыть руки с мылом; - ВНИМАНИЕ! о любых происшествиях немедленно сообщить преподавателю или лаборанту, которые ликвидируют опасность и окажут первую помощь; - при воспламенении горючей жидкости на одежде работающего необходимо немедленно погасить пламя, завернув пострадавшего в одеяло; - при ожогах концентрированными растворами кислот пораженное место промывают сильной струей воды в течение 2-3 минут, затем 2-3 %-ным раствором чайной соды, после чего накладывают марлевую повязку, смоченную 1-2%-ным раствором перманганата калия; при сильных ожогах после оказания первой помощи следует обратиться к врачу; - при ожогах концентрированными растворами щелочей обожженное место промывают обильным количеством воды, затем 1-2%-ным раствором борной или уксусной кислоты, после чего накладывают марлевую повязку, смоченную 1-2%-ным раствором перманганата калия; - при попадании кислоты, щелочи или какого-либо другого реактива в глаза следует промыть их обильным количеством воды и немедленно обратиться к врачу.
ХИМИЯ МЕТАЛЛОВ Щелочные металлы
Все щелочные металлы серебристого цвета, за исключением цезия, который имеет золотисто-желтую окраску. Они очень мягки и легко режутся ножом; самый твердый из них литий. От лития к францию число электронных уровней в атоме возрастает от 2 до7, в связи с чем увеличиваются радиусы атомов и уменьшаются энергии ионизации, а следовательно, возрастает восстановительная активность. На внешнем уровне всех атомов находится по одному s- электрону (ns1), который слабо связан с ядром, легко отторгается и всем этим элементам характерна степень окисления +1. Щелочные металлы имеют небольшую плотность (литий почти в два раза легче воды), низкие температуры плавления и высокую электропроводность. В ряду стандартных окислительно-восстановительных потенциалов щелочные металлы по своим значениям электродных потенциалов расположены в начале ряда. В природе из-за высокой реакционной способности щелочные металлы могут находиться исключительно в виде соединений, главным образом солей: хлоридов, сульфатов, карбонатов, нитратов, силикатов. Наиболее распространены в природе натрий и калий; содержание каждого из них в земной коре около 2,5 %, а на долю всех остальных приходится приблизительно 0,014%. В свободном виде щелочные металлы получают, главным образом, электролизом расплавленных солей или гидроксидов. Используются также методы замещения: KCl + Na ® K + NaCl KOH + Na ® K + NaOH 2 RbCl + Ca ® 2Rb + CaCl2 2 CsCl + Ca ® 2Cs + CaCl2 Щелочные металлы легко вступают в химические реакции со всеми элементарными окислителями: галогенами, кислородом, серой, азотом и даже водородом. 2 Na + Cl2 ® 2 NaCl Литий при взаимодействии с кислородом образует оксид Li2O: 4 Li + О2® 2 Li2O Натрий - пероксид Na2O2: 2 Na + О2 ® Na2O2 Калий, рубидий и цезий - супероксиды: Me + О2 ® MeO2 2 Na + S ® Na2S (Na2S2, Na2S5) 6 Li + N2 ® 2 Li3N 2 Na + H2 ® 2NaH Щелочные металлы бурно взаимодействуют с водой с выделением тепла: 2Me + 2H2O ® 2 MeOH + H2 + Q Характеристичные соединения – оксиды (Ме2О) и гидроксиды (МеОН) хорошо растворяются в воде и являются сильными основаниями. Ме2О + Н2О = 2МеОН Их водные растворы имеют сильнощелочную среду в результате полной диссоциации: МеОН ® Ме+ + ОН- Соли щелочных металлов практически все хорошо растворимы в воде. Они не гидролизуются по катиону, поэтому их растворы нейтральны (соли сильных кислот) или щелочные (соли слабых кислот). Щелочные металлы широко используются в технике. Изотоп лития 73 Li - теплоноситель в атомных реакторах. Металлический литий и некоторые его соединения служат топливом для ракет. Кроме того, литий используют, как исходный продукт для получения трития 31Н в ядерной реакции: 63 Li + 10 n = 31 H + 42 He Рубидий и цезий широко используют в фотоэлементах, преобразующих лучистую энергию в электрическую. Наибольшее практическое применение во всех областях нашли соединений натрия и калия. Лабораторная работа № 1
Все опыты со щелочными металлами следует проводить осторожно, не роняя кусочков металла на пол, одежду и строго соблюдать методику проведения опыта. Категорически запрещается наклонять лицо над сосудом, в котором происходит реакция! Все опыты проводить в вытяжном шкафу! Опыт 4. (Демонстрационный) Открытие ионов щелочных металлов по окрашиванию пламени. Нихромовую проволоку подержать некоторое время в соляной кислоте и прокалить в пламени горелки. Затем опустить проволоку в раствор соли лития и внести в бесцветное пламя горелки. В какой цвет окрасилось пламя? Так же поступить с солями калия и натрия (натрий - в последнюю очередь), каждый раз предварительно очищая проволоку в кислоте. В какой цвет окрашивают пламя ионы калия и натрия?
Контрольные вопросы. 1. Чем объяснить высокую активность щелочных металлов? 2. Какова электронная структура атомов щелочных металлов? 3. Как изменяются радиусы атомов, потенциалы ионизации, окислительно-восстановительные свойства элементов I А подгруппы по группе периодической системы Д.И. Менделеева? 4. Каковы физические свойства щелочных металлов? 5. Каковы химические свойства щелочных металлов? Взаимодействуют ли непосредственно щелочные металлы с азотом, кислородом, хлором, водородом, серой, водой? Написать соответствующие уравнения реакций. 6. Назвать важнейшие области применения щелочных металлов. 7. Назвать основные способы получения щелочных металлов. 8. Назвать важнейшие соединения щелочных металлов и области их применения. 9. Как из хлорида калия получить металлический калий; гидроксид калия? Написать соответствующие уравнения реакций. 10.Как можно получить нитриды щелочных металлов? Как нитриды металлов взаимодействуют с водой? 11.Как получить гидриды калия и натрия? Каковы их химические свойства? 12.Гидроксид калия применяется для осушки газов. Какие из указанных газов: сероводород, аммиак, диоксид углерода – нельзя осушать гидроксидом калия? 13.Составить уравнения реакций для следующих превращений: Na ® NaCl ® NaOH ® Na ® NaH ® NaCl 14.Составить уравнения реакций для следующих превращений: Li2SO4 ® Li2CO3 ® LiHCO3 ® LiCl ® Li 15.Составить уравнения реакций для следующих превращений: NaCl ® Na ® Na2O2 ® Na2O ® NaOH 16.Составить уравнения реакций для следующих превращений Cs ® CsCl ® CsOH ® CsNO3 ® CsNO2 17.Написать уравнения реакций: а). NaHCO3 ®t б). LiNO3 ® t в). NaOH + Cl2 ® 18.Написать уравнения реакций: а). Li + N2 ® б). NaOH + CO2 ® в). KO2 + CO2 ® 19. Написать уравнения реакций, лежащих в основе промышленного способа получения гидрокарбоната натрия. Как проводят очистку продукта? 20. Как получить калий из сильвинита? Какие промышленные отходы возможны в этом производстве? Металлы II А подгруппы.
Все элементы II А подгруппы имеют по два валентных s-электрона, один из которых при возбуждении переходит на р-подуровень. Поэтому они в своих соединениях двухвалентны. Бериллий имеет очень маленький радиус иона и, следовательно, большой потенциал ионизации. Он образует, практически во всех соединениях, ковалентные связи. Элементы II А подгруппы химически активны и встречаются в природе только в виде соединений. Бериллий чаще всего встречается в виде минерала берилла Be3Al2(SiO3)6. Окрашенные примесями разновидности берилла известны как драгоценные камни - изумруд, аквамарин и т.д. Магний, кальций, стронций и барий входят в состав природных сульфатов, карбонатов, фосфатов, силикатов. Основным способом получения металлов II А подгруппы является электролиз расплавов солей или гидроксидов. Реже используют для получения этих металлов процессы восстановления кремнием, углем, алюминием. В свободном состоянии элементы II А подгруппы - легкие металлы с различными формами кристаллической решетки. Металлы IIA подгруппы очень сильные восстановители и активно взаимодействуют с различными окислителями. С неметаллами образуют бинарные соединения, например: 3Me + N2 = Me3N2; обладают высоким сродством к кислороду: 2Ме + О2 = 2МеО. Химическая активность в подгруппе увеличивается с повышением порядкового номера. Электродные потенциалы имеют низкие отрицательные значения: от –1,85 В у бериллия до –2,9 В у бария. По отношению к воде бериллий и магний устойчивы, так как покрыты защитной оксидной пленкой. Щелочноземельные металлы (Са, Sr, Ba) реагируют с водой по реакции: Ме + 2Н2О = Ме(ОН)2 + Н2. Все металлы активно взаимодействуют с различными кислотами: Me + 2H+ = Ме2+ + H2 4Me + 5H2SO4(конц.) = 4MeSO4 + H2S + 4H2O 4Me + 10HNO3(разб.) = 4Me(NO3)2 + NH4NO3 + 3H2O Со щелочами с образованием комплексных солей способен взаимодействовать только бериллий, что объясняется амфотерным характером его оксида и гидроксида: Be + 2H2O + 2NaOH = Na2[Be(OH)4] + H2 Свойства характеристичных соединений –оксидов (МеО) и гидроксидов (Ме(ОН)2) – в подгруппе закономерно изменяются с увеличением порядкового номера:возрастает растворимость в воде и усиливаются основные свойства.
Оксиды Гидроксиды Растворимость Кислотно-основные свойства BeO Be(OH)2 нерастворим амфотерные MgO Mg(OH)2 нерастворим сред. основные CaO Ca(OH)2 умеренно раств. сильн. основные SrO Sr(OH)2 умеренно раств. сильн. основные BaO Ba(OH)2 умеренно раств. сильн. Основные
Большинство оксидов и гидроксидов металлов IIA подгруппы обладают основными свойствами и диссоциируют в соответствии с уравнениями:
Они взаимодействуют только с кислотами: Me(OH)2 + 2HCl = MeCl2 + 2H2O Исключением являются соединения бериллия, которые амфотерны. Диссоциация его гидроксида протекает как по кислотному, так и по основному типу:
Оксид и гидроксид бериллия взаимодействуют и с кислотами и со щелочами, образуя соответствующие соли: Be(OH)2 + 2HCl = BeCl2 + 2H2O Be(OH)2 + 2NaOH = Na2[Be(OH)4] Тетрагидроксобериллат натрия сплав. Be(OH)2 + 2NaOH = Na2BeO2 + 2H2O бериллат натрия Все соли бериллия сильно гидролизованы. Наибольшее значение в промышленности имеют бериллий и магний. Бериллий используют как замедлитель нейтронов в атомных реакторах. В качестве легирующей добавки он сообщает сплавам твердость, прочность, антикоррозионную устойчивость. Сплавы на основе магния широко применяют как конструкционные материалы в ракетной технике, авиа- и автостроении. Они содержат до 80% магния и различные добавки, отличаются малой плотностью, высокой прочностью, хорошей электропроводностью. Сплавы бария со свинцом используют в типографском деле. Металлический кальций используют для восстановления из руд хрома, рубидия и некоторых других металлов. Из соединений элементов IIА подгруппы наибольший практический интерес представляют соединения кальция: СаО - оксид кальция (негашеная известь) Са(ОН)2 - гидроксид кальция (гашеная известь; известковая вода). СаСО3 - карбонат кальция (мел; мрамор) СаSO4 × 2 Н2О - двуводный кристаллогидрат сульфата кальция (гипс) СаSO4 × 1/2 H2O - полуводный кристаллогидрат сульфата кальция (алебастр). Лабораторная работа №2
Алюминий
Al2O3 + 6 H+ ® 2 Al+3 + 3 H2O Al2O3 + 2OH- + 3H2O ® 2[Al(OH)4] - Алюминий, лишенный защитной пленки, взаимодействует с водой: 2Al + 6 H2O ® 2 Al(OH)3 + 3 H2, Алюминий активно реагирует с кислотами 2 Al + 6 H+ ® 2 Al+3 + 3 H2, и с водными растворами щелочей 2Al + 2OH- + 6 H2O ® 2[Al(OH)4]- + 3H2. Гидроксид алюминия Al(OH)3 - типичное амфотерное соединение: свежеприготовленный легко растворяется в кислотах и в щелочах. OH- OH-
H+ H+ Для получения осадка Al(OH)3 щелочь обычно не используют из-за легкости перехода осадка в раствор, а действуют на соли алюминия гидроксидом аммония, причем при комнатной температуре образуется Al(OH)3 (ортоалюминиевая кислота H3AlO3), а при кипячении - AlO(OH) (метаалюминиевая кислота HAlO2) AlCl3 + 3 NH4OH = Al(OH)3¯ + 3NH4Cl t AlCl3 + 3 NH4OH = HAlO2 + 3NH4Cl + H2O Соли алюминия и сильных кислот хорошо растворимы в воде и подвергаются в значительной степени гидролизу по катиону, создавая сильнокислотную среду, в которой возможно растворение металлов, например, Mg или Zn:
При определенных условиях (нагревание, подщелачивание) гидролиз протекает и по следующим ступеням
В растворах метаалюминатов (NaAlO2) среда щелочная из-за гидролиза по аниону
Алюминий - важнейший конструкционный металл, основа легких коррозионно-стойких сплавов (с магнием - дюралюмин или дюраль, с медью - бронза). Чистый алюминий в больших количествах идет на изготовление посуды и электрических проводов.
Лабораторная работа №3
Олово. Свинец
Sn... 5s25p2 Pb... 6s26p2 Степень окисления элементов в нормальном состоянии +2, при возбуждении +4, поэтому известны два ряда производных олова и свинца. Отношение Sn и Pb к кислотам различно. Олово растворяется в соляной кислоте (в разбавленной медленно, а в концентрированной и при нагревании - быстро): Sn + 2HCl = SnCl2 + H2 Свинец при взаимодействии с HCl покрывается слоем PbCl2, препятствующим дальнейшему взаимодействию Pb с кислотой. Аналогично происходит взаимодействие свинца с разбавленной серной кислотой, но при концентрации кислоты выше 80% на поверхности металла образуется растворимая кислая соль Pb(HSO4)2. Разбавленная серная кислота на олово не действует. Горячая концентрированная серная кислота растворяет оба элемента по схеме Э + 4H2SO4 = Э(SO4)2 + 2SO2 + 4H2O В сильно разбавленной азотной кислоте олово медленно растворяется с образованием Sn(NO3)2. Концентрированная азотная кислота действует на Sn по схеме Sn + 4HNO3 = SnO2 + 4NO2 + 2H2O При действии HNO3 на свинец реакция протекает по схеме 3Pb + 8HNO3 = 3Pb(NO3)2 + 2NO + 4H2O Образующаяся соль Pb(NO3)2 не растворима в концентрированной азотной кислоте, и наоборот, хорошо растворима в воде, поэтому Pb хорошо растворяется в разбавленной азотной кислоте. Олово и свинец растворяются в щелочах с выделением водорода и образованием комплексных солей: Pb + 4KOH + 2H2O ® K4[Pb(OH)6] + H2 Для олова и свинца известны оксиды типов ЭО и ЭО2. В воде они почти не растворимы, поэтому отвечающие им гидроксиды получают действием щелочей на растворы соответствующих солей: SnCl4 + 4NaOH = 4NaCl + Sn(OH)4¯ Pb(NO3)2 + 2NaOH = 2NaNO3 + Pb(OH)2¯ По химическим свойствам все эти гидроксиды - амфотерные соединения. Изменения кислотных и основных свойств можно представить схемой: Усиление основных свойств
Pb(OH)2 Pb(OH)4
Гидроксиды H2SnO2 и H2PbO2 называют оловянистой и свинцовистой кислотами, а их соли - станнитами и плюмбитами. Гидроксиды H2SnO3 (H4SnO4) и H2PbO3 (H4PbO4) называют оловянной и свинцовой кислотами, а их соли - станнатами и плюмбатами. Ввиду слабости основных свойств гидроксидов Э(ОН)4 их соли подвергаются в растворах сильному гидролизу. Наибольшее значение из соединений этих элементов имеют галиды ЭГ4. Самое характерное свойство для них - склонность к реакции присоединения. Например, SnCl4 образует комплексы с HCl, H2O. Галиды ЭГ2 имеют ярко выраженный характер солей, гидролизуются значительно меньше, чем ЭГ4. Для Sn известны сульфиды SnS и SnS2, которые отличаются по своему отношению к сернистому аммонию. В то время как сульфид олова(II) с ним не взаимодействует, сульфид олова(IV) в растворе сульфида аммония образует аммонийную соль тиооловянной кислоты: (NH4)2S + SnS2 = (NH4)SnS3 Для характеристики окислительно – восстановительных свойств используют диаграммы Латимера. Диаграммы Латимера: а) для олова; -0,118
+0,154 -0,141
б) для свинца: -0,956
1,685 -0,356
1,456 - 0,126
Соединения олова и свинца характеризуются различными окислительно-восстановительными свойствами (см. диаграмму Латимера).Для олова более устойчивой является степень окисления (+4), соединения Sn+2 - восстановители, легко окисляются кислородом воздуха и другими окислителчми; для свинца - более устойчива степень окисления (+2), соединения свинца (+4) - чрезвычайно сильные окислители. Например, возможно окисление диоксидом свинца соединений марганца (II) до перманганат-иона: 5PbO2 + 2Mn(NO3)2 + 6HNO3 = 5Pb(NO3)2 + 2HMnO4 + 2H2O
Лабораторная работа №4 ВНИМАНИЕ! Все соединения свинца ядовиты! При работе с ними соблюдать особую осторожность! По окончании опытов с кислотами растворы слить в слив, а не растворившиеся металлы положить в специальную посуду!
Опыт 1. Отношение олова и свинца к кислотам (проводить в вытяжном шкафу!). а) растворение олова в кислотах В три пробирки положить по кусочку металлического олова и прилить по 5 капель кислот, в первую - соляной, во вторую - серной, в третью - азотной. Отметить наблюдения. Написать уравнения реакций в ионной и молекулярной формах. б) В три пробирки поместить по кусочку свинца и прилить по 5-8 капель растворов кислот: в первую - соляной, во вторую - серной, в третью - азотной. Нагреть пробирки на спиртовке. Во всех ли пробирках протекает реакция? После охлаждения растворов в каждую пробирку добавить 1-2 капли раствора KI. В какой из пробирок выпал осадок?
Цинк, кадмий, ртуть.
В виде простых веществ цинк, кадмий и ртуть представляют собой серебристо-белые металлы, поверхность которых покрыта оксидной пленкой. Ртуть является в нормальных условиях жидким металлом, так как имеет низкую температуру плавления (- 39° С). Химическая активность металлов этой группы от Zn к Hg уменьшается. Об этом свидетельствуют значения их окислительно-восстановительных потенциалов: j° Zn2+/ Zn = -0,76 в j°Cd2+ / Cd = -0,403 в j°Hg2+ /Hg = +0,789 в Наиболее активным является цинк. В воде цинк не растворяется, так как его поверхность покрыта нерастворимым в воде оксидом. Очищенный от оксидной пленки цинк способен вытеснять водород из воды: Zn + 2H2O ® Zn(OH)2 + H2 Цинк легко растворяется в разбавленных кислотах (HCl, H2SO4): Zn + 2H+ ® Zn2+ + H2 , и при нагревании в щелочах, так как обладает амфотерностью, и его оксид и гидроксид хорошо растворяются в щелочном растворе. Zn + 2OH- + 2H2O ® H2 + [Zn(OH)4]2- При растворении в азотной кислоте цинк способен восстановить N+5до N-3 4 Zn + 10 HNO3 (разб.)® 4Zn(NO3)2 + NH4NO3 + 3H2O При взаимодействии цинка с концентрированной серной кислотой могут образовываться разные продукты восстановления S+6: SO2, S, H2S. Например: 4Zn + 5H2SO4 ® 4ZnSO4 + H2S + 4H2O Кадмий в щелочах практически не растворяется, а в кислотах - менее энергично, чем цинк. Ртуть способна растворяться в растворах концентрированных кислот-окислителей (HNO3, H2SO4 конц.) и в разбавленной HNO3: Hg + 4HNO3 (конц.) ® Hg(NO3)2 + 2NO2 + 2H2O 6Hg + 8HNO3 (разб.) ® 3Hg2(NO3)2 + 2NO + 4 H2O Hg + H2SO4 (конц.) ® SO2 + HgSO4 + H2O Свойства однотипных соединений по группе закономерно изменяются. Например, основные свойства оксидов (ЭО) и гидроксидов (Э(ОН)2) от цинка к ртути усиливаются. Поэтому гидроксид кадмия, Cd(OH)2, кислотные свойства проявляет в значительно меньшей степени, чем Zn(OH)2. Если Zn(OH)2 легко растворяется в щелочах, то Cd(OH)2 взаимодействует с концентрированными щелочами при длительном кипячении: Cd(OH)2 + 4NaOH ® Na4[Cd(OH)6] В отсутствии избытка щелочи гидроксокадматы легко разрушаются водой: Na4[Cd(OH)6] ® Cd(OH)2 + 4NaOH При действии на соли катионов подгруппы цинка раствором аммиака образующиеся в начале гидроксиды растворяются с образованием аммиакатных комплексов: Zn2+ + 2NH4OH ® Zn(OH)2 + 2NH4+ Zn(OH)2 + 4NH4OH ® [Zn(NH3)4](OH)2 + 4H2O Аммиакаты ртути (II), [Hg(NH3)4](NO3)2 образуются только при большом избытке NH3 и в присутствии солей аммония. Взаимодействие HgCl2 c NH3 в концентрированном растворе NH4Cl приводит к выпадению осадка [Hg(NH3)2Cl2]: HgCl2 + 2NH3 ® [Hg(NH3)2Cl2]¯ В разбавленных же растворах образуется нерастворимое в воде амидное производное [HgNH2]Cl: HgCl2 + 2NH3 ® [HgNH2]Cl + NH4Cl Диаграмма Латимера для ртути: +0,854
Hg2+ Hg22+ Hg0
X=Br, +0,306 X=Br, + 0,1397
X= Br, +0,223
Соединения цинка не проявляют в водных растворах активных окислительных свойств, тогда как соединения ртути являются достаточно сильными окислителями, о чем свидетельствует диаграмма Латимера для ртути. Соли ртути (II) способны окислять даже такой неактивный металл как медь: Cu + Hg2+ ® Cu2+ + Hg Проявляя постоянную валентность - два, ртуть способна к образованию соединений со степенью окисления +1, в которых ртуть находится в виде сложного катиона (Hg - Hg)2+. Соединения такой ртути весьма склонны к диспропорционированию: Hg22+ ® Hg + Hg2+ В зависимости от условий соединения Hg22+ могут проявлять или восстановительные или окислительные свойства: Hg2Cl2 + Cl2 ® 2HgCl2 Hg2Cl2 + SnCl2 ® 2Hg + SnCl4 Соединения кадмия и ртути ядовиты, особенно соединения ртути.
Лабораторная работа №5
Опыт 1. Образование сульфидов взаимодействием простых веществ (демонстрационный опыт, проводить в вытяжном шкафу!). При проведении данного опыта не наклоняйтесь над смесью серы и цинка. Нельзя проводить опыт в пробирке! Цинковую пыль и серный цвет (порошок серы), взятые в массовом соотношении 2:1, тщательно перемешать. Смесь поместить на кусочек асбеста и прикоснуться к ней горячей стеклянной палочкой. Объяснить яркую вспышку и образование белого дыма. Составить уравнение реакции.
Медь, серебро.
Ag... 4d10 5s1 Медь и серебро -мягкие пластичные металлы с высокой тепло- и электропроводимостью, с характерным металлическим блеском и цветом; медь- красноватого, серебро - серебристо-белого цвета. Металлы IБ группы характеризуются высокой энергией металлической связи и высокими энергиями ионизации и, следовательно, относительно низкой химической активностью. Причем медь более активна, чем серебро. Медь непосредственно взаимодействует с кислородом, серой и галогенами, образуя соединения меди (II): 2Cu + O2 = 2CuO Cu + Cl2 = CuCl2 Исключением является реакция с иодом, при которой получается иодид меди (I). Во влажном воздухе изделия из меди покрываются “патиной” - смесью основных сульфатов и карбонатов меди (II). Серебро на воздухе в присутствии сероводорода темнеет в результате образования сульфида серебра (I): Ag + 2H2S + O2 = 2Ag2S + 2 H2O Медь и серебро характеризуются положительными значениями стандартных окислительно-восстановительных потенциалов, поэтому они устойчивы в водных средах различной кислотности (в воде, водн. NaOH, водн. HCl и др. кислотах “неокислителях”). Медь и серебро реагируют с разбавленной и концентрированной азотной и концентрированной серной кислотами: Cu + 2H2SO4 (конц.) = CuSO4 + SO2 + 2H2O Ag + 2HNO3(конц.) = AgNO3 + NO2 + H2O Если в растворе возможно образование комплексного соединения, восстановительные свойства металлического серебра усиливаются, например, в присутствии цианидов серебро окисляется кислородом: 4Ag + O2 + 8CN- + 2H2O = 4[Ag(CN)2] - + 4OH – Диаграмма Латимера для меди: +0,337
| ||||||||
|
| Поделиться: |

 Щелочными металлами называют элементы главной подгруппы первой группы периодической системы Д. И. Менделеева. К ним относятся литий Li, натрий Na, калий К, рубидий Rb, цезий Сs и франций Fr. Щелочными их называют потому, что их гидроксиды хорошо растворяются в воде и представляют собой сильные щелочи.
Щелочными металлами называют элементы главной подгруппы первой группы периодической системы Д. И. Менделеева. К ним относятся литий Li, натрий Na, калий К, рубидий Rb, цезий Сs и франций Fr. Щелочными их называют потому, что их гидроксиды хорошо растворяются в воде и представляют собой сильные щелочи. Во IIА подгруппу периодической системы Д.И.Менделеева входят элементы бериллий Ве, магний Mg, кальций Са, стронций Sr, барий Ва, радий Ra. Входящие в IIА подгруппу кальций, стронций, барий и радий называют щелочноземельными металлами, так как гидроксиды их обладают щелочными свойствами, а оксиды сходны с оксидами алюминия и тяжелых металлов (так называемых “земель”). Бериллий (и отчасти, магний) существенно отличаются от остальных элементов II А подгруппы. По ряду свойств бериллий похож на алюминий, а магний - на цинк.
Во IIА подгруппу периодической системы Д.И.Менделеева входят элементы бериллий Ве, магний Mg, кальций Са, стронций Sr, барий Ва, радий Ra. Входящие в IIА подгруппу кальций, стронций, барий и радий называют щелочноземельными металлами, так как гидроксиды их обладают щелочными свойствами, а оксиды сходны с оксидами алюминия и тяжелых металлов (так называемых “земель”). Бериллий (и отчасти, магний) существенно отличаются от остальных элементов II А подгруппы. По ряду свойств бериллий похож на алюминий, а магний - на цинк.
 Mg(OH)2 Mg2 + + 2OH-
Mg(OH)2 Mg2 + + 2OH-


 [Be(OH)4]2- + 2H+ Be(OH)2 + 2H2O Be2+ + 2OH-
[Be(OH)4]2- + 2H+ Be(OH)2 + 2H2O Be2+ + 2OH- Алюминий входит в главную подгруппу III группы периодической системы Д.И.Менделеева. На внешнем электронном слое атома три электрона: Al..3s23p1; при возбуждении: Al*….3s13p2. Поэтому в соединениях алюминий проявляет степень окисления +3.По своим свойствам он резко отличается от бора и обладает ярко выраженными металлическими свойствами. Из-за устойчивой оксидной пленки алюминий не растворяется в воде, несмотря на высокое значение электродного потенциала (-1,66 В). Оксидная пленка растворяется в кислотах (с трудом) и в щелочах. Оксид алюминия амфотерен.
Алюминий входит в главную подгруппу III группы периодической системы Д.И.Менделеева. На внешнем электронном слое атома три электрона: Al..3s23p1; при возбуждении: Al*….3s13p2. Поэтому в соединениях алюминий проявляет степень окисления +3.По своим свойствам он резко отличается от бора и обладает ярко выраженными металлическими свойствами. Из-за устойчивой оксидной пленки алюминий не растворяется в воде, несмотря на высокое значение электродного потенциала (-1,66 В). Оксидная пленка растворяется в кислотах (с трудом) и в щелочах. Оксид алюминия амфотерен.


 Al+3 Al(OH)3 ¯ [Al(OH)4] -
Al+3 Al(OH)3 ¯ [Al(OH)4] -
 Al+3 + H2O AlOH2+ + H+ (рН <<7) (I ступень)
Al+3 + H2O AlOH2+ + H+ (рН <<7) (I ступень)
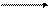 (AlOH) 2+ + H2O [Al(OH)2]+ + H + (II ступень)
(AlOH) 2+ + H2O [Al(OH)2]+ + H + (II ступень)
 [Al(OH)2]+ + H2O Al(OH)3 + H+ (III ступень)
[Al(OH)2]+ + H2O Al(OH)3 + H+ (III ступень)
 AlO2- + H2O HAlO2 + -OH (pH >7)
AlO2- + H2O HAlO2 + -OH (pH >7) Олово и свинец - металлы IV А подгруппы периодической системы Д.И.Менделеева. Электронные формулы валентных электронов этих металлов:
Олово и свинец - металлы IV А подгруппы периодической системы Д.И.Менделеева. Электронные формулы валентных электронов этих металлов:
 Sn(OH)2 Sn(OH)4
Sn(OH)2 Sn(OH)4
 SnO2
SnO2
 Sn4+ Sn2+ Sn0
Sn4+ Sn2+ Sn0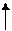 -0,96 -0,79
-0,96 -0,79
 [Sn(OH)6]2- [Sn(OH)6]4-
[Sn(OH)6]2- [Sn(OH)6]4-
 PbS
PbS

 PbSO4
PbSO4
 PbO2 Pb2+ Pb0
PbO2 Pb2+ Pb0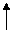 0,305 -0,538
0,305 -0,538 
 [Pb(ОН)6]2- [Pb(OH)4]2-
[Pb(ОН)6]2- [Pb(OH)4]2- Элементы II B подгруппы имеют завершенную конфигурацию валентных электронов ns2 (n-1)d10 и проявляют постоянную валентность, равную 2.
Элементы II B подгруппы имеют завершенную конфигурацию валентных электронов ns2 (n-1)d10 и проявляют постоянную валентность, равную 2.

 +0,920 +0,788
+0,920 +0,788 +0,53 +0,2676
+0,53 +0,2676
 HgCl2 Hg2Cl2
HgCl2 Hg2Cl2
 [НgX4]2- Hg2X2
[НgX4]2- Hg2X2 X=I, +0,116 X=I, -0,0405
X=I, +0,116 X=I, -0,0405 X= I, -0,038
X= I, -0,038 Медь и серебро d- металлы IБ подгруппы. Электронные формулы валентных электронов атомов металлов: Cu... 3d10 4s1
Медь и серебро d- металлы IБ подгруппы. Электронные формулы валентных электронов атомов металлов: Cu... 3d10 4s1



