
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опыт 1. (Демонстрационный) Взаимодействие магния и кальция с кислородом.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Небольшой кусочек стружки магния, пинцетом внести в пламя горелки и после воспламенения сжечь его над фарфоровым тиглем. К собранному в тигле оксиду магния прилить 1... 2 мл воды и добавить 1 каплю фенолфталеина. Аналогичный опыт провести с кальцием. Объяснить происходящие явления и написать уравнения реакций.
Опыт 2. (Демонстрационный). Взаимодействие магния и кальция с водой. В химический стакан с водой добавить 1... 2 капли фенолфталеина и внести пинцетом небольшую стружечку (лучше немного порошка) магния и наблюдать за протеканием реакции. Аналогичный опыт провести с кальцием. Объяснить происходящие явления и написать уравнения реакций. Сопоставить активность металлов по отношению к воде.
Опыт3.Свойства гидроксидов бериллия и магния. а) В две пробирки налить по 3... 5 капель раствора хлорида бериллия и добавить в каждую пробирку раствор гидроксида натрия по каплям до образования осадка. Отметить цвет осадка. Затем в одну пробирку добавить HCl, а в другую - NaOH до растворения осадков. Описать наблюдения, дать объяснения. Написать уравнения реакций. Какими свойствами обладает Ве(ОН)2? б) В две пробирки налить по 3... 5 капель раствора хлорида магния и раствора NaOH до образования осадка. Отметить цвет осадка. Затем в одну пробирку добавить 3... 5 капель (избыток) NaOH, а в другую - столько же HCl. В обеих ли пробирках растворяется осадок? Какими свойствами обладает Mg(OH)2? Дать объяснения наблюдениям. Написать уравнения реакций.
Опыт 4.Сравнение способности к гидролизу растворов солей Be, Mg, Ca. На три бумажки универсального индикатора нанести по капле растворов BeCl2, MgCl2, CaCl2 (отдельно!). Сравнить полученные цвета индикаторных бумажек с цветной шкалой универсального индикатора. Записать рН растворов. Написать уравнения реакций гидролиза. Гидролиз какой соли идет в большей степени?
Опыт 5. Получение осадков солей металлов II А подгруппы а) В три пробирки налить (отдельно!) по 2... 3 капли растворов солей кальция, стронция, бария и прилить в каждую пробирку по 2... 3 капли раствора сульфата натрия (Na2SO4). Отметить внешний вид, цвет и количество выпавших осадков. Все ли осадки выпадают с одинаковой скоростью? Чем это объяснить? Написать уравнения реакций. б) Налить в пробирку 2... 3 капли раствора соли бария и добавить столько же раствора хромата калия K2CrO4. Отметить внешний вид и цвет выпавшего осадка. Написать уравнение реакции. Объяснить, почему выпал осадок. в) Налить в пробирку 2... 3 капли раствора соли кальция и добавить столько же раствора щавелевокислого аммония (NH4)2C2O4. Отметить цвет, внешний вид и количество выпавшего осадка. Почему выпал осадок? Написать уравнение реакции.
Опыт 6 (Демонстрационный). Окрашивание пламени солями элементов II А подгруппы Обработать нихромовую проволоку концентрированной HCl и прокалить в пламени спиртовой горелки, затем опустить её в раствор соли щелочноземельного металла (Са, Sr, Ba) и вновь внести в пламя спиртовой горелки. В какие цвета окрашивают пламя соли испытуемых металлов?
Контрольные вопросы 1. Какими физическими и химическими свойствами обладают щелочноземельные металлы? 2. Магний сожгли на воздухе. Продукты реакции обработали водой. Какие соединения при этом образовались? Написать уравнения реакций. 3. Как изменит окраску лакмус в растворах солей а) хлорида магния; б) хлорида бария? 4. Осуществить превращения, назвать соединения: Са ® СаО ® Са(ОН)2 ® СаСО3 ® Са(НСО3)2 ® СаСl2 5. В сосуд с водой поместили 15,6 г смеси кальция и оксида кальция. Вычислить массу каждого из веществ, зная, что в результате реакции выделилось 5,6 л газа (н.у.). 6. При прокаливании 12 г известняка выделилось 2,24 л оксида углерода (IV) (н.у.). Определить массовую долю карбоната в навеске известняка. 7. Определить массу осадка, образующегося при приливании избытка раствора карбоната натрия к 200 г 20%-ного раствора хлорида кальция. 8. К 100 мл 0,25 М раствора CaCl2 прибавили равный объём 0,25 М раствора Na2SO4. Сколько мг ионов Са2+ осталось в растворе? (ПРCaSO4 = 6,1 × 10-5). (Ответ: 62,2 мг). 9. Сколько алебастра можно получить при обжиге 1 т гипса? 10. На сколько увеличится масса 1 кг алебастра при его переводе в гипс? 11. Составить схему электролиза а) расплава хлорида магния; б) водного раствора хлорида магния. 12. Какая вода называется жесткой? Химические способы умягчения воды. 13. Написать уравнения реакций для следующих превращений: Mg ® Mg(NO3)2 ® MgO ® MgSO4 ® Mg(HSO4)2 14. Написать уравнения реакций для следующих превращений: CaCl2 ® Ca ® CaO ® Ca(OH)2 ® СaOCl2 15. Написать уравнения реакций для следующих превращений: Sr ® Sr(OH)2 ® SrCO3 ® Sr(NO3)2 ® t Х 16. Написать уравнения реакций для следующих превращений: BaCl2 ® BaSO4 ® BaCO3 ® BaO ® Ba(OH)2 17. Написать уравнения реакций: а).BaO + NO2 ® б). Ca + HNO3 ® в).Be(OH)2 + KOH ® 18. Написать уравнения реакций: а). BaSO4 + C ® б). BeF2 + NaF ® в). CaH2 + H2O ® 19. Написать уравнения реакций для следующих превращений: Ca3(PO4)2 ® Ca(HSO4)2 ® CaSO4 ® CaS ® CaCl2 20. Написать уравнения реакций для следующих превращений: ВaCl2 ® BaCrO4 ® Ba(NO3)2 ® BaCO3 ® BaO. 21. Написать уравнения реакций: а). Mg + N2 ® б). CaC2 + H2O ® в). Mg(OH)2 + NH4Cl ®
Алюминий
Al2O3 + 6 H+ ® 2 Al+3 + 3 H2O Al2O3 + 2OH- + 3H2O ® 2[Al(OH)4] - Алюминий, лишенный защитной пленки, взаимодействует с водой: 2Al + 6 H2O ® 2 Al(OH)3 + 3 H2, Алюминий активно реагирует с кислотами 2 Al + 6 H+ ® 2 Al+3 + 3 H2, и с водными растворами щелочей 2Al + 2OH- + 6 H2O ® 2[Al(OH)4]- + 3H2. Гидроксид алюминия Al(OH)3 - типичное амфотерное соединение: свежеприготовленный легко растворяется в кислотах и в щелочах. OH- OH-
H+ H+ Для получения осадка Al(OH)3 щелочь обычно не используют из-за легкости перехода осадка в раствор, а действуют на соли алюминия гидроксидом аммония, причем при комнатной температуре образуется Al(OH)3 (ортоалюминиевая кислота H3AlO3), а при кипячении - AlO(OH) (метаалюминиевая кислота HAlO2) AlCl3 + 3 NH4OH = Al(OH)3¯ + 3NH4Cl t AlCl3 + 3 NH4OH = HAlO2 + 3NH4Cl + H2O Соли алюминия и сильных кислот хорошо растворимы в воде и подвергаются в значительной степени гидролизу по катиону, создавая сильнокислотную среду, в которой возможно растворение металлов, например, Mg или Zn:
При определенных условиях (нагревание, подщелачивание) гидролиз протекает и по следующим ступеням
В растворах метаалюминатов (NaAlO2) среда щелочная из-за гидролиза по аниону
Алюминий - важнейший конструкционный металл, основа легких коррозионно-стойких сплавов (с магнием - дюралюмин или дюраль, с медью - бронза). Чистый алюминий в больших количествах идет на изготовление посуды и электрических проводов.
Лабораторная работа №3
|
||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 579; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.135.249.76 (0.007 с.) |

 Алюминий входит в главную подгруппу III группы периодической системы Д.И.Менделеева. На внешнем электронном слое атома три электрона: Al..3s23p1; при возбуждении: Al*….3s13p2. Поэтому в соединениях алюминий проявляет степень окисления +3.По своим свойствам он резко отличается от бора и обладает ярко выраженными металлическими свойствами. Из-за устойчивой оксидной пленки алюминий не растворяется в воде, несмотря на высокое значение электродного потенциала (-1,66 В). Оксидная пленка растворяется в кислотах (с трудом) и в щелочах. Оксид алюминия амфотерен.
Алюминий входит в главную подгруппу III группы периодической системы Д.И.Менделеева. На внешнем электронном слое атома три электрона: Al..3s23p1; при возбуждении: Al*….3s13p2. Поэтому в соединениях алюминий проявляет степень окисления +3.По своим свойствам он резко отличается от бора и обладает ярко выраженными металлическими свойствами. Из-за устойчивой оксидной пленки алюминий не растворяется в воде, несмотря на высокое значение электродного потенциала (-1,66 В). Оксидная пленка растворяется в кислотах (с трудом) и в щелочах. Оксид алюминия амфотерен.


 Al+3 Al(OH)3 ¯ [Al(OH)4] -
Al+3 Al(OH)3 ¯ [Al(OH)4] -
 Al+3 + H2O AlOH2+ + H+ (рН <<7) (I ступень)
Al+3 + H2O AlOH2+ + H+ (рН <<7) (I ступень)
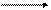 (AlOH) 2+ + H2O [Al(OH)2]+ + H + (II ступень)
(AlOH) 2+ + H2O [Al(OH)2]+ + H + (II ступень)
 [Al(OH)2]+ + H2O Al(OH)3 + H+ (III ступень)
[Al(OH)2]+ + H2O Al(OH)3 + H+ (III ступень)
 AlO2- + H2O HAlO2 + -OH (pH >7)
AlO2- + H2O HAlO2 + -OH (pH >7)


