
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Методы получения серной кислоты.Содержание книги Похожие статьи вашей тематики
Поиск на нашем сайте Введение Серная кислота является одним из основных продуктов химической промышленности и применяется в различных отраслях народного хозяйства. Существенное достоинство серной кислоты состоит в том, что она не дымит, не имеет запаха, при комнатной температуре находится в жидком состоянии и в концентрированном виде не действует на черные металлы. Основная же особенность серной кислоты состоит в том, что она принадлежит к числу сильных кислот и является самой дешевой кислотой (она примерно в два раза дешевле азотной и хлороводородной кислот). Серная кислота находит разнообразное применение в нефтяной, металлургической и других отраслях промышленности, она широко используется в производстве различных солей и кислот, всевозможных органических продуктов, красителей, дымообразующих и взрывчатых веществ и др., применяется в качестве водоотнимающего и осушающего средства, используется в процессах нейтрализации, травления и многих других. Исходным веществом для производства серной кислоты является диоксид серы SO2, который образуется в результате сжигания серы или другого серосодержащего сырья. Переработка SO2 в серную кислоту включает его окисление и последующее присоединение воды к триоксиду серы. Скорость взаимодействия диоксида серы с кислородом в обычных условиях очень мала, поэтому в промышленности эту реакцию проводят на катализаторе (контактный метод производства серной кислоты) или с применением передатчиков кислорода (нитрозный метод производства серной кислоты). При этом обжиг сырья и получение обжигового газа в обоих случаях одинаковы. В данной курсовой работе представлен способ получения серной кислоты методом мокрого катализа, который широко используется в наши дни. Химический состав серной кислоты выражается формулой H2SO4 (молекулярная масса 98,08).
валентно-структурная формула Серную кислоту следует рассматривать как соединение одной молекулы триоксида серы SO3 (ангидрид серной кислоты) с одной молекулой воды; следовательно, безводная серная кислота содержит 81,63 % мас. SO3 и 18,37 % мас. H2O. В технике под серной кислотой подразумевают любые смеси триоксида серы с водой. Если на 1 моль SO3 приходится более 1 моль Н2О, смеси являются водными растворами серной кислоты, если менее 1 моль воды, то это растворы серного ангидрида в серной кислоте, которые называют олеумом, или дымящей серной кислотой. Состав водных растворов серной кислоты характеризуется содержанием H2SO4 или SO3 (в %), состав олеума – содержанием общего или свободного серного ангидрида, а также количеством H2SO4, которое можно получить при добавлении к олеуму воды. Серная кислота – одна из самых активных неорганических кислот. Она реагирует почти со всеми металлами, и их оксидами, вступает в реакции обменного разложения, энергично соединяется с водой, обладает окислительными и другими важными химическими свойствами. Высокая химическая активность серной кислоты обусловила ее широкое применение в различных отраслях промышленности. Безводная серная кислота представляет собой при 20 Вязкость оказывает существенное влияние на гидравлическое сопротивление при движении серной кислоты по трубам и желобам, на скорость процессов теплопередачи при нагревании и охлаждении серной кислоты, на скорость растворения в серной кислоте солей, металлов и других веществ. Максимум вязкости соответствует 84,5 %-ной и 100 %-ной серной кислоте. С повышением температуры вязкость серной кислоты уменьшается. Так, при повышении температуры от 20 до 80 Сорта серной кислоты. Промышленность выпускает несколько сортов серной кислоты, различающихся содержанием H2SO4 или SO3 (своб.), а также содержанием примесей. Нитрозным методом получают сравнительно низкоконцентрированную кислоту, содержащую 75 % мас. H2SO4, контактным методом может быть получена серная кислота практически любой концентрации. Состав и содержание примесей также зависят от метода производства серной кислоты. Например, при получении башенной серной кислоты в нее попадают частицы пыли, остающиеся в обжиговом газе даже после его очистки в сухих электрофильтрах. Кроме того, башенная кислота содержит растворенные оксиды азота. Серная кислота может быть также загрязнена продуктами коррозии аппаратуры, растворимыми в H2SO4, если кислота подвергается концентрированию, в ней могут находиться примеси, присутствовавшие в топочных греющих газах. Техническая серная кислота иногда окрашена в темный цвет, вследствие обугливания органических веществ, переходящих в кислоту в процессе ее производства, при хранении и перевозках. При производстве серной кислоты контактным методом обжиговый газ после удаления из него пыли подвергается тщательной специальной очистке. Поэтому контактная серная кислота содержит только растворимые продукты коррозии. Применяя аппаратуру, изготовленную из достаточно коррозионностойких материалов, можно получить контактную серную кислоту высокой чистоты. Требования к качеству различных сортов серной кислоты регламентируются стандартами и систематически пересматриваются в соответствии с изменениями техники производства кислоты и нужд ее потребителей. Например, контактная серная кислота имеет требования по ГОСТ 2184-77, техническая серная кислота имеет требования по ГОСТ 667-73, кислота серная особой чистоты имеет требования по ГОСТ 1462-78. Чтобы уменьшить возможность кристаллизации серной кислоты при перевозке и хранении, установлены стандарты на товарные сорта серной кислоты, концентрации которых соответствуют наиболее низким температурам ее кристаллизации. Требования к качеству различных сортов серной кислоты представлены в Табл. 1.1. Таблица 1.1
Температура кристаллизации технических сортов серной кислоты несколько ниже температуры кристаллизации чистой серной кислоты; с увеличением содержания примесей эта разница возрастает. Полученная в производстве серная кислота по качеству должна отвечать ГОСТ 2184-77. Характеристика серной кислоты приведена в Табл. 1.2. Таблица 1.2 -Химический состав серной кислоты, %
Улучшенную серную кислоту транспортируют в железнодорожных цистернах из кислотостойкой стали с нанесением трафаретов "Улучшенная серная кислота", "Опасно", а также трафарета приписки. По согласованию с потребителем допускается транспортировать улучшенную серную кислоту по кислотопроводу из стали марки СтЗ по требованию ГОСТ 380 или нержавеющей стали. Техническую серную кислоту 1-го и 2-го сортов, башенную и регенерированную кислоты транспортируют в железнодорожных сернокислотных цистернах, а также в стальных контейнерах, стальных бочках по требованию ГОСТ 6247 или поставляют потребителю перекачкой по кислотопроводу из стали марки Ст3 по требованию ГОСТ 380. На бочки и контейнеры наносится транспортная маркировка по требованию ГОСТ 14192. На бочки, контейнеры и цистерны наносится знак опасности по требованию ГОСТ 19433, класс 8, подкласс 8.1, черт. 8, классификационный шифр 8111, серийный номер ООН 1830 (кроме регенерированной кислоты. Трафареты на цистерны заполняются в соответствии с правилами перевозки грузов. Техническую серную кислоту транспортируют железнодорожным транспортом в цистернах и автомобильным транспортом в контейнерах и бочках в соответствии с правилами перевозок грузов, действующими на каждом виде транспорта. Заполнение цистерн, контейнеров и бочек рассчитывают с учетом полного использования их вместимости и объемного расширения продукта при возможном перепаде температур в пути следования. Техническая серная кислота 1-го и 2-го сортов, улучшенный и технический олеум, башенная и регенерированная кислоты должны храниться в емкостях из стали или спецстали, как нефутерованных, так и футерованных кислотоупорным кирпичом или кислотоустойчивым материалом. Улучшенная серная кислота должна храниться у потребителя в чистых герметически закрытых емкостях из нержавеющей стали или емкостях из стали марки Ст3 по требованию ГОСТ 380, футерованных кислотоупорными плиткой или кирпичом.
Сероводород Сероводород является примесью попутного, природного, коксового газов, продуктов нефтепереработки. Обычно указанные газы содержат от 0,3 до 1,5 % мас. H2S. Отдельные месторождения попутного газа содержат до 20 % мас. H2S. Такой газ может быть переработан в серную кислоту методом «мокрого катализа». В основном, этот метод создан для того, чтобы снизить выбросы серосодержащих газов и максимально перерабатывать сырье. Температура сжигания H2S поддерживается в пределах от 900 до 1000оС Сероводородный газ, выделяемый при очистке технологических и др. газов, подразделяют на концентрированный (от 90 до 94 % мас. H2S) и низкоконцентрированный (от 3 до 7 % мас.). Сероводородный газ встречается в виде примесей в природном газе, вследствие чего затрудняется транспортировка, в связи с тем, что сероводород вызывает сильную коррозию газового оборудования (трубы, ёмкости теплообменников и т. д.). Поэтому при транспортировке следует подготовить и трубопровод. Широкое применение здесь находят азотные установки, которые применяются для создания инертной среды в трубопроводе. Сероводород, хранят в конденсированном виде при низкой температуре или в газометрах над насыщенным раствором хлорида натрия. Для совершенно чистого и сухого газа в качестве затворной жидкости можно использовать и ртуть. Вода Вода в производстве серной кислоты используется для охлаждения в холодильниках технологических кислот промывного, сушильно – абсорбционного отделений и подшипников нагнетателей газа. Вода по качеству подразделяется на свежую производственную и оборотную. Свежая вода регламентируется требованиями ГОСТ 2874 – 83 «Питьевая вода», а оборотная – требованиями качества оборотной воды, утвержденными главным инженером. Подача воды в производство осуществляется от действующей системы водоснабжения промплощадки комбината. Оборотная вода подается от действующей системы водооборота сернокислотного цеха. Воздух Воздух в химической промышленности применяют в основном как сырье или как реагент в технологических процессах, а также для энергетических целей. Технологическое применение воздуха обусловлено химическим составом атмосферного воздуха; сухой, чистый воздух содержит: N2+инертные газы ‑ 78,10 % об.; О2 ‑ 20,90 % об. Чаще всего используют кислород воздуха в качестве окислителя: окислительный обжиг сульфидных руд цветных металлов, серосодержащего сырья при получении диоксида серы в сернокислотном, целлюлозно-бумажном производствах; неполное окисление углеводородов при получении спиртов, альдегидов, кислот и др. Обжиг сероводорода. Процесс горения сероводорода можно описать следующим уравнением (3.1): H2S+1,5O2=SO2+H2O+Q (3.1) Предельная концентрация SО2 по этой реакции составляет 14,78% при воздушном дутье. Температура сжигания H2S поддерживается в пределах 900-1000оС (при более высокой температуре идет фиксация азота с образование оксидов). Данная реакция идёт с выделением тепла. Тепловой эффект данной реакции равен 523,33 кДж/моль. Окисление диоксида серы. В производстве серной кислоты контактным методом окисление SO2 по уравнению реакции (3.2) и происходит в присутствии катализатора.
Энергия активации Е реакции очень велика, поэтому без катализатора реакция гомогенного окисления практически не идет даже при высокой температуре. В присутствии твердых катализаторов энергия активации снижается, а скорость гетерогенной каталитической реакции возрастает. Газ приводят в соприкосновение с катализатором, находящимся в стационарном или псевдоожиженном состоянии. Способность ускорять окисление SO2 обладают различные металлы, их сплавы и оксиды, некоторые соли, силикаты и многие другие вещества. Каждый катализатор обеспечивает определенную, характерную для него степень превращения – количество окисленного SO2 к общему первоначальному количеству SO2 в газе. В заводских условиях выгоднее пользоваться катализаторами, при помощи которых достигается наибольшая степень превращения, так как остаточное количество неокисленного SO2 не улавливается в абсорбционном отделении, а удаляется в атмосферу вместе с отходящими газами. Длительное время лучшим катализатором данного процесса считали платину, которую в мелкораздробленном состоянии наносили на волокнистый асбест, силикагель или сульфат магния. Однако платина, хотя и обладает наивысшей каталитической активностью, очень дорога, кроме того, ее активность сильно снижается при наличии в газе самых незначительных количеств мышьяка, селена, хлора и других примесей. Поэтому применение катализатора из платины приводило к усложнению аппаратного оформления из-за необходимости тщательной очистки газа и повышало стоимость готовой продукции. Среди неплатиновых катализаторов наибольшей каталитической активностью обладает ванадиевый катализатор (на основе пентоксида ванадия V2O5), он более дешевый и менее чувствительный к примесям, чем платиновый катализатор. Промышленный ванадиевый катализатор (ванадиевая контактная масса) представляет собой смесь каталитически активного вещества V2O5, некоторых веществ, повышающих активность V2О5, - активаторов (соединение оксида с пиросульфатом калия Реакция окисления SO2 экзотермична; тепловой эффект ее, как и любой химической реакции. Зависит от температуры представлена в Табл. 3.1.
Таблица 3.1- Зависимость теплоты реакции от температуры.
Реакция окисления SO2 в SO3 обратима. Константа равновесия этой реакции (в Па-0,5) можно рассчитать по формуле (3.3).
где Степень превращения SO2, достигаемая на катализаторе, зависит от его активности, состава газа, продолжительности контакта газа с катализатором, давления и др. Для газа данного состава теоретически возможная, т.е. равновесная степень превращения, зависит от температуры и выражается по формуле (3.4).
где Р – общее давление газа, Па a – начальное содержание SO2 в газовой смеси, доли единицы, b – начальное содержание O2 в газовой смеси, доли единицы. В производственных условиях существенное значение имеет скорость окисления SO2. от скорости этой реакции зависит количество диоксида серы, окисляющегося в единицу времени на единице массы катализатора, и, следовательно, расход катализатора, размеры контактного аппарата и другие технико-экономические показатели процесса. Процесс стремятся вести так, чтобы скорость окисления SO2, а также степень превращения были возможно более высокие. Очень важным показателем качества контактной массы является температура зажигания, при которой каталитический процесс начинает протекать с достаточной для практических целей скоростью. Температура зажигания ванадиевой контактной массы зависит не только от качества катализатора, но и от состава газовой смеси. Она повышается с уменьшением содержания кислорода в газе. С течением времени температура зажигания контактной массы в промышленных аппаратурах повышается, поэтому постепенно увеличивают температуру газа на входе в первый слой катализатора. В промышленных аппаратах активность ванадиевой контактной массы со временем снижается, поэтому катализатор полностью или частично заменяют через каждые 3 – 5 лет. Как известно, каталитическая активность контактной массы снижается в присутствии небольших количеств так называемых контактных ядов, отравляющих катализатор. Ванадиевая масса более устойчива к действию контактных ядов, чем платиновая, но все же в присутствии некоторых примесей в обжиговом газе (мышьяк и фтор) заметно теряет активность. Действие мышьяка на ванадиевый катализатор значительно слабее, чем на платиновый. Мышьяк поглощается контактной массой и находится в ней в виде As2O5 и KAsO3. при последующей продувке газовой смесью, не содержащей мышьяка, активность контактной массы несколько повышается, но полностью не восстанавливается и остается значительно ниже первоначальной. Фтор в производстве серной кислоты может находиться в виде SiF4 и HF, оба соединения могут оказывать вредное влияние на работу ванадиевой контактной массы. При небольшом содержании в газе фтористых соединений и высокой температуре процесса окисления SiF4 реагирует с имеющимися в газе парами воды по уравнению реакции (3.5).
В результате выделяющийся SiO2 блокирует поверхность ванадиевой контактной массы и ее каталитическая активность снижается, поэтому содержание SiF4 в газе перед контактным аппаратом не должно превышать 3 мг/м3. При высокой концентрации в газе HF и малом содержании паров воды равновесие реакции смещается влево, фтористый водород реагирует с SiO2 контактной массы и ее объем уменьшается. Условия окисления Скорость процесса окисления SO2 в SO3 на ванадиевом катализаторе (в неподвижном слое) выражается по формулам (3.6) и (3.7).
где X – степень превращения, доли единицы; τ – время контакта, с; к – константа скорости реакции, с-1Па-1; а – начальная концентрация SO2, доли единицы; b – начальная концентрация кислорода, доли; Р – общее давление, Па; КР – константа равновесия, Па-0,5. Из уравнений (3.6) следует, что скорость процесса окисления зависит от константы скорости реакции к, которая очень сильно возрастает с повышением температуры. Однако при этом уменьшается константа равновесия КР. Таким образом, скорость процесса окисления зависит от двух величин, одна из которых с повышением температуры увеличивается, а другая уменьшается. Также скорость окисления зависит и от состава газовой смеси. Поэтому при различном составе газа оптимальные температуры для данных степеней превращения будут неодинаковы. Конденсация триоксида серы После контактного аппарата газы, содержащие серный ангидрид и пары воды с температурой 430-45 nSO3 +H2O = H2SO4 + (n – 1)SO3 (3.12) При охлаждении газов внизу башни пары воды и Туман серной кислоты из башни с температурой 60.70 Контактный аппарат. В установках мокрого катализа, работающих на концентрированном сероводороде, применяются два типа контактных аппаратов: четырехслойные аппараты с охлаждением реакционного газа во встроенных теплообменниках и четырехслойные аппараты с регулированием температуры реакционного газа поддувом холодного воздуха. Четырехслойный аппарат с охлаждением реакционного газа во встроенных теплообменниках представлен на рисунке 3.3. В качестве охлаждающего агента используется воздух, подаваемый в U-образные трубки теплообменников специальным вентилятором. Воздух поступает во все теплообменники параллельно. Для предотвращения конденсации серной кислоты на трубках теплообменников применяется частичная рециркуляция воздуха, который вводится в теплообменник при температуре около 250 °С. Для выравнивания температурного поля после теплообменников установлены смесители. Такие аппараты надежны в эксплуатации, однако имеют большую высоту и требуют большого расхода металла. Четырехслойный аппарат с регулированием температуры реакционного газа поддувом холодного воздуха после первого, второго и третьего слоев контактной массы представлен на рисунке 3.4. Обычно они используются в установках мокрого катализа на нефтеперерабатывающих заводах. Концентрация сернистого ангидрида в газе на входе в первый слой катализатора от 8,5 до 9,5 %. За счет поддува воздуха объем реакционной смеси на выходе из аппарата в полтора раза больше объема газа на входе в него. Аппарат такой конструкции проще аппарата с теплообменниками, имеет меньшую высоту и вес. Однако при поддуве холодного воздуха необходимо предусматривать такие меры по защите от коррозии внутренних элементов аппарата, как футеровка, применение легированных сталей, что повышает стоимость аппарата. В Табл. 3.2 приведены технические характеристики аппаратов, работающих на сернистом газе, получаемом сжиганием сероводорода. Контактные аппарат относятся к: - непрерывным реакторам (реагенты и продукты непрерывно вводятся и выводятся из аппарата) - политермическим (разно температурные реакторы); - нестационарным (параметры процесса меняются во времени); - газовым реакторам (по фазовому составу реакционной смеси).
Рисунок 3.3- Четырехслойный аппарат с охлаждением реакционного газа во встроенных теплообменниках.
Рисунок 3.4- Четырехслойный аппарат с регулированием температуры реакционного газа поддувом холодного воздуха.
Таблица 3.2- Характеристика контактных аппаратов для переработки
газов, получаемых сжиганием сероводорода. Башня-конденсатор. Из контактного аппарата газ, содержащий S03, поступает в башню-конденсатор, представляющую собой скруббер с насадкой, орошаемый кислотой. Серный скруббер по своей конструкции и размерам не отличается от бензольных скрубберов. Его размеры: диаметр от 3 до 6 м и высота до 40 м. Он также заполнен деревянной хордовой насадкой. Допустимая скорость газа в серном скруббере, отнесенная к его полному сечению, составляет 0,7—0,8 м/сек. Необходимая поверхность орошения насадки на 1 м3 в час газа, приведенного к нормальным условиям (0° и 760 мм рт. ст.), равна 0,5—0,6 м2. При установке нескольких серных скрубберов они включаются последовательно, не более двух скрубберов на каждый газовый поток. Олеумный абсорбер относится к: - непрерывным реакторам; - адиабатического типа (отсутствие передачи тепла во внешнюю среду); - нестационарным; - жидкостным реакторам;
Введение Серная кислота является одним из основных продуктов химической промышленности и применяется в различных отраслях народного хозяйства. Существенное достоинство серной кислоты состоит в том, что она не дымит, не имеет запаха, при комнатной температуре находится в жидком состоянии и в концентрированном виде не действует на черные металлы. Основная же особенность серной кислоты состоит в том, что она принадлежит к числу сильных кислот и является самой дешевой кислотой (она примерно в два раза дешевле азотной и хлороводородной кислот). Серная кислота находит разнообразное применение в нефтяной, металлургической и других отраслях промышленности, она широко используется в производстве различных солей и кислот, всевозможных органических продуктов, красителей, дымообразующих и взрывчатых веществ и др., применяется в качестве водоотнимающего и осушающего средства, используется в процессах нейтрализации, травления и многих других. Исходным веществом для производства серной кислоты является диоксид серы SO2, который образуется в результате сжигания серы или другого серосодержащего сырья. Переработка SO2 в серную кислоту включает его окисление и последующее присоединение воды к триоксиду серы. Скорость взаимодействия диоксида серы с кислородом в обычных условиях очень мала, поэтому в промышленности эту реакцию проводят на катализаторе (контактный метод производства серной кислоты) или с применением передатчиков кислорода (нитрозный метод производства серной кислоты). При этом обжиг сырья и получение обжигового газа в обоих случаях одинаковы. В данной курсовой работе представлен способ получения серной кислоты методом мокрого катализа, который широко используется в наши дни. Химический состав серной кислоты выражается формулой H2SO4 (молекулярная масса 98,08).
валентно-структурная формула Серную кислоту следует рассматривать как соединение одной молекулы триоксида серы SO3 (ангидрид серной кислоты) с одной молекулой воды; следовательно, безводная серная кислота содержит 81,63 % мас. SO3 и 18,37 % мас. H2O. В технике под серной кислотой подразумевают любые смеси триоксида серы с водой. Если на 1 моль SO3 приходится более 1 моль Н2О, смеси являются водными растворами серной кислоты, если менее 1 моль воды, то это растворы серного ангидрида в серной кислоте, которые называют олеумом, или дымящей серной кислотой. Состав водных растворов серной кислоты характеризуется содержанием H2SO4 или SO3 (в %), состав олеума – содержанием общего или свободного серного ангидрида, а также количеством H2SO4, которое можно получить при добавлении к олеуму воды. Серная кислота – одна из самых активных неорганических кислот. Она реагирует почти со всеми металлами, и их оксидами, вступает в реакции обменного разложения, энергично соединяется с водой, обладает окислительными и другими важными химическими свойствами. Высокая химическая активность серной кислоты обусловила ее широкое применение в различных отраслях промышленности. Безводная серная кислота представляет собой при 20 Вязкость оказывает существенное влияние на гидравлическое сопротивление при движении серной кислоты по трубам и желобам, на скорость процессов теплопередачи при нагревании и охлаждении серной кислоты, на скорость растворения в серной кислоте солей, металлов и других веществ. Максимум вязкости соответствует 84,5 %-ной и 100 %-ной серной кислоте. С повышением температуры вязкость серной кислоты уменьшается. Так, при повышении температуры от 20 до 80 Сорта серной кислоты. Промышленность выпускает несколько сортов серной кислоты, различающихся содержанием H2SO4 или SO3 (своб.), а также содержанием примесей. Нитрозным методом получают сравнительно низкоконцентрированную кислоту, содержащую 75 % мас. H2SO4, контактным методом может быть получена серная кислота практически любой концентрации. Состав и содержание примесей также зависят от метода производства серной кислоты. Например, при получении башенной серной кислоты в нее попадают частицы пыли, остающиеся в обжиговом газе даже после его очистки в сухих электрофильтрах. Кроме того, башенная кислота содержит растворенные оксиды азота. Серная кислота может быть также загрязнена продуктами коррозии аппаратуры, растворимыми в H2SO4, если кислота подвергается концентрированию, в ней могут находиться примеси, присутствовавшие в топочных греющих газах. Техническая серная кислота иногда окрашена в темный цвет, вследствие обугливания органических веществ, переходящих в кислоту в процессе ее производства, при хранении и перевозках. При производстве серной кислоты контактным методом обжиговый газ после удаления из него пыли подвергается тщательной специальной очистке. Поэтому контактная серная кислота содержит только растворимые продукты коррозии. Применяя аппаратуру, изготовленную из достаточно кор
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-13; просмотров: 736; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.33 (0.014 с.) |

 бесцветную маслянистую жидкость, кристаллизующуюся при 10,37
бесцветную маслянистую жидкость, кристаллизующуюся при 10,37  для 100 %-ной H2SO4 достигает 1,8305 г/см3.
для 100 %-ной H2SO4 достигает 1,8305 г/см3. Требования к качеству различных сортов серной кислоты.
Требования к качеству различных сортов серной кислоты.
 (3.2)
(3.2) ), и носителя, который создает структурную основу катализатора. В производстве серной кислоты применяются в основном отечественные контактные массы(катализатор): масса БАВ(барий, алюминий, ванадий), масса СВД(сульфо-ванадато-диатомовая), СВС(сульфованадат на силикате) и ИК(Институт катализа). С течением времени активность ванадиевой массы снижается (из за засорения пор, взаимодействия ванадия с компонентами газовой смеси), поэтому для достижения максимальной степени превращения по мере протекания процесса постепенно повышают температуру газа на входе во все слои контактной массы, т.к. при низкой температуре может образоваться малоактивное соединение – сульфат ванадила VOSO4.
), и носителя, который создает структурную основу катализатора. В производстве серной кислоты применяются в основном отечественные контактные массы(катализатор): масса БАВ(барий, алюминий, ванадий), масса СВД(сульфо-ванадато-диатомовая), СВС(сульфованадат на силикате) и ИК(Институт катализа). С течением времени активность ванадиевой массы снижается (из за засорения пор, взаимодействия ванадия с компонентами газовой смеси), поэтому для достижения максимальной степени превращения по мере протекания процесса постепенно повышают температуру газа на входе во все слои контактной массы, т.к. при низкой температуре может образоваться малоактивное соединение – сульфат ванадила VOSO4.
 (3.3)
(3.3) равновесные парциальные давления SO3, SO2 и О2, Па. Величина Кр зависит от температуры: с повышением температуры константа равновесия снижается.
равновесные парциальные давления SO3, SO2 и О2, Па. Величина Кр зависит от температуры: с повышением температуры константа равновесия снижается. (3.4)
(3.4) (3.5)
(3.5) (3.6)
(3.6) (3.7)
(3.7)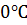 поступают в нижнюю часть башни-конденсатора, снабженного кольцевой насадкой, орошаемой серной кислотой, подаваемой насосом из циркуляционного сборника кислоты через аппарат воздушного охлаждения. Получение серной кислоты можно описать уравнением реакции (3.12).
поступают в нижнюю часть башни-конденсатора, снабженного кольцевой насадкой, орошаемой серной кислотой, подаваемой насосом из циркуляционного сборника кислоты через аппарат воздушного охлаждения. Получение серной кислоты можно описать уравнением реакции (3.12).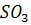 образуют пары серной кислоты, концентрация которых не превышает критическую величину, поэтому образование тумана серной кислоты здесь не происходит, в нижней части башни пары серной кислоты конденсируются на поверхности насадки. При дальнейшем движении газов вверх их охлаждении пересыщение паров
образуют пары серной кислоты, концентрация которых не превышает критическую величину, поэтому образование тумана серной кислоты здесь не происходит, в нижней части башни пары серной кислоты конденсируются на поверхности насадки. При дальнейшем движении газов вверх их охлаждении пересыщение паров  достигает критической величины и образуется туман.
достигает критической величины и образуется туман.




