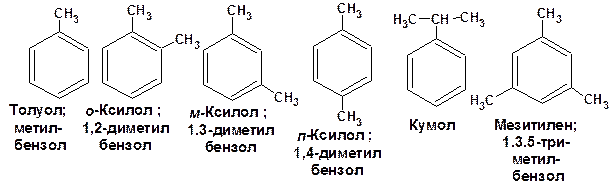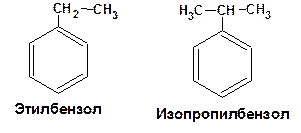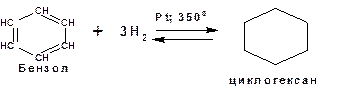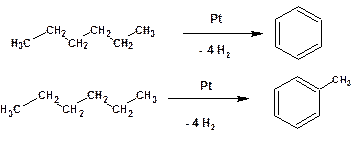Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Промышленные способы полученияСодержание книги
Поиск на нашем сайте
АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ Схема лекции. 1. Ароматичность 2. Изомерия, номенклатура. 3. Способы получения. 4. Физические свойства. 5. Химические свойства. 5.1. Реакции присоединения 5.2 Окисление бензола 5.4 Механизм реакции электрофильного замещения 5.5. Реакции электрофильного замещения катализируемые кислотами Бренстеда и σ-кислотами. 5.6. Реакции электрофильного замещения катализируемые кислотами Льюиса. 5.7. Правила ориентации в электрофильном ароматическом замещении. 5.8. Химические свойства боковых цепей.
АРОМАТИЧНОСТЬ.
В 1825г. Майкл Фарадей из светильного газа выделил новое вещество со своеобразным сильным запахом. Он назвал это вещество бензолом. В 1834 году Эрих Митчерлих получил
бензол декарбоксилированием бензойной кислоты и установил его эмпирическую формулу (СН)n или СnНn. Измерением плотности паров бензола была установлена молекулярная формула бензола С6Н6. Судя по молекулярной формуле бензол должен быть ненасыщенным соединением. Однако его химические свойства не соответствовали свойствам ненасыщенного соединения. Были только некоторые исключения из общего правила. Так бензол не реагировал с галоидводородами, но зато вступал в реакции с азотной кислотой с образованием продуктов замещения. Бензол при нагревании до температуры 7000С оставался устойчивым и не подвергался окислению или пиролизу. На бензол и его гомологи не действовал на холоду разбавленный раствор перманганата калия. На сам бензол также не действовал концентрированный раствор перманганата калия при нагревании, а у его гомологов окислялся алкильный радикал с образованием бензойной кислоты. Общая тенденция в химических свойствах бензола заключалась в том, что бензол инертен в реакциях присоединения и активен в реакциях замещения, причем в таких реакциях, где в роли атакующего реагента выступает электрофильная частица. Ненасыщенные соединения инертные в реакциях и активные в реакциях замещения были названы «ароматическими». Название сложилось исторически. За специфический запах, а также то, что призводные выделены из душистых природных веществ. В 1865г. Фридрих Кекуле предположил, что молекула бензола имеет циклическое строение. Внутри цикла атомы углерода связаны чередующимися двойными и простыми связями:
Однако для подобных структур должна была наблюдаться разница в свойствах дизамещенных производных бензола:
Однако подобное различие не наблюдалось. В 1930г американский ученый Майкл Дьюар предложил рассматривать бензол как совокупность резонансных структур:
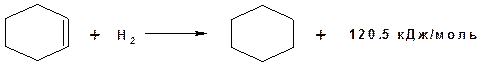
Возможность представления молекулы в виде резонансных структур указывает на высокую степень делокализации электронной плотности в молекуле бензола. Мы знаем, что чем выше степень делокализации электронной плотности тем выше устойчивость молекулы. Тезис о повышенной устойчивости молекулы бензола подтверждают расчеты для теплоты гидрирования. Так теплота гидрирования циклогексена:
Если бы бензол содержал три изолированные связи, то его теплота гидрирования составила бы: 120.5 × 3 = 361.5 кДж/моль
Однако экспериментальное значение теплоты гидрирования бензола значительно ниже:
Разность теплоты гидрироваания гипотетического 1,3,5-гексатриена с изолированными двойными связями и реальным бензолом равная: 361.5 – 208.4 = 153.1 кДж/моль называется энергией стабилизации. Энергия стабилизации обусловлена высокой степенью сопряжения или делокализации π-электронов в пределах циклической структуры. Определение: Углеводороды циклического строения, обладающие системой чередующихся двойных и простых связей и обладающих повышенной стабильностью – называются ароматическими углеводородами. Свойство повышенной стабильности углеводородов циклического строения, обладающих системой чередующихся двойных и простых связей называется ароматичностью. Ароматические углеводороды еще называют аренами. Ароматические соединения обладают особым свойством – они подчиняются так называемому правилу Хюккеля или правилу ароматичности: ароматическими являются органические соединения плоского строения, содержащие сопряженную систему, которая включает 4n+2 π-электрона в цикле. Для n=0 цикл должен содержать 2 π-электрона. Такому условию удовлетворяет циклопропенил-катион:
Для n=1 цикл должен содержать 6 π-электронов. Такому условию удовлетворяют:
Для n=2 цикл должен содержать 10 π-электронов. Такому условию удовлетворяет:
Для n=3 цикл должен содержать 14 π-электронов. Такому условию удовлетворяют:
ИЗОМЕРИЯ И НОМЕНКЛАТУРА
Ароматические соединения образуют гомологический ряд обще формулы СnH2n-6. Основоположником гомологического ряда является бензол. Бензол – тривиальное название. Кроме бензола очень часто употребляются тривиальные названия:
Употребляются рациональные названия:
По ситематической номенклатуре: 1. Расставляют локанты в цикле следующим образом:
2. Номер «1» присваивается той функциональной группе, у которой атом, непосредственно связанный с бензольным кольцом, имеет наменьшую массу. Например:
Теория химического строения допускает существование только одного монозамещенного бензола. Дизамещенных может быть три. Причем в дизамещенном бензоле положения носят определенные названия: 1,2- орто -; 1,3- мета- и 1,4- пара -. Возможна изомерия боковой цепи. Например, н -пропилбензол и изопропилбензол СПОСОБЫ ПОЛУЧЕНИЯ. ФИЗИЧЕСКИЕ СВОЙСТВА Ароматические углеводороды – обычно жидкости и реже твердые вещества – обладают сильным специфическим запахом и как правило токсичны. Причем многие являются канцерогенными веществами. Бензол относится к одним из наиболее опасных, самые безопасные это толуол и ксилолы. Температура кипения бензола 80.10С, что выше кипения соответствующего циклоалкана – циклогексана 68.80С. Изомеры с несколькими радикалами кипят при более высокой температуре, чем изомеры с одним радикалом. орто -Изомеры кипят при более высокой температуре, чем пара -изомеры. Но пара -изомеры имеют более высокую температуру плавления, чем орто -изомеры. Для ароматических соединений характерно наличие экзальтации молекулярной рефракции. Ароматические соединения с заместителями, обладающими большими мезомерными эффектами – как правило окрашены.
ХИМИЧЕСКИЕ СВОЙСТВА Химические свойства ароматических соединений делятся на две большие группы. 1. Химические свойства ароматического кольца. 2. Химические свойства заместителей. Ароматическое кольцо и заместители оказывают друг на друга определенное влияние. Поэтому свойства кольца рассматриваются обязательно при учете влияния заместителей, а свойства функциональных групп, выступающих в роли заместителей, обязательно рассматриваются отдельно от свойств ациклических и неароматических соединений. Химические свойства ароматического кольца рассматриваются на примере химических свойств бензола. Наиболее характерны для бензола реакции электрофильного замещения (SEAr), однако бензол способен вступать в некоторые реакции присоединения и как каждое органическое соединение способен вступать в реакции окисления (в том числе и горит с выделением большого количества копоти). Поскольку реакций присоединения меньше то и следует начать с них.
Реакции присоединения 1. Присоединение водорода с образованием циклогексана в присутствии платинового или палладиевого катализатора при температуре 3000С.
2. В жестких условиях под влиянием ультрафиолетового излучения или яркого солнечного света бензол способен присоединить три молекулы хлора:
Однако со временем или при нагревании гексахлорциклогексан отщепляет три молекулы хлористого водорода с образованием 1,3,5-трихлорбензола:
3. Бензол подвергается озонолизу:
При присоединении озона образуется триозонид (сильно взрывчатое вещество). Под действием воды озонид распадается с образованием трех молекул глиоксаля.
Окисление бензола Бензольное кольцо в условиях, в которых окисляются алкены и алкины - не окисляется. Бензол окисляют кислородом воздуха на катализаторе пентаоксиде ванадия:
Продуктом реакции является малеиновый ангидрид. Реакция заложена в основу промышленного способа производства малеинового ангидрида.
Сульфирование Сульфирование – это реакция замещения атома водорода в углеводороде на группу это реакция замещения атома водорода в углеводороде на группу –SO3H:
Существенным отличием реакции сульфирования от других реакций электрофильного замещения является ее обратимость. Электрофильным агентом в сульфировании концентрированной серной кислотой или моногидратом выступает нейтральная молекула серного ангидрида, образующаяся по схеме:
2. Нитрование – это реакция замещения атома водорода в углеводороде на группу –NO2. Бензол реагирует с концентрированной азотной кислотой медленно даже при нагревании. Поэтому нитрование обычно проводят действием нитрующей смеси. Это смесь концентрированной азотной и серной кислоты. Нитрование аренов нитрующей смесью является основным способом получения нитросоединений ароматического ряда. АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ Схема лекции. 1. Ароматичность 2. Изомерия, номенклатура. 3. Способы получения. 4. Физические свойства. 5. Химические свойства. 5.1. Реакции присоединения 5.2 Окисление бензола 5.4 Механизм реакции электрофильного замещения 5.5. Реакции электрофильного замещения катализируемые кислотами Бренстеда и σ-кислотами. 5.6. Реакции электрофильного замещения катализируемые кислотами Льюиса. 5.7. Правила ориентации в электрофильном ароматическом замещении. 5.8. Химические свойства боковых цепей.
АРОМАТИЧНОСТЬ.
В 1825г. Майкл Фарадей из светильного газа выделил новое вещество со своеобразным сильным запахом. Он назвал это вещество бензолом. В 1834 году Эрих Митчерлих получил
бензол декарбоксилированием бензойной кислоты и установил его эмпирическую формулу (СН)n или СnНn. Измерением плотности паров бензола была установлена молекулярная формула бензола С6Н6. Судя по молекулярной формуле бензол должен быть ненасыщенным соединением. Однако его химические свойства не соответствовали свойствам ненасыщенного соединения. Были только некоторые исключения из общего правила. Так бензол не реагировал с галоидводородами, но зато вступал в реакции с азотной кислотой с образованием продуктов замещения. Бензол при нагревании до температуры 7000С оставался устойчивым и не подвергался окислению или пиролизу. На бензол и его гомологи не действовал на холоду разбавленный раствор перманганата калия. На сам бензол также не действовал концентрированный раствор перманганата калия при нагревании, а у его гомологов окислялся алкильный радикал с образованием бензойной кислоты. Общая тенденция в химических свойствах бензола заключалась в том, что бензол инертен в реакциях присоединения и активен в реакциях замещения, причем в таких реакциях, где в роли атакующего реагента выступает электрофильная частица. Ненасыщенные соединения инертные в реакциях и активные в реакциях замещения были названы «ароматическими». Название сложилось исторически. За специфический запах, а также то, что призводные выделены из душистых природных веществ. В 1865г. Фридрих Кекуле предположил, что молекула бензола имеет циклическое строение. Внутри цикла атомы углерода связаны чередующимися двойными и простыми связями:
Однако для подобных структур должна была наблюдаться разница в свойствах дизамещенных производных бензола:
Однако подобное различие не наблюдалось. В 1930г американский ученый Майкл Дьюар предложил рассматривать бензол как совокупность резонансных структур:
Возможность представления молекулы в виде резонансных структур указывает на высокую степень делокализации электронной плотности в молекуле бензола. Мы знаем, что чем выше степень делокализации электронной плотности тем выше устойчивость молекулы. Тезис о повышенной устойчивости молекулы бензола подтверждают расчеты для теплоты гидрирования. Так теплота гидрирования циклогексена:
Если бы бензол содержал три изолированные связи, то его теплота гидрирования составила бы: 120.5 × 3 = 361.5 кДж/моль
Однако экспериментальное значение теплоты гидрирования бензола значительно ниже:
Разность теплоты гидрироваания гипотетического 1,3,5-гексатриена с изолированными двойными связями и реальным бензолом равная: 361.5 – 208.4 = 153.1 кДж/моль называется энергией стабилизации. Энергия стабилизации обусловлена высокой степенью сопряжения или делокализации π-электронов в пределах циклической структуры. Определение: Углеводороды циклического строения, обладающие системой чередующихся двойных и простых связей и обладающих повышенной стабильностью – называются ароматическими углеводородами. Свойство повышенной стабильности углеводородов циклического строения, обладающих системой чередующихся двойных и простых связей называется ароматичностью. Ароматические углеводороды еще называют аренами. Ароматические соединения обладают особым свойством – они подчиняются так называемому правилу Хюккеля или правилу ароматичности: ароматическими являются органические соединения плоского строения, содержащие сопряженную систему, которая включает 4n+2 π-электрона в цикле. Для n=0 цикл должен содержать 2 π-электрона. Такому условию удовлетворяет циклопропенил-катион:
Для n=1 цикл должен содержать 6 π-электронов. Такому условию удовлетворяют:
Для n=2 цикл должен содержать 10 π-электронов. Такому условию удовлетворяет:
Для n=3 цикл должен содержать 14 π-электронов. Такому условию удовлетворяют:
ИЗОМЕРИЯ И НОМЕНКЛАТУРА
Ароматические соединения образуют гомологический ряд обще формулы СnH2n-6. Основоположником гомологического ряда является бензол. Бензол – тривиальное название. Кроме бензола очень часто употребляются тривиальные названия:
Употребляются рациональные названия:
По ситематической номенклатуре: 1. Расставляют локанты в цикле следующим образом:
2. Номер «1» присваивается той функциональной группе, у которой атом, непосредственно связанный с бензольным кольцом, имеет наменьшую массу. Например:
Теория химического строения допускает существование только одного монозамещенного бензола. Дизамещенных может быть три. Причем в дизамещенном бензоле положения носят определенные названия: 1,2- орто -; 1,3- мета- и 1,4- пара -. Возможна изомерия боковой цепи. Например, н -пропилбензол и изопропилбензол СПОСОБЫ ПОЛУЧЕНИЯ. Промышленные способы получения 1. Основным природным источником ароматических углеводородов является нефть и каменный уголь. При коксовании угля в качестве побочного продукта образуется так называемая каменноугольная смола, которая представляет собой раствор всевозможных ароматических углеводородов в бензоле. Кроме того, существуют месторождения нефти (Майкоп), которая представляет собой также раствор всевозможных ароматических углеводородов в бензоле. 2. Ароматизация парафинов открытая Н.Д. Зелинским, Б.А. Казанским и А.Ф. Плате. Смесь алканов, обычно гексан-гептановая фракция, при 3000С пропускается над платиновым катализатором:
3. Дегидрогенизация циклогексана и его гомологов:
При пропускании парообразного циклогексана или его гомологов над платиной или палладием при 3000С устанавливается равновесие между циклоалканом и ароматическим соединением, которое можно сместить в ту или иную сторону в зависимости от потребности.
|
||||
|
Последнее изменение этой страницы: 2016-04-08; просмотров: 380; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.57.41 (0.007 с.) |