Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Реакции общего пути катаболизмаСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
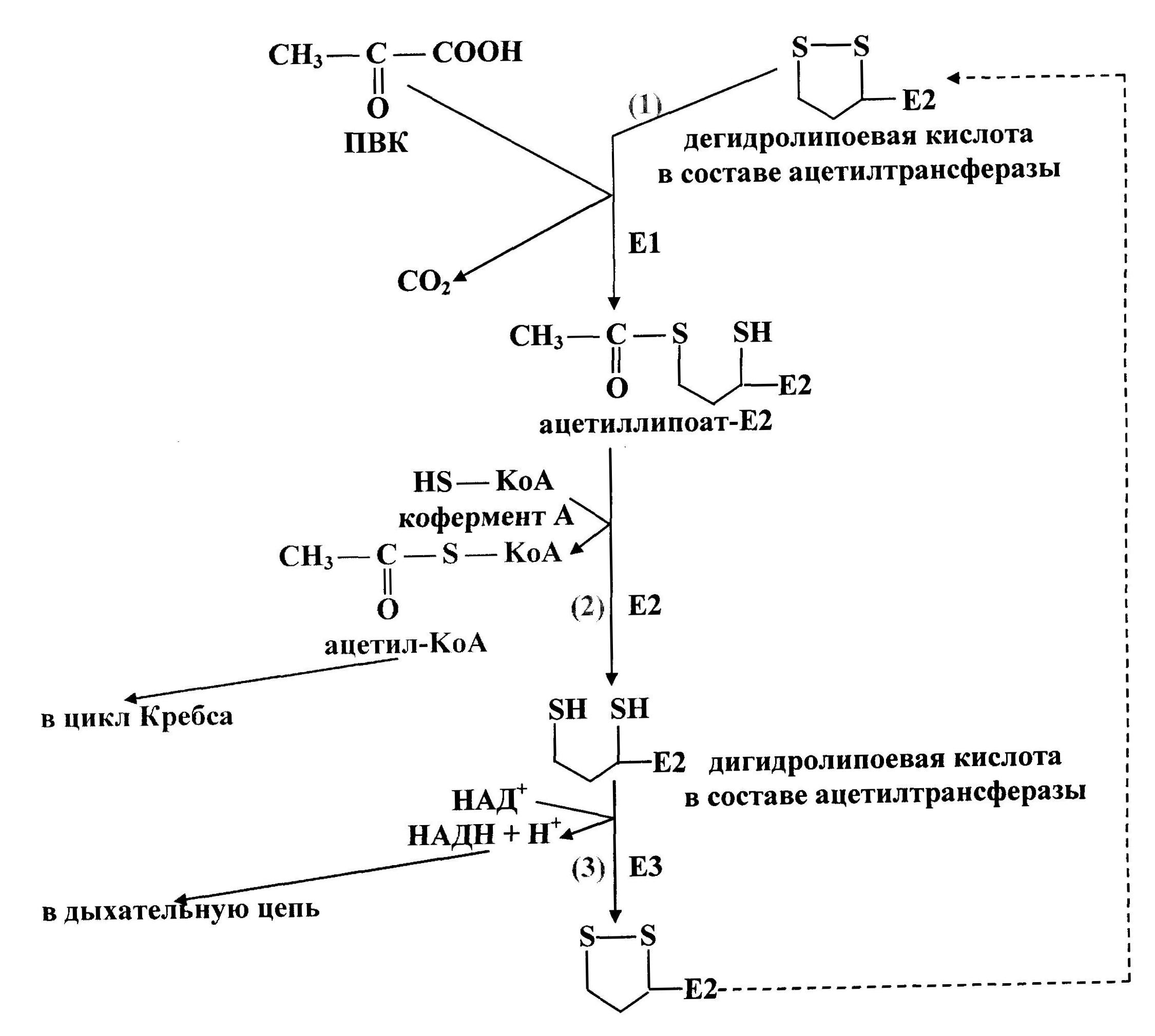
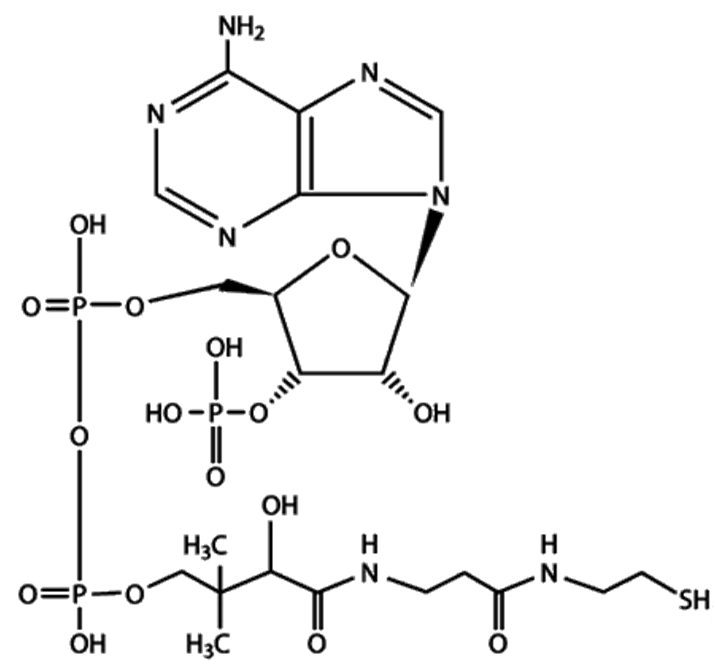
ОКИСЛИТЕЛЬНОЕ ДЕКАРБОКСИЛИРОВАНИЕ ПВК Окислительное декарбоксилирование пировиноградной кислоты - многостадийный процесс, который катализирует пируватдегидрогеназный комплекс - митохондриальный мультиферментный комплекс, соединенный с внутренней мембраной со стороны матрикса. ПВК поступает к комплексу из матрикса, и туда же освобождаются продукты реакции. Пируватдегидрогеназный комплекс включает три фермента (пируватдегидрогеназа (Е1), ацетилтрансфераза (Е2), дегидрогеназа дигидролипоевой кислоты (Е3)) и пять коферментов (НАД+, ФАД, тиаминпирофосфат, липоевая кислота, кофермент А (рис. 36)). Тиаминпирофосфат связан с пируватдегидрогеназой (Е1), липоевая кислота - с ацетилтрансферазой (Е2), ФАД - с дегидрогеназой дигидролипоевой кислоты (Е3). Кофермент А и НАД+ находятся в свободно растворенном состоянии. В состав пируватдегидрогеназного комплекса входит примерно по три десятка молекул Е1 и Е2 и 10 молекул Е3. Комплекс работает как конвейер: промежуточные продукты не освобождаются в раствор, а передаются от фермента к ферменту.
Первую реакцию (рис. 37) катализирует Е1, субстратами являются ПВК и дегидролипоевая кислота, являющаяся простетической группой Е2. От ПВК отщепляется карбоксильная группа и образуется СО2, а ацетильный остаток соединяется с атомом серы липоевой кислоты в составе ацетилтрансферазы. Образуется ацетиллипоат-Е2. Во второй реакции ацетилтрансфераза (Е2) катализирует перенос ацетильного остатка, соединенного с его простетической группой, на коэнзим А. Продукты этой реакции - дигидролипоевая кислота в составе Е2 и ацетил-KоА. В третьей реакции происходит дегидрирование дигидролипоевой кислоты в составе ацетилтрансферазы при воздействии фермента Е3 (дегидрогеназа дигидролипоевой кислоты), содержащего ФАД. ФАД передает водород на НАД+. Образуются НАДН+Н+ и дегидролипоевая кислота в составе Е2. Последний фермент снова вступает в окислительное декарбоксилирование ПВК. Ацетил-KоА (продукт второй реакции) затем окисляется в цикле Кребса. Водород с НАДН (продукт третьей реакции) поступает в дыхательную цепь, где образуется АТФ. Энергетический выход окислительного декарбоксилирования пирувата – 3 АТФ.
Суммарное уравнение процесса: СH3-CО-COOH + HS-KoA + НАД+ ® СH3-CО-S-KoA + НАДН + Н+ + СО2.
Рис. 37. Схема окислительного декарбоксилирования пирувата
По механизму «обратной связи» работу пируватдегидрогеназного комплекса ингибируют конечные продукты окислительного декарбоксилирования - ацетил-KоА, НАДН+Н+, а также АТФ. Увеличивают активность комплекса пировиноградная кислота и АДФ. Также имеет место гормональная регуляция: инсулин увеличивает активность пируатдегидрогеназного комплекса, глюкагон - снижает.
ЦИКЛ ТРИКАРБОНОВЫХ КИСЛОТ Цикл трикарбоновых кислот (цикл Кребса, цитратный цикл) открыт английским биохимиком Хансом Кребсом, получившим за это выдающееся достижение в 1953 г. Нобелевскую премию. Цикл Кребса - путь окисления молекул ацетил-KoA, в которые превращается в процессе катаболизма большая часть углеводов, жирных кислот и аминокислот. Цикл трикарбоновых кислот протекает в матриксе митохондрий. Его стадии: 1. Реакция конденсации ацетил-KoA с оксалоацетатом при участии цитрат-синтазы с образованием лимонной кислоты: 2. Реакция дегидратации лимонной кислоты с образованием цис-аконитовой кислоты, которая присоединяет молекулу воды и переходит в изолимонную кислоту (изоцитрат). Процесс катализирует аконитат-гидратаза: 3. Реакция дегидрирования и декарбоксилирования изолимонной кислоты в присутствии НАД-зависимой изоцитратдегидрогеназы. Это лимитирующая стадия цикла Кребса, в результате которой образуется 4. Окислительное декарбоксилирование a-кетоглутаровой кислоты с образованием макроэргического соединения сукцинил-KoA при участии 5. Сукцинил-KoA при участии ГДФ и неорганического фосфата превращается в сукцинат (янтарная кислота). Одновременно образуется ГТФ за счет макроэргической тиоэфирной связи сукцинил-KoA. Реакцию катализирует сукцинил-KoA-синтетаза. Ингибиторами являются НАДН, АТФ и сукцинил-КоА. ГТФ + АДФ ® АТФ + ГДФ.
6. Реакция дегидрирования сукцината с образованием фумаровой кислоты при участии сукцинатдегидрогеназы, коферментом которой является ФАД. Сукцинатдегидрогеназа связана с внутренней мембраной митохондрий: 7. Реакция гидратации фумаровой кислоты в яблочную (L-малат) при участии фумаразы: 8. Под влиянием митохондриальной НАД-зависимой малатдегидрогеназы L-малат окисляется в оксалоацетат и, тем самым, цикл Кребса замыкается: В цикле Кребса образуется: 3 молекулы НАДН (реакции 3 - изоцитратдегидрогеназная, 4 – 1 молекула ФАДН2 (реакция 6 - сукцинатдегидрогеназная), которая дает 2 молекулы АТФ в дыхательной цепи; 1 молекула ГТФ из сукцинил-КоА (реакция 5), а из нее 1АТФ. ИТОГО: 9АТФ + 2АТФ + 1АТФ = 12АТФ. Суммарно в общем пути катаболизма образуется: 3АТФ (окислительное декарбоксилирование ПВК) + 12АТФ (цикл Кребса) = Цикл Кребса регулируется по механизму «отрицательной обратной связи» с участием аллостерических ферментов. НАДН ингибируют НАД-зависимые дегидрогеназы цикла. При уменьшении расхода АТФ активность дыхательной цепи снижается (дыхательный контроль), концентрация НАДН в клетке повышается, и ингибирование реакций 3, 4 и 8 снижает активность цикла Кребса в целом.
|
|||||||||
|
Последнее изменение этой страницы: 2016-07-14; просмотров: 708; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.6.9 (0.01 с.) |

 а
а
 б
б