
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опыт 2. Твердофазная реакция нитрата свинца и иодида калияСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте В сухой ступке осторожно смешайте несколько кристаллов нитрата свинца Pb(NO3)2 и йодида калия KI. Отметьте, происходит ли изменение окраски. Затем энергично разотрите кристаллы пестиком, запишите наблюдения. Из капельницы добавьте к смеси несколько капель воды. Объясните различия в скорости появления окраски. Напишите стехиометрическое уравнение происходящей реакции. Опыт 3. Образование роданидного комплекса кобальта в твердой фазе Смешайте в сухой ступке несколько кристаллов хлорида кобальта (II) (CoCl2) и роданида аммония NH4SCN. Отметьте, происходит ли изменение цвета. Затем разотрите кристаллы пестиком, запишите наблюдения. В результате реакции образуется комплексное соединение (NH4)2 [Co(SCN)4]. Напишите стехиометрическое уравнение реакции. К полученной смеси прибавьте по каплям дистиллированной воды до получения розовой окраски. Изменение окраски связано с превращением роданидного комплекса кобальта в аквакомплекс: [Co(SCN)4]2- + 6H2O = [Co(H2O)6]2+ + 4 SCN - Контрольные вопросы и задачи для защиты лабораторной работы 1. Рассчитайте начальную скорость гетерогенной реакции 2-го порядка: A(к) + B(г) ® C(г) + D(г) , если известно, что [B]0 = 0,25 моль/л, а константа скорости равна k = 0,15 л/(мольЧс). 2. Рассчитайте начальную скорость гетерогенной реакции 2-го порядка Mg (к) + 2 HCl (р-р) = MgCl2 (р-р) + H2 (г), если известно, что начальная концентрация [HCl] = 0,5 моль/л, а константа скорости k = 0,012 л/(моль с). 3. Напишите кинетическое уравнение для гетерогенной реакции М (к) + В (г) ® Р (г), если известно, что при увеличении концентрации вещества В в 3 раза скорость реакции возрастает 9 раз. 4. Напишите кинетическое уравнение гетерогенной реакции M(к) + N(г) + T(г) ® P(г) + R(г), если известно, что при увеличении начальной концентрации вещества N в 3 раза начальная скорость реакции увеличивается в 3 раза, а при увеличении начальной концентрации вещества T в 2 раза начальная скорость реакции увеличивается в 4 раза (при постоянных начальных концентрациях других исходных веществ). 5. Во сколько раз увеличится скорость реакции C(гр) + O2(г) = CO2(г), если парциальное давление кислорода увеличится в 3 раза. 6. Во сколько раз увеличится начальная скорость гетерогенной реакции A(к) + B(г) ® C(г) + D(г) при одновременном увеличении начальной концентрации вещества B в 3 раза и температуры от 293 К до 323 К, если известно, что общий порядок реакции n = 1,5, а энергия активации реакции EА = 190 кДж / моль? 7. Между веществами А и В протекает гетерогенная реакция 2-го порядка по схеме: А (к) + В (г) ® Р (г) Исходная смесь содержит по 0,5 моль веществ А и Б в сосуде объемом 2 л. Как изменится скорость реакции к моменту времени, когда в сосуде останется 0,2 моля вещества В? 8. Напишите кинетическое уравнение для гетерогенной реакции М (к) + К (г) ® Р (г), если известно, что при увеличении концентрации вещества К в 2,4 раза скорость реакции возрастает в 1, 55 раза. Как изменится скорость реакции при увеличении общего давления в системе в 4 раза? 9. Рассчитайте скорость гетерогенной реакции В (к) + N (г) ® C (г) + D (г), если известно, что общий порядок реакции равен n = 1,5, константа скорости k = 0,6, концентрация С N = 0,4 моль / л. Укажите размерность константы скорости, если время измеряется в секундах. 10. Как изменится скорость гетерогенной реакции 2 - го порядка A (к) + B (р-р) ® C (р-р) + D (р-р), если начальную концентрацию вещества В увеличить в 4 раза? Укажите размерность константы скорости, если время измеряется в секундах. 11. Напишите кинетическое уравнение для гетерогенной реакции М (к) + К (г) ® Р (г), если известно, что при увеличении концентрации вещества К в 2 раза скорость реакции возрастает в 1, 4 раза. 12. Рассчитайте скорость гетерогенной реакции В (к) + N (г) ® C (г) + D (г), если известно, что порядок реакции равен n = 0,5, константа скорости k = 0,2, концентрация С N = 0, 3 моль / л. Укажите размерность константы скорости, если время измеряется в минутах. 13. Запишите кинетическое уравнение для реакции 2 А (к) + В2 (г) = 2 АВ (к) , если известно, что общий порядок реакции равен 1,5. Во сколько раз увеличится скорость реакции при увеличении общего давления в 5 раз? 14. Рассчитайте скорость для гетерогенной реакции 2 - го порядка А (к) + 2 В (р-р) = АВ2 (р-р) при концентрации С В = 0,4 моль / л, если известно, что константа скорости k = 0,2. Укажите размерность константы скорости, если время измеряется в секундах. Во сколько раз изменится скорость реакции, когда концентрация В уменьшится на 30 %? 15. В каком режиме протекает гетерогенная реакция, если известно, что скорость процесса сильно зависит от температуры и слабо зависит от интенсивности перемешивания в системе? Лабораторная работа № 6 Каталитические реакции Цель работы: Ознакомление с явлением катализа и изучение основных особенностей каталитических реакций. Теоретическая часть Катализом называют явление изменения скорости термодинамически возможной химической реакции под влиянием катализаторов – веществ, участвующих в реакции, но остающихся в неизменном количестве и составе после ее завершения. Все каталитические процессы подразделяют на две группы: гомогенные и гетерогенные. К гомогенным относятся процессы, в которых реагирующие вещества и катализатор находятся в одной фазе и образуют гомогенную систему. Например, некоторые газофазные каталитические реакции и многие каталитические реакции в растворах. Примером гомогенной каталитической реакции, в которой все участники находятся в одном агрегатном состоянии – газообразном, является окисление оксида серы (IV) кислородом в присутствии оксида азота (IV):
В гетерогенных процессах катализатор представляет самостоятельную фазу, граничащую с фазой реагентов. В этом случае каталитическая реакция протекает на поверхности раздела фаз: газ – твердое тело, жидкость - твердое тело, жидкость – газ. Наибольшее практическое значение имеют каталитические реакции, в которых катализатор находится в твердой фазе, а реагенты – в жидкой или газообразной. Примером гетерогенного каталитического процесса является та же реакция окисления оксида серы (IV) кислородом, но в присутствии твердого оксида ванадия (V):
Можно выделить следующие общие закономерности каталитических реакций. Катализатор не влияет на положение термодинамического равновесия. Он в одинаковой степени изменяет константы скорости прямой и обратной реакций и только ускоряет наступление равновесия. Катализатор не входит ни в состав исходных веществ, ни в продукты реакции, поэтому он не оказывает влияние на изменение энергии Гиббса реакции D r G, являющейся функцией состояния. Следовательно, катализатор не может вызвать протекание реакций, для которых в данных условиях D r G > 0, а может увеличить скорость реакции лишь в том случае, если D r G < 0. Действие катализатора заключается в том, что он образует с реагирующими веществами промежуточный комплекс, который затем разрушается с образованием продуктов реакции, а сам катализатор освобождается и переходит в исходное состояние. Основной причиной увеличения скорости в результате катализа является значительное уменьшение энергии активации реакции Е А. Скорость каталитической реакции, как правило, пропорциональна концентрации катализатора (гомогенный катализ) или площади поверхности катализатора (гетерогенный катализ).Например, пероксид водорода в водном растворе медленно разлагается на воду и кислород по уравнению: Н2О2 = Н2О + 1 / 2 О2 . Энергия активации этой реакции составляет 75,6 кДж / моль. В присутствии ионов трехвалентного железа Fe 3 + энергия активации уменьшается до 54,6 кДж / моль. Наименьшее значение энергии активации соответствует каталитическому разложению в присутствии биологического катализатора - фермента каталазы – 20 кДж / моль. В его присутствии скорость реакции увеличивается приблизительно в 10 8 раз по сравнению с некаталитической реакцией. Уменьшение энергии активации является не единственной причиной увеличения скорости реакции в присутствии катализатора. В некоторых случаях ускорение процесса обусловлено увеличением предэкспоненциального множителя k 0 в уравнении Аррениуса:
Катализаторы по своему действию селективны, то есть избирательны. Катализатор увеличивает скорость преимущественно одной из возможных реакций, не влияя заметно на скорость других реакций. Контрольные вопросы и задачи для предварительной подготовки Лабораторной работы 1. Что такое катализ? Какие две основные его разновидности известны? 2. Способен ли катализатор вызвать реакцию или он ее только ускоряет? 3. Через какой кинетический параметр влияет катализатор на скорость реакции? 4. Подсчитайте, используя уравнение Аррениуса, во сколько раз увеличивается скорость разложения пероксида водорода при снижении энергии активации реакции с 75,6 кДж/моль – в отсутствие катализатора, до 54,6 кДж/моль в присутствии ионов железа (III). 5. Укажите отличительные особенности гомогенного и гетерогенного катализа. 6. Может ли катализатор влиять на состояние химического равновесия в соответствии с принципом Ле Шателье? Практическая часть
|
||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 1185; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.141 (0.009 с.) |



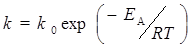 .
.


