
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Московский государственный техническийСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Московский государственный технический университет им. Н.Э. Баумана ЛАБОРАТОРНЫЙ ПРАКТИКУМ ПО КУРСУ ХИМИИ ДЛЯ ТЕХНИЧЕСКИХ УНИВЕРСИТЕТОВ ЧАСТЬ I Издательство МГТУ им. Н.Э. Баумана Г. Московский государственный технический университет им. Н.Э. Баумана ЛАБОРАТОРНЫЙ ПРАКТИКУМ ПО КУРСУ ХИМИИ ДЛЯ ТЕХНИЧЕСКИХ УНИВЕРСИТЕТОВ Методические указания к лабораторным работам по курсу общей химии для технических университетов Под редакцией Проф. Г.Н. Фадеева Москва Издательство МГТУ им. Н.Э. Баумана СОДЕРЖАНИЕ Методические указания к лабораторным работам по курсу общей химии для технических университетов ЧАСТЬ I Методика проведения лабораторного практикума по химии Блок-модуль № 1 Лабораторная работа №1. Определение молярной массы эквивалента металла объёмным методом. Лабораторная работа №2. Определение точной концентрации растворов титриметрическим методом. Лабораторная работа №3. Окислительно-восстановительные реакции. Блок-модуль № 2 Лабораторная работа №4. Кинетика гомогенных реакций. Лабораторная работа №5. Кинетика гетерогенных реакций. Лабораторная работа №6. Каталитические реакции. Блок-модуль № 3 Лабораторная работа №7. Растворы электролитов. Лабораторная работа №8. Химическое равновесие.
Методические указания к лабораторным работам по курсу общей химии для технических университетов
ЧАСТЬ II Блок-модуль № 1 Лабораторная работа №1. Свойства s-металлов. Жесткость воды. Лабораторная работа №2. Свойства p-элементов.
Блок-модуль № 2 Лабораторная работа №3. Свойства d-элементов. 1-я часть Лабораторная работа №4. Свойства d-элементов. 2-я часть
Блок-модуль №3 Лабораторная работа №5. Коррозия металлов и сплавов. Лабораторная работа №6. Защита металлов от коррозии.
Блок-модуль № 4 Лабораторная работа №7. Гальванические элементы. Лабораторная работа №8. Электролиз. УДК 541 (075.8) ББК 24.1 Г67 Рецензент – к.х.н. доцент Шаповал В.Н. Г67. Лабораторный практикум по курсу химии для технических университетов -М.:Изд-воМГТУим.Н.Э. Баумана, 2003, -00 с., 00 ил.
Ответственный редактор-составитель проф. Г.Н. Фадеев Авторы: Березина С.Л., Голубев А. М., Горшкова В.М., Горячева В.Н., Двуличанская Н.Н., Елисеева Н.М., Ермолаева В.И., Машьянов М.Н., Овчаренко Л.П., Погромская Н.Н., Татьянина И.В., Фадеев Г.Н., Хмарцева Л.П. Лабораторный практикум по курсу химии для технических университетов включает экспериментальные работы, выполняемые студентами всех факультетов при изучении химии на первом курсе Московского технического университета им. Н.Э. Баумана. Проводимые исследования охватывают основные разделы курса и знакомят студентов с основными законами химии и прививают им навыки исследовательской экспериментальной работы. Следует обратить внимание на предварительную подготовку к лабораторной работе, заполнению лабораторного журнала и самостоятельной работе по самоконтролю, заключающемуся в письменном ответе на вопросы, относящиеся к пониманию и выполнению лабораторной работы. Рекомендован для студентов приборостроительных, машиностроительных и других родственных специальностей технических университетов. Авторы лабораторного практикума по курсу химии для технических университетов Часть 1 Бадаев Ф.З., Березина С.Л., Голубев А. М., Горшкова В.М., Горячева В.Н., Гуров А.А., Двуличанская Н.Н., Елисеева Н.М., Ермолаева В.И., Машьянов М.Н., Погромская Н.Н. Овчаренко Л.П., Татьянина И.В., Фадеев Г.Н., Хмарцева Л.А. Методика проведения лабораторного практикума по химии На кафедре химии МГТУ им. Н.Э.Баумана принята рейтинговая система баллов. Во-первых, такая система, позволяет студентам постоянно контролировать результаты своих усилий. Во–вторых, стимулирует ритмичную работу в течение всего семестра и всего курса обучения химии. В-третьих, делает открытым процесс получения оценки. В-четвертых, облегчает трудности обучения, помогает равномерно и добросовестно работающим студентам получить зачет сразу по окончании лабораторного практикума и даже экзаменационную оценку по окончании семестра. Выполнение лабораторных работ Студент допускается к выполнению лабораторной работы при наличии подготовленного лабораторного журнала, включающего название лабораторной работы, цель, краткие теоретические сведения, практическую часть (название опытов, таблицы и пр.) и ответы на предлагаемые вопросы.
Студент, не подготовившийся к выполнению лабораторной работы, готовится к ней во время занятия под наблюдением преподавателя и допускается к работе, если остается достаточно времени для ее выполнения. Если времени на выполнение лабораторной работы недостаточно, то студент направляется на отработку пропущенной работы в другую группу по расписанию работы преподавателя (или направляется в другую группу по договоренности с преподавателем). Сумма баллов, выделенная на подготовку работы, при этом снижается на 50%. Студент выполняет лабораторную работу, внося в практическую часть отчета необходимые сведения: уравнения реакций, наблюдения, расчеты, графики, делает необходимые выводы. В конце занятия преподаватель оценивает работу определенной суммой баллов и ставит свою подпись. Преподаватель в конце занятия выдает каждому студенту 3-4 индивидуальных задачи, решение которых студент представляет преподавателю на следующем занятии. Правильное решение задач оценивается определенной суммой баллов и засчитывается преподавателем как защита выполненной лабораторной работы. Студенты, не защитившие лабораторные работы в срок и не набравшие необходимой суммы баллов, защищают все выполненные лабораторные работы на занятии, выделенном как защита блока лабораторных работ. Студенты, уже защитившие часть лабораторных работ, защищают последнюю из выполненных работ. Защита выполненных лабораторных работ допускается не более двух раз и оценивается при этом минимальным количеством баллов. Лабораторный практикум считается выполненным, если студент отработал и защитил все лабораторные работы, набрав при этом минимально необходимую сумму баллов. Зачет Студент допускается к зачету после выполнения лабораторного практикума и сдачи домашнего задания при условии набора определенной суммы баллов. Зачет проводится в форме письменной работы, которая включает вопросы и задачи, соответствующие содержанию лабораторных работ и домашнего задания. Если студент выполнил зачетную работу не полностью, то он может получить зачет после собеседования с преподавателем или переписав зачетную работу повторно. Зачетная работа оценивается определенной суммой баллов. Студент может получить зачет при определенной сумме баллов, набранной в семестре, без выполнения письменной работы, при этом к набранному им рейтингу прибавляется 2/3 от суммы баллов, выделенных на итоговую зачетную работу. Рейтинг Рейтинг 1-ого семестра составляет 100 баллов, из них на лабораторные работы и домашнее задание отводится 60 баллов, зачетную работу – 40 баллов. Минимальная сумма допуска к зачетной работе – 36 баллов. Сумма баллов, дающая право получить зачет без написания письменной работы, составляет 55 баллов. Рейтинг 2-ого семестра также составляет 100 баллов, из них на лабораторные работы отводится 60 баллов, домашнее задание или рубежный контроль – 40 баллов. Минимальная сумма допуска к экзамену составляет 70 баллов. Студент может получить экзаменационную оценку досрочно, набрав определенную сумму баллов, которая определяется как среднее арифметическое рейтинга 1- и 2-ого семестров и составляет 95 баллов – «отлично» и 90 баллов – «хорошо».
Лабораторная работа № 1 Определение молярной массы эквивалента металла объемным методом Цель работы: Усвоение понятий эквивалент, молярная масса эквивалента, расчет эквивалентов простых и сложных веществ, знакомство с простейшим экспериментальным методом определения эквивалента элемента. Теоретическая часть Немецкие химики Венцель и Рихтер установили (1793г.), что вещества реагируют и образуются в эквивалентных количествах. Современная формулировка закона эквивалентов: массы реагирующих веществ относятся между собой как эквиваленты этих веществ Эквивалент Э - условная химическая частица в Z раз меньшая соответствующей формульной единицы ФЕ вещества, участвующего в реакции. Под формульной единицей понимается химическая формула вещества. Для реакции: 2Al(OH)3 + 3 H2SO4 = Al2(SO4)3 + 6 H2O Формульное количество 2 моль 3 моль 1 моль 6 моль Эквивалентное количество 6 моль 6 моль 6 моль 6 моль Эквивалентное число Z 3 2 6 1 Фактор эквивалентности f = 1/Z 1/3 1/2 1/6 1 По аналогии с молярной массой вещества M вводится понятие молярной массы эквивалента вещества M экв: Mэ кв = Эквивалент может быть также определен как количество вещества, равноценное в химической реакции 1 молю атомов водорода или 1 молю электронов. 1 моль атомов водорода имеет молярную массу М ≈ 1 (точнее 1,008) г/моль; 1 моль электронов эквивалентен количеству электричества F, известному как число Фарадея: q = 1,6·1019Кл·6,02·1023моль = 96484 Кл/моль = F. Эквивалентное число Z численно равно валентности элемента для простого вещества или сумме степеней окисления катиона или аниона (по модулю) для сложного вещества. Примеры расчета эквивалентов веществ. 1. Рассчитать эквивалент железа в реакциях: а) Fe + H2SO4 (разб.) = FeSO4 + H2; б) 2Fe +6H2SO4 (конц.) = Fe2(SO4)3 +3 SO2 + 6H2O. Для реакции (а) Fe – 2e = Fe+2 и эквивалентное число Z =2. Эквивалент железа равен Э = ½ ФЕ, молярная масса эквивалента железа равна М экв = ½ М = 55,85: 2 = 27,925 г/моль. Для реакции (б) Fe – 3e = Fe+3 и эквивалентное число Z =3. Эквивалент железа равен Э = ⅓ ФЕ, молярная масса эквивалента железа равна М экв = ⅓ М = 55,85: 3 = 18,617 г/моль. 2. Вычисление эквивалентного числа для кислот, оснований и солей в реакциях обмена. Для кислоты эквивалентное число определяется количеством ионов водорода, замещающихся ионами металла, т.е. основностью кислоты: а) H3PO4 + NaOH = NaH2PO4 + H2O, Z (H3PO4) =1 б) H3PO4 + 2 NaOH = Na2HPO4 + 2H2O, Z (H3PO4) =2 в) H3PO4 + 3 NaOH = Na3PO4 + 3H2O, Z (H3PO4) =3
Для основания эквивалентное число определяется количеством ионов гидроксида, замещающихся анионами кислоты, т.е. кислотностью основания: а) Al(OH)3 + HCl = Al(OH)2Cl + H2O, Z [Al(OH)3] = 1 б) Al(OH)3 + 2HCl = Al(OH)Cl2 + 2H2O, Z [Al(OH)3] = 2 в) Al(OH)3 + 3HCl = Al(OH)3 + 3H2O, Z [Al(OH)3] = 3 Для соли эквивалентное число определяется произведением валентности (степени окисления) катиона (или аниона по модулю) n на количество катионов (или анионов) m: Z = n·m а) NaCl, Z =1·1=1; б) Na2SO4, Z = 1·2=2; в) Al2(SO4)3, Z =3·2=6; г) Na[HSO4], Z =1·1=1; д) [Al(OH)]Cl2, Z =2·1=2; e) [Cu(NH3)4](OH)2, Z =2·1=2. 3. Вычисление эквивалентного числа окислителя и восстановителя в окислительно-восстановительной реакции. Эквивалентное число окислителя и восстановителя в окислительно-восстановительной реакции определяется количеством принятых или отданных электронов. 3 H2S + K2Cr2O7 + 4 H2SO4 = Cr2(SO4)3 + 3 S + K2SO4 + 7 H2O восстановитель: H2S – 2e = S + 2H+, Z = 2, М экв = окислитель: Cr2O72- + 14 H+ + 6e = 2 Cr3+ + 7 H2O, Z = 6, М экв = Экспериментально эквивалент элемента может быть определен химическим путем - определением количества присоединяемого или замещаемого элементом водорода, кислорода или другого элемента, эквивалент которого известен, или электрохимическим путем на основании закона Фарадея, согласно которому при прохождении 96494 Кл электричества через раствор электролита на электродах превращается один эквивалент вещества. В данной работе использован наиболее простой и доступный способ определения эквивалента активного металла, основанный на измерении объема водорода при реакции вытеснения его из раствора соляной кислоты: Me + n HCl = MeCln + Согласно закону эквивалентов, один эквивалент металла вытесняет один эквивалент водорода, имеющий молярную массу эквивалента 1 г/моль. Используя закон Авогадро, можно определить объем, который занимает один эквивалент водорода при определенных физических условиях. При нормальных физических условиях (р = 1,013·105 Па или р =760 мм рт. ст., Т = 298 К) 1 моль водорода, имеющий массу 2 г/моль, занимает объем V = 22,4 л, тогда 1 моль эквивалента водорода, имеющий массу 1 г/моль, должен занимать объем V экв = 11,2 л. Таким способом можно рассчитать эквивалентный объем любого газа при нормальных условиях. Вопросы для предварительной подготовки лабораторной работы 1. Что называют эквивалентом вещества? Как определяется эквивалентное число и фактор эквивалентности? 2. Определите эквивалентное число и фактор эквивалентности для веществ: а) Fe2O3,б) HClO4, в) NaHS, г) MgOHCl, д) Ca(OH)2. 3. Как связаны молярная масса вещества и молярная масса эквивалента? Рассчитайте молярную массу эквивалента веществ, приведенных в вопросе 1. 4. Как рассчитывается молярная масса эквивалента окислителя и восстановителя в окислительно-восстановительной реакции? 5. Рассчитайте молярную массу эквивалента перманганата калия KMnO4, рассматривая данное соединение как: а) соль; б) окислитель, превращающийся в MnO(OH)2; в) окислитель, превращающийся в MnSO4. 6. Какой объем занимает при нормальных условиях 1 моль эквивалента газообразного вещества: а) кислорода, б) хлора; в) углекислого газа? 7. Используя закон эквивалентов, рассчитайте объем оксида
углерода (II), который потребуется для восстановления железа из 1 кг оксида железа (III) при нормальных условиях. Практическая часть 1. Описание прибора. Определение молярной массы эквивалента металла выполняется на приборе, изображенном на рисунке. Прибор состоит из штатива (1), на котором закреплены бюретки (2) и (3), соединенные шлангом. Бюретки имеет поперечное сечение, равное 1 см2, и градуированы с точностью 0,1 см, причем нулевая отметка находится в верхней части бюретки. К бюретке (3) при помощи стеклянных трубок, соединенных резиновым шлангом (4), присоединена пробирка (5) с отводной трубкой (6). Бюретки заполнены водой, пробирка (5) – концентрированной соляной кислотой. В отводную трубку помещают образец металла с известной массой и, переводя пробирку из положения (6) в положение (7), сбрасывают металл в кислоту. При взаимодействии металла с кислотой в пробирке (5) выделяется водород, который, поступая в бюретку (3), вытесняет воду из нее в бюретку (2). Измерения проводят при одинаковом положении уровней воды в обеих бюретках, что определяет одинаковое давление.
2. Проведение опыта. Перед началом опыта бюретки должны находиться в таком положении относительно друг друга, чтобы уровень воды в них был примерно на середине шкалы отсчета. Отводную трубку (6) и закрывающую ее пробку перед началом опыта насухо вытирают фильтровальной бумагой, после чего в нее помещают полученный образец металла с известной массой m. Трубку плотно закрывают пробкой, осторожно ввинчивая ее. Прибор проверяют на герметичность. Для этого медленно поднимают или опускают бюретку (2), наблюдая за колебаниями уровня воды в бюретке (3). Если прибор не герметичен, то уровни в обеих бюретках будут выравниваться. В этом случае нужно проверить положение всех пробок и снова проверить прибор. После проверки прибора на герметичность, уравнивают положение воды в обеих бюретках и отмечают положение уровня в бюретке (3) по нижнему мениску, записывая его значение по градуировочной шкале h 1 с точностью 0,1 см. После чего осторожно сбрасывают металл в кислоту, переводя пробирку (5) из положения (6) в положение (7). По мере понижения уровня воды в бюретке (3) опускают бюретку (2), следя за тем, чтобы уровни в обеих бюретках были приблизительно на одной высоте, что определяет равенство давлений в них. По окончании процесса растворения металла в кислоте точно выравнивают положение уровней в обеих бюретках и записывают положение уровня в бюретке (3) по шкале h 2 с той же точностью. Объем выделившегося водорода V в реакции: Me + n HCl = MeCln + равен разности уровней V = h2 – h1, имеет размерность см3 и относится к атмосферным условиям (p, T) проведения опыта. Эквивалент металла Э мет, имеющий молярную массу М экв, вытесняет эквивалент водорода Э
Измеренный объем водорода при атмосферных условиях (p, T) пересчитывается на нормальные условия по уравнению Клапейрона (2):
в котором p 0, V 0, T 0 относятся к нормальным условиям, а p, V, T - к условиям проведения опыта. Давление p газов в бюретке (3) в соответствии с законом Дальтона будет равно сумме парциальных давлений воздуха p возд, водорода p Н и насыщенного водяного пара p пар: p = p возд + p Н + p пар (3). При одинаковом положении уровней воды в обеих бюретках давление p атм = p возд + p Н в бюретке (3) будет меньше атмосферного на величину давления насыщенного водяного пара, которое зависит только от температуры (таблица 1). p = p атм - p пар (4) Подставляем в уравнение (1), выражение из уравнения (2) V 0.Получаем уравнение для расчета молярной массы эквивалента металла М экв: Мэкв = Таблица 1 Лабораторная работа № 2 Теоретическая часть Растворы - это гомогенные (состоящие из одной фазы) системы, содержащие несколько компонентов. Растворы бывают газообразные, жидкие и твердые. Среди соединений (компонентов), образовавших раствор, выделяют растворенные вещества и растворитель. Растворителем принято считать компонент, агрегатное состояние которого соответствует агрегатному состоянию раствора. Как правило, это компонент, содержание которого в растворе выше содержания остальных, называемых растворенными веществами. Наибольшее практическое значение имеют жидкие растворы, в частности – водные растворы, в которых растворителем является вода. Растворимостью называется способность вещества растворяться в том или ином растворителе. Мерой растворимости вещества является его содержание в насыщенном растворе. Состав раствора и содержание растворенного вещества (концентрация) выражаются различными способами. 1. Массовая доля компонента w i - это отношение массы i- го компонента mi к массе раствора S mi: w i = mi / S mi, (1) w i - безразмерная величина, принимающая значения от 0 до 1 или от 0 до 100% (в последнем случае говорят о процентной концентрации по массе). 2. Молярная доля компонента Хi - это отношение числа молей i -го компонента ni к сумме молей å n i всех компонентов, образующих раствор, безразмерная величина: Хi = ni / å n i. (2) 3. Моляльная концентрация растворенного вещества, или моляльность, Сm - число молей растворенного вещества n, приходящихся на 1 кг растворителя, моль/кг: Сm = n / ms = где m –масса растворенного вещества (г); М – молярная масса растворенного вещества (г/моль); ms - масса растворителя (кг). 4. Молярная концентрация растворенного вещества, или молярность, С - число молей растворенного вещества n в 1 л раствора, моль/л, или, сокращенно, М: С = n / V = где V - объем раствора (л); m –масса растворенного вещества (г); М – молярная масса растворенного вещества (г/моль). 5. Молярная концентрация эквивалента растворенного вещества, или нормальная концентрация, или нормальность, Сэкв - число молей эквивалентов растворенного вещества n экв в 1 л раствора, моль экв/л, или, сокращенно, н.: С экв= n экв/ V = где М экв – молярная масса эквивалента растворенного вещества (г/моль экв); z экв – число эквивалентности растворенного вещества; V - объем раствора (л); m –масса растворенного вещества (г); М – молярная масса растворенного вещества (г/моль). 6. Массовая концентрация Смасс – масса растворенного вещества m в 1 л раствора, г/л: С масс = m / V,(6) где V - объем раствора (л). 7. Титр Т – масса растворенного вещества в 1 мл раствора, г/мл. Т = С масс/1000 Можно применять и другие способы выражения состава раствора. Для приготовления раствора заданной концентрации взвешивают необходимые массы (отмеряют необходимые объемы) чистых компонентов раствора. В химических аналитических лабораториях используют концентрированные растворы известной концентрации: фиксаналы – растворы, помещенные в герметичные ампулы заводского производства, содержащие строго определенное (обычно 0,1 моль) количество химического соединения. При расчете масс (объемов) компонентов учитывают (см. Табл.1) соотношения между различными способами выражения состава раствора. Таблица 1. Соотношения между различными способами выражения состава бинарного раствора (r - плотность раствора данного состава, г/л)
Установление состава раствора является одной из задач аналитической химии. Количественный анализ проводят физическими, химическими и физико-химическими методами. Одним из наиболее простых среди них является титриметрия. Титриметрия – аналитический метод, основанный на измерении объема раствора реагента точно известной концентрации, взаимодействующего с определяемым веществом. Растворы реагентов известной концентрации, используемые в титриметрии, называют титрованными (стандартными) растворами, или титрантами. Принцип титрования: к раствору анализируемого вещества неизвестной концентрации (пробе) добавляют небольшими порциями раствор титранта до тех пор, пока не будет получен сигнал индикатора, свидетельствующий о прекращении реакции (достижении конечной точки титрования). Момент окончания титрования можно установить при помощи химической реакции или по изменению некоторого физического свойства. Часто используются органические красители, окраска которых изменяется по достижении конечной точки титрования (см. табл.2). Таблица 2. Практическая часть Молярную концентрацию эквивалента исходного раствора кислоты (обычно 0,1 н.), а также концентрацию и объем (50 или 100 мл) конечного раствора указывает преподаватель. Определение концентрации осуществляется методом титрования стандартным (титрованным) раствором щелочи (NaOH или КОН). Титриметрической реакцией является реакция нейтрализации раствора кислоты раствором щелочи. Конечную точку титрования устанавливают по изменению окраски кислотно-основного индикатора (фенолфталеина или метилового оранжевого). 1. Порядок проведения работы 1. Рассчитайте объем (мл) исходного 0,1н. раствора серной кислоты, необходимый для приготовления 100 (или 50) мл раствора H2SO4 заданной преподавателем концентрации: 0,003н.; 0,004н.; 0,005н. и т.п. (см. пример 1). 2. Отмерьте необходимый объем исходного раствора кислоты с помощью мерной бюретки. Для этого определите начальный уровень исходного раствора кислоты в бюретке с точностью до 0,1 мл. (При определении уровня глаз наблюдателя и нижний край мениска жидкости должны находиться на одной горизонтальной плоскости.) Конечный уровень раствора в бюретке равен сумме начального значения и рассчитанного в п.1 объема кислоты. 3. Перенесите рассчитанный объем кислоты в колбу, имеющую метку объема 100 (или 50) мл. Для этого осторожно поверните кран бюретки или надавите на стеклянный шарик в резиновой трубочке. 4. Приливая дистиллированную воду, доведите объем раствора в колбе до 100 (или 50) мл. 5. Добавьте 2-3 капли индикатора фенолфталеина. Отметьте окраску раствора. 6. Определите уровень титранта (0,1н. раствора NaOH или КОН) в бюретке с точностью до 0,1 мл. Запишите начальный уровень титранта h н. 7. Проводите титрование раствора кислоты, добавляя небольшими порциями раствор щелочи в колбу с кислотой. Раствор кислоты при этом непрерывно перемешивайте, держа горло колбы правой рукой. Кран (или зажим) бюретки открывайте левой рукой. 8. Конец титрования определите по появлению едва заметной, не исчезающей в течение 30 с, малиновой окраски фенолфталеина. (Окраску раствора удобнее наблюдать на белом фоне, поэтому подложите под колбу листок белой бумаги.) Отметьте и запишите конечный уровень титранта в бюретке h к. 9. Добавьте еще одну каплю раствора щелочи. Если окраска раствора стала более заметной, значит, конечная точка титрования определена правильно. 10. Повторите действия п.п.2-9, заменив фенолфталеин другим индикатором – метиловым оранжевым. Конец титрования определите по соответствующему изменению окраски индикатора (см. табл.2). 2.Обработка результатов 1. По разности конечного h к и начального h н уровней жидкости в бюретке рассчитайте объем титранта V щ, израсходованного на титрование в присутствии индикатора фенолфталеина. 2. Рассчитайте молярную концентрацию эквивалента приготовленного раствора кислоты С экв к по формуле: С экв к = 3. Сравните заданное значение концентрации раствора кислоты С экв,к,з и определенное методом титрования значение концентрации приготовленного раствора Сэкв,к и рассчитайте суммарную погрешность титрования и приготовления раствора по формуле: h=½ 4. Проведите расчет концентрации раствора кислоты при титровании с другим индикатором (метиловым оранжевым), повторив п.п.1- 3. 5. Напишите уравнение титриметрической реакции в молекулярной форме. Исходные данные, результаты измерений и расчетов занесите в таблицу.
Таблица
6. Объясните, чем вызваны расхождения в величинах концентрации одного и того раствора, оттитрованного в присутствии разных индикаторов. При каких значениях рН раствора происходит изменение окраски использованных индикаторов? Какова относительная систематическая погрешность h с титрования заданного раствора в каждом случае? Примеры решения задач Пример 1. Какой объем 0,1 н. раствора серной кислоты необходимо отмерить для приготовления 100 мл 0,02 н. раствора? Решение. Т.к. количество молей эквивалентов H2SO4 в исходном и приготовленном растворах одинаково, то, в соответствии с законом эквивалентов (7), объем исходного раствора V 1 = Пример 2. Какой объем 12%-ного раствора H2SO4 потребуется для приготовления 1 л 0,1н. раствора этой кислоты. Решение. Масса серной кислоты в 1 л 0,1н. раствора составляет
Плотность исходного раствора по данным табл.3 Приложения составляет r =1080,0 г/л. Следовательно, для приготовления 1 л 0,1н. раствора H2SO4 потребуется Пример 3. Плотность водного раствора NaCl r = 1095,0 г/л. Определить массовую долю соли в растворе, рассчитать молярную долю NaCl, молярную концентрацию, молярную концентрацию эквивалента соли, моляльную концентрацию и массовую концентрацию раствора. Решение. Для определения массовой доли соли в растворе используем данные табл.3 Приложения. Заданное значение плотности раствора NaCl в табл.3 отсутствует, поэтому применим метод интерполяции. Для этого используем ближайшие меньшее и большее значения плотностей и соответствующие им массовые доли раствора данной соли. Считая, что в указанных пределах зависимость между плотностью и массовой долей раствора линейная, рассчитаем массовую долю растворенного вещества w в растворе по пропорции (индекс б означает "большее", м - "меньшее"):
По данным табл.3 r б=1100,9 г/л; wб= 0,14; r м=1085,7 г/л; wм= 0,12. Соответственно:
Решая уравнение, получим w=0,132 (или 13,2%). При расчете молярной доли соли в растворе и других концентраций удобно использовать следующие соотношения: масса раствора – 100 г, следовательно, масса растворенного вещества т = 13,2г, а масса воды (растворителя) ms = 86,8 г = 0,0868 кг. В таком растворе число молей NaCl составит n NaCl = Следовательно, молярная доля NaCl в соответствии с уравнением (2), По уравнению (3) рассчитаем моляльную концентрацию: Сm = Раствор массой 100 г занимает объем V = молярная концентрация по уравнению (4): С = молярная концентрация эквивалента по (5): С экв= массовая концентрация по (6): С масс = Для расчетов можно использовать и соотношения табл.1 Приложения: 1) С= 3) Сm= Контрольные вопросы и задачи для защиты лабораторной работы 1–20. Рассчитать массовую долю, молярную концентрацию, молярную концентрацию эквивалента, моляльную концентрацию и массовую концентрацию раствора данного вещества, используя значение плотности данного раствора и соответствующие величины табл.3.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 625; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.198.37 (0.015 с.) |

 = f ·M.
= f ·M. =17 г/моль;
=17 г/моль; = 35,99 ≈ 36 г/моль
= 35,99 ≈ 36 г/моль H2
H2 Рис. 1. Прибор для определения молярной массы эквивалента металла объемным методом.
Рис. 1. Прибор для определения молярной массы эквивалента металла объемным методом. , который при нормальных условиях занимает объем V экв= 11200см3, а используемая в опыте масса металла m вытесняет объем водорода V 0, пересчитанный на нормальные условия. В соответствии с законом эквивалентов, это можно представить в виде уравнения (1):
, который при нормальных условиях занимает объем V экв= 11200см3, а используемая в опыте масса металла m вытесняет объем водорода V 0, пересчитанный на нормальные условия. В соответствии с законом эквивалентов, это можно представить в виде уравнения (1): (1)
(1) (2),
(2), (5)
(5) , (3)
, (3) , (4)
, (4)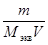 =
=  , (5)
, (5)
















 , где V к = 100 (или 50) мл,
, где V к = 100 (или 50) мл, 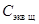 =0,1 моль экв/л.
=0,1 моль экв/л. ½100%.
½100%.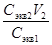 =
=  =20 мл.
=20 мл. =
=  = 49×0,1×1=4,9 г. Такая масса H2SO4 содержится в 40,83 г 12%-ного раствора в соответствии с формулой (1):
= 49×0,1×1=4,9 г. Такая масса H2SO4 содержится в 40,83 г 12%-ного раствора в соответствии с формулой (1):  =40,83 г.
=40,83 г. =
=  =0,0378 л или 37,8 мл 12%-ного раствора.
=0,0378 л или 37,8 мл 12%-ного раствора.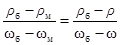 .
. .
. =0,2256 моль, а число молей воды
=0,2256 моль, а число молей воды 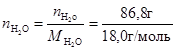 =4,8222 моль.
=4,8222 моль. =0,045.
=0,045. =2,6 моль/кг.
=2,6 моль/кг. =0,0926 л, следовательно:
=0,0926 л, следовательно: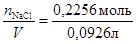 =2,48моль/л,
=2,48моль/л,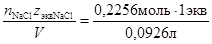 =2,48 моль экв/л,
=2,48 моль экв/л, =144,54 г/л.
=144,54 г/л.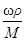 =
=  2,48 моль/л; 2) С экв= Сz экв=2,48×1= 2,48 моль экв/л;
2,48 моль/л; 2) С экв= Сz экв=2,48×1= 2,48 моль экв/л; =
=  =2,6моль/кг;4) С масс = w r =0,132×1095 =144,54 г/л.
=2,6моль/кг;4) С масс = w r =0,132×1095 =144,54 г/л.


