Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Адсорбцией называется концентрирование вещества в поверхностном слое в результате самопроизвольного перехода его из объема фазы.Содержание книги
Поиск на нашем сайте
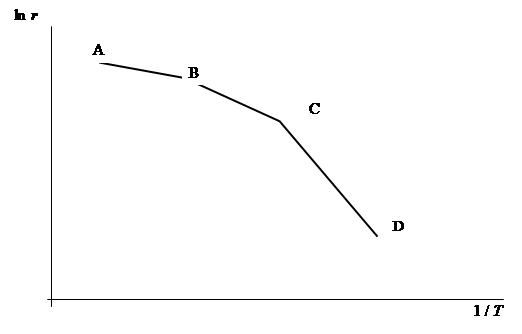
Более подробно с этим вопросом вы можете ознакомиться в рекомендуемых учебниках. В гетерогенных реакциях можно выделить, по меньшей мере, три стадии: 1 - перенос реагирующих веществ к поверхности раздела фаз, в реакционную зону; 2 - химическое взаимодействие;3 - удаление продуктов реакции из реакционной зоны. Скорость всего процесса определяется наиболее медленной стадией (она называется лимитирующей), если скорости стадий существенно различаются. Если скорость собственно химического взаимодействия значительно больше скоростей подвода реагентов к реакционной зоне и отвода продуктов, то общая скорость процесса будет определяться скоростями переноса реагентов и продуктов реакции в реакционную зону и удаления из нее. В таком случае общая скорость самопроизвольной термически инициируемой реакции будет определяться диффузией. В этом случае реакция протекает в диффузионном режиме или ее кинетика находится в диффузионной области. Когда собственно химическое взаимодействие является наиболее медленной стадией, а подвод реагентов и отвод продуктов реакции протекают сравнительно быстро, то реакция протекает в кинетическом режиме или ее режим находится в кинетической области. Если скорости реакции и диффузии приблизительно равны, то говорят о переходном режиме или диффузионно-кинетической (переходной) области гетерогенной реакции. Для гетерогенной реакции типичная форма зависимости логарифма константы скорости ln k от (1 / T) (координаты уравнения Аррениуса) приведена на рис. 1. Участок АВ, на котором k мало или практически не зависит от температуры, соответствует диффузионной области протекания процесса. В этом случае скорость процесса определяется законами диффузии и описывается диффузионными уравнениями. Участок ВС соответствует переходной области протекания процесса. В этом случае скорость процесса определяется и законами диффузии, и законами химической кинетики. Участок CD соответствует кинетической области. Для него обычно характерны значительные величины энергий активации и для его описания пользуются законами формальной кинетики.
Рис. 1. Зависимость логарифма константы скорости реакции от 1/ Т. Вопросы для предварительной подготовки лабораторной работы
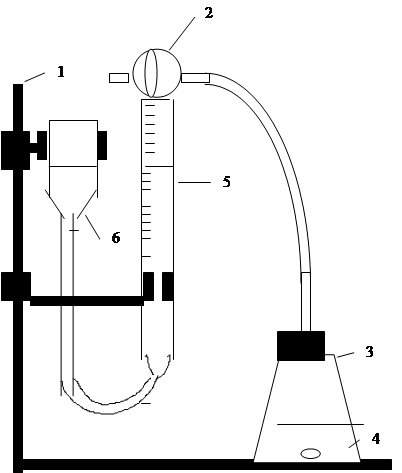
1. Приведите пример гетерогенной реакции из вашего жизненного опыта. 2. Перечислите основные стадии гетерогенной химической реакции. 3. Какой режим протекания гетерогенной химической реакции называется диффузионным, какой - кинетическим, какой - переходным? 4. Напишите кинетические уравнения гетерогенных реакций, считая их элементарными: 2 Mg(к) + O2(г) = 2 MgO(к) CO2(г) + C(гр) = 2 CO(г) 5. Запишите кинетическое уравнение для реакции: Mg + 2 HCl(р-р) = MgCl2(р-р) + H2(г) , если известно, что это реакция второго порядка. 6. Что понимается под скоростью твердофазной реакции? 7. Какая стадия реакции называется лимитирующей? 8.. В чем особенность применения постулата химической кинетики к гетерогенным реакциям? Практическая часть Опыт 1. Взаимодействие цинка с раствором кислоты Изучение взаимодействия цинка с раствором 20% -ной серной кислоты проводится на приборе, изображенном на рис. 2. Для заполнения бюретки 5 водой кран 2 поставьте в положение а и с помощью уравнительного сосуда 6 доведите уровень воды в бюретке до верхней метки. Затем зафиксируйте уровень воды поворотом крана в положение б. Возьмите четыре гранулы цинка и поместите их в реакционную колбу 4 (объем 50 мл). В эту же колбу до метки налейте раствор серной кислоты (H2SO4). Закройте колбу 4 пробкой с газоотводной трубкой, переведите кран 2 в положение в и начинайте отсчет времени. Непрерывно равномерным аккуратным потряхиванием помешивайте содержимое колбы. Через определенные промежутки времени отмечайте объем выделившегося газа (например, через каждые 1-2 мин.). Произведите не менее пяти отсчетов и результаты занесите в таблицу. Суммарный объем выделившегося газа получают как разность показаний бюретки за истекший общий интервал времени и начальный момент. Таблица 1
Аналогичный эксперимент проведите с приблизительно равной по массе навеской порошка цинка (4 лопаточки порошка). Дальше заполните таблицу, аналогичную для кусочков цинка. Постройте на одном и том же рисунке по полученным данным кинетические кривые (в координатах объем газа V - время t) для реакций кусочка вещества (кривая 1) и его порошка (кривая 2) с кислотой. Определите графически начальные скорости реакции и скорости реакции через определенные интервалы времени (в см 3 / мин) еще в двух точках для каждого случая.
а б в Рис. 2. Прибор для определения скорости гетерогенной реакции: 1 – штатив, 2 - трехходовой кран, 3 – резиновая пробка с газоотводной трубкой, 4 – реакционная колба, 5 – бюретка, 6 – уравнительный сосуд: а - положение крана при заполнении бюретки водой, б - рабочее положение крана при фиксации уровня воды, в - рабочее положение крана при выделении водорода. Сравните соответствующие скорости взаимодействия кусочка вещества и его порошка. Напишите стехиометрическое уравнение реакции и кинетическое уравнение для скорости изучавшейся вами реакции.
|
||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 462; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.184.207 (0.007 с.) |