
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Зависимость давления насыщенного водяного пара от температурыСодержание книги
Поиск на нашем сайте
Преобразуем уравнение (5), подставив известные численные данные: Мэкв = где K = Коэффициент K зависит только от условий опыта (p, T) и размерности давления. Так как этот коэффициент не зависит от массы металла, то его можно рассчитать заранее и использовать при повторных измерениях. После расчета молярной массы эквивалента металла по уравнению (6) рассчитывается молярная масса металла для трех значений валентности Z, равных 1,2 и 3 по уравнению: M =M экв ·Z (8) По таблице Д. И. Менделеева выбирается металл, проявляющий соответствующую валентность, для которого расхождение расчетной величины молярной массы с табличной не превышает 1 –2 г/моль. Затем рассчитывается относительная погрешность опыта по уравнению: Δ M = где М экв,экспер – молярная масса эквивалента металла, рассчитанная из опытных данных по уравнению (6), М экв,теор – теоретическая молярная масса эквивалента металла, рассчитанная по уравнению (8). Контрольные вопросы и задачи для защиты лабораторной работы 1-10. Рассчитать молярную массу эквивалента
11-20. Рассчитать эквивалентное число и молярную массу эквивалента окислителя и восстановителя по данным схемам химических реакций
21-30. Рассчитать молярную массу эквивалента металла по нижеприведенным данным.
31-40. Рассчитать массу полученного вещества из данных исходных веществ, используя закон эквивалентов.
Лабораторная работа № 2 Определение концентрации раствора титриметрическим методом Цель работы: Ознакомление с понятием "растворы" и способами выражения содержания растворенного вещества; определение концентрации раствора методом титрования. Теоретическая часть Растворы - это гомогенные (состоящие из одной фазы) системы, содержащие несколько компонентов. Растворы бывают газообразные, жидкие и твердые. Среди соединений (компонентов), образовавших раствор, выделяют растворенные вещества и растворитель. Растворителем принято считать компонент, агрегатное состояние которого соответствует агрегатному состоянию раствора. Как правило, это компонент, содержание которого в растворе выше содержания остальных, называемых растворенными веществами. Наибольшее практическое значение имеют жидкие растворы, в частности – водные растворы, в которых растворителем является вода. Растворимостью называется способность вещества растворяться в том или ином растворителе. Мерой растворимости вещества является его содержание в насыщенном растворе. Состав раствора и содержание растворенного вещества (концентрация) выражаются различными способами. 1. Массовая доля компонента w i - это отношение массы i- го компонента mi к массе раствора S mi: w i = mi / S mi, (1) w i - безразмерная величина, принимающая значения от 0 до 1 или от 0 до 100% (в последнем случае говорят о процентной концентрации по массе). 2. Молярная доля компонента Хi - это отношение числа молей i -го компонента ni к сумме молей å n i всех компонентов, образующих раствор, безразмерная величина: Хi = ni / å n i. (2) 3. Моляльная концентрация растворенного вещества, или моляльность, Сm - число молей растворенного вещества n, приходящихся на 1 кг растворителя, моль/кг: Сm = n / ms = где m –масса растворенного вещества (г); М – молярная масса растворенного вещества (г/моль); ms - масса растворителя (кг). 4. Молярная концентрация растворенного вещества, или молярность, С - число молей растворенного вещества n в 1 л раствора, моль/л, или, сокращенно, М: С = n / V = где V - объем раствора (л); m –масса растворенного вещества (г); М – молярная масса растворенного вещества (г/моль). 5. Молярная концентрация эквивалента растворенного вещества, или нормальная концентрация, или нормальность, Сэкв - число молей эквивалентов растворенного вещества n экв в 1 л раствора, моль экв/л, или, сокращенно, н.: С экв= n экв/ V = где М экв – молярная масса эквивалента растворенного вещества (г/моль экв); z экв – число эквивалентности растворенного вещества; V - объем раствора (л); m –масса растворенного вещества (г); М – молярная масса растворенного вещества (г/моль). 6. Массовая концентрация Смасс – масса растворенного вещества m в 1 л раствора, г/л: С масс = m / V,(6) где V - объем раствора (л). 7. Титр Т – масса растворенного вещества в 1 мл раствора, г/мл. Т = С масс/1000 Можно применять и другие способы выражения состава раствора. Для приготовления раствора заданной концентрации взвешивают необходимые массы (отмеряют необходимые объемы) чистых компонентов раствора. В химических аналитических лабораториях используют концентрированные растворы известной концентрации: фиксаналы – растворы, помещенные в герметичные ампулы заводского производства, содержащие строго определенное (обычно 0,1 моль) количество химического соединения. При расчете масс (объемов) компонентов учитывают (см. Табл.1) соотношения между различными способами выражения состава раствора. Таблица 1. Соотношения между различными способами выражения состава бинарного раствора (r - плотность раствора данного состава, г/л)
Установление состава раствора является одной из задач аналитической химии. Количественный анализ проводят физическими, химическими и физико-химическими методами. Одним из наиболее простых среди них является титриметрия. Титриметрия – аналитический метод, основанный на измерении объема раствора реагента точно известной концентрации, взаимодействующего с определяемым веществом. Растворы реагентов известной концентрации, используемые в титриметрии, называют титрованными (стандартными) растворами, или титрантами. Принцип титрования: к раствору анализируемого вещества неизвестной концентрации (пробе) добавляют небольшими порциями раствор титранта до тех пор, пока не будет получен сигнал индикатора, свидетельствующий о прекращении реакции (достижении конечной точки титрования). Момент окончания титрования можно установить при помощи химической реакции или по изменению некоторого физического свойства. Часто используются органические красители, окраска которых изменяется по достижении конечной точки титрования (см. табл.2). Таблица 2.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 352; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.33.239 (0.008 с.) |

 (6),
(6), (7)
(7) % (9),
% (9), , (3)
, (3) , (4)
, (4)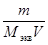 =
=  , (5)
, (5)



















