
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опыт 6. Селитра как окислительСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте В сухой пробирке, укрепленной в вертикальном штативе, расплавьте 1-2 г нитрата калия и бросьте в расплав небольшой кусочек древесного угля. Если кусочек угля сразу не загорится, то осторожно нагрейте пробирку сильнее. После того, как уголек сгорит, охладите пробирку и растворите ее содержимое в воде. Добавьте соляной кислоты. Обратите внимание на выделение газов СО2 и N2. Объясните, почему уголек подпрыгивает в пробирке при сгорании. Напишите уравнение реакции, учитывая, что азот в нитрате калия восстанавливается до свободного состояния N2, углерод до СО2, а калий образует карбонат. Укажите окислитель и восстановитель. Расставьте коэффициенты в уравнении реакции. Контрольные вопросы и задачи для защиты лабораторной работы 1. Определите, к какому типу относится каждая из реакций, выраженных следующими схемами: 1) N2O5 ® NO2 + O2 2) SO32- + MnO4- + H+ ® SO42- + Mn2+ + H2O 3) SO32- + O2 ® SO42- 4) KClO2 ® KClO3 + KCl 5) NO + NO2 ® N2O3 6) CrO3 ® Cr2O3 + O2 7) HNO3 ® NO2 + O2 + H2O 8) H2S + H2SO3 ® S + H2O 9) KClO3 ® KCl + O2 10)K2 MnO4 + H2O ® KMnO4 + MnO2 + KOH 2. Расставьте коэффициенты в уравнениях окислительно-восстановительных реакций с помощью электронного баланса, укажите окислитель и восстановитель: 1) HNO2 + KMnO4 + H2SO4 ® HNO3 + MnSO4 + K2SO4 + H2O 2) K2Cr2O7 + Na2SO3 + H2SO4 ® Cr2(SO4)3 + Na2SO4 + K2SO4 + H2O 3) KMnO4 + Н2S ® K2SO4 + MnO2 + KOH + H2O 4) P + HNO3 + H2O ® H3PO4 + NO 5) Zn + NaOH + H2O ® Na[Zn(OH)3] + H2 6) Fe(CrO2)2 + K2CO3 + O2 ® Fe2O3 + K2CrO4 + CO2 7) AsH3 + HNO3 ® H3AsO4 + NO2 + H2O 8) Cu2S + HNO3 ® Cu(NO3)2 + H2SO4 + NO+ H2O 9) H2SO4 + HJ ® J2 + H2S + H2O 10)BiCl3 + SnCl2 ® Bi + SnCl4 3. Закончите составление следующих уравнений и найдите коэффициенты с помощью ионно-электронных схем: 1) Сl2 + FeSO4 + KOH ® Fe(OH)3 + … 2) SnCl2 + KMnO4 + HCl ® H2SnCl6 + … 3) KCNS + H2O2 ® HCN + KHSO4 + … 4) CuJ + H2SO4 + KMnO4 ® CuSO4 +J2 +MnSO4 + … 5) NaBr + H2SO4 + NaBrO3 ® Br2 + Na2SO4 + … 6) KClO3 + KOH(конц) +MnSO4 ® K2MnO4 + KCl + K2SO4 +… 7) Na2SeO3 + NaOH + Cl2 ® Na2SeO4 + NaCl +… 8) HClO + H2O2 ® HCl +… 9) KClO + KJ + H2SO4 ® KCl + J2 + K2SO4 + … 10) KClO + KJ + H2O ® KCl + J2 + … 4. Заполните пропущенные места в предложенных ниже схемах, составьте ионно-электронные уравнения и напишите полные уравнения реакций в молекулярной форме: 1) CrO2- + H2O2 + OH- ® CrO42- +… 2) SO32- + MnO4- + OH- ® … 3) Br2 + SnO22- + OH- ® SnO32- +… 4) Fe2+ + ClO3- ® Cl- +… 5) NO2- + ClO3- ® Cl- + … 6) ClO- ® ClO3- + … 7) Cu + NO2- + H+ ® NO + … 5. Сколько граммов KNO2 можно окислить в присутствии серной кислоты 30 мл 0,09н. раствора KMnO4? Напишите уравнение реакции. 6. Сколько миллилитров 0,01н. раствора KMnO4 можно восстановить в присутствии серной кислоты с помощью 100 мл H2S (условия нормальные)? Напишите уравнение реакции. 7. Сколько граммов FeSO4можно окислить в присутствии H2SO4 с помощью 100мл 0,25н. раствора K2CrO4. Напишите уравнение реакции. 8. Aммиак окисляется бромной водой в щелочной среде до свободного азота. Напишите уравнение этой реакции и укажите, какое вещество выполняет функцию солеобразователя. 9. Определите, как могут вести себя в окислительно-восстановительных реакциях следующие вещества: KNO2, J2, S, K2MnO4, H2O2. Какие из них могут быть только окислителями или только восстановителями, а какие способны быть и тем и другим в зависимости от условий? 10. Какой метод нахождения окислительно-восстановительных коэффициентов удобно использовать для реакций, идущих в газовой и твердой фазах, в расплавах, в неводных и водных растворах?
Лабораторная работа № 4 Кинетика гомогенных химических реакций Цель работы: Ознакомление с основными закономерностями протекания гомогенных химических реакций и факторами, влияющими на скорость реакции. Теоретическая часть Гомогенными называются реакции, протекающие в одной фазе (в смеси газов, в жидком растворе или в твердой фазе). Важнейшей количественной кинетической характеристикой любой химической реакции является ее скорость. Наиболее общим является определение скорости реакции r как скорости возрастания степени завершенности реакции x (греческая буква "кси"), которую называют химической переменной. Пусть в закрытой системе протекает химическая реакция n1A1 + n2A2 = n3A3 + n4A4 (1) где A1, A2,...,Ai - участники реакции; n1, n2,..., ni - стехиометрические коэффициенты. Тогда химическая переменная xi, характеризующая глубину протекания реакции по i-ому компоненту, определяется как
где Ni - число молей i-го компонента в момент времени t, Ni0 - число молей того же компонента в начальный момент времени (t = 0), ni - стехиометрический коэффициент при i- ом компоненте в уравнении реакции. Стехиометрические коэффициенты у исходных веществ берутся со знаком минус, а у продуктов реакции - со знаком плюс. При таком выборе знаков глубина протекания реакции всегда положительна независимо от участника реакции. Скорость гомогенной химической реакции r определяется как скорость изменения глубины протекания реакции в единицу времени в единице объема:
где V - объем системы. Определенная таким образом скорость реакции не зависит от выбора компонента и будет практически одинаковой для разных веществ, участвующих в реакции. Дифференциальная форма уравнения (2) имеет вид
С его учетом из уравнения (3) для r, получаем
Величина
называется скоростью реакции по i- ому компоненту. Она характеризует изменение количества i - ого вещества Ni (в молях) в единицу времени в единице объема. Таким образом, скорость реакции в целом и скорости реакции по отдельным компонентам связаны следующим соотношением
Выражения (3) и (4) является строгими определениями скоростей реакций, справедливыми и для системы переменного объема.На практике часто пользуются более простым уравнением, пригодным для реакции в системе постоянного объема. Так как отношение Ni / V равно концентрации вещества C i, то при постоянном объеме
Скорость реакции (при постоянном объеме) представляет собой изменение концентрации данного вещества в единицу времени. Скорость реакции всегда положительная величина. В выражении (6) используют знак плюс, если скорость определяется по образующемуся в реакции веществу (продукту), и знак минус, если скорость определяется по расходующемуся в реакции веществу (реагенту). Этим учитываются разные знаки стехиометрических коэффициентов реагентов и продуктов реакции. Уравнение (6) наиболее часто применяют для реакций в растворах и для реакций газов в замкнутых реакционных сосудах. Если концентрация измеряется в моль/л, а время в секундах, то скорость реакции имеет размерность моль/(л×с). Кинетический эксперимент заключается в том, что при проведении реакции по мере ее протекания анализируют тем или иным экспериментальным методом концентрации исходных веществ и продуктов реакции. Результаты такого эксперимента представляют в виде кинетических кривых образования и расходования соответствующих веществ. Под кинетической кривой понимают график зависимости концентрации реагента или продукта реакции от времени.
|
||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 826; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.012 с.) |

 (2)
(2) (3)
(3)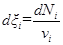 .
. .
. (4)
(4) . (5)
. (5) (6)
(6)


