
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опыт 1. Зависимость скорости реакции от температурыСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Налейте в один стаканчик 20 мл 0,5%-ного раствора серной кислоты, а в другой 20 мл 0,5%-ного раствора серноватистокислого натрия Na2S2O3. Измерьте температуру растворов (каждый раз предварительно сполоснув термометр). Поставьте стаканчик с кислотой на лист линованной бумаги, быстро прилейте к нему раствор Na2S2O3, взболтайте и отметьте момент сливания растворов по секундной стрелке часов. Отметьте отрезок времени до условного окончания процесса. Запишите число секунд. Повторите эксперимент, нагрев реагирующие растворы на 10 градусов выше температуры первого эксперимента. Для этого оба стаканчика с растворами поместите одновременно на горячую водяную баню. В одном из стаканчиков периодически измеряйте температуру (не оставляя термометр в стакане). По достижении требуемой температуры быстро смешайте растворы и отметьте по часам условную продолжительность реакции. Повторите эксперимент, повысив температуру обоих растворов на 20 градусов выше первого эксперимента. Результаты запишите в табл. 1. Таблица 1
· Коэффициент пропорциональности 100 берем для удобства расчетов и построения графика. Задания: 1. Постройте график зависимости скорости реакции r от температуры t. 2. По полученным данным рассчитайте температурный коэффициент Вант-Гоффа для данной реакции:
3. Оцените энергию активации реакции по уравнению:
Опыт 2. Зависимость скорости химической реакции от концентрации реагирующих веществ при постоянной температуре Налейте в стаканчик 10 мл 0,5% раствора серной кислоты. В другой стаканчик налейте 10 мл раствора серноватистокислого натрия и 20 мл дистиллированной воды. Затем к раствору кислоты прилейте содержимое второго стакана и отметьте по часам продолжительность опыта. Повторите опыт еще два раза, изменив концентрацию Na2S2O3 ( табл. 2). Задания: 1. Постройте график зависимости скорости реакции от концентрации серноватистокислого натрия Na2S2O3 (r - C(Na2S2O3)); 2. Определите порядок реакции по серноватистокислому натрию (метод Вант-Гоффа) Концентрации растворов Na2S2O3 приведены в табл. 2. Таблица 2
Контрольные вопросы для защиты лабораторной работы 1. Каков физико-химический смысл константы скорости реакции? Какие факторы влияют на константу скорости реакции? 2. Какую размерность имеет константа скорости для реакции: а) 1-го порядка; б) 2-го порядка; в) 3-го порядка. 3. Запишите кинетические уравнения для реакций, рассматривая их как элементарные: а) NO2 + NO2 = N2O4 б) N2O5 = N2O4 + 1/2 O2 в) 2NO + O2 = 2NO2 4. При начальных концентрациях реагентов [A] 01 =2,3×10 - 3 моль/л и [B] 01 = 1,1×10 - 3 моль/л начальная скорость элементарной газофазной реакции A+B = 2C равна W01 = 2,5×10 - 3 моль/(л×с). Какова будет начальная скорость этой реакции W02 при других начальных концентрациях [A] 02 = 1,9×10 - 3 и [B] 02 = 10 - 2 моль/л? Считать, что продукты реакции не влияют на скорость прямой реакции. 5. Вычислите, при какой температуре реакция закончится за 5 мин., если при 20°С на это требуется 24 мин. Температурный коэффициент скорости реакции равен 3. 6. Выведите формулу, связывающую температурный коэффициент скорости реакции g и энергию активации реакции EA. 7. Во сколько раз возрастет скорость реакции при повышении температуры от 30°С до 50°С, если энергия активации реакции равна 125 кДж/моль? 8. Константа скорости реакции при 600 К равна 7,5, а при 650 К - 450. Вычислите энергию активации и константу скорости при 700 К. 9. Напишите кинетическое уравнение химической реакции A + 2 B = C, рассматривая ее как элементарную. Определите, во сколько раз возрастет скорость реакции, если: а) концентрация A увеличится в 2 раза; б) концентрация B увеличится в 3 раза; в) концентрация A и B увеличится в 2 раза. 10. Напишите кинетическое уравнение химической реакции A + B + C ® D + F, если известно, что при увеличении начальной концентрации вещества A в 2 раза начальная скорость реакции увеличивается в 4 раза, а при увеличении начальной концентрации вещества B в 2 раза начальная скорость реакции увеличивается в 2,83 раза, а при увеличении начальной концентрации вещества C скорость реакции не изменяется.
Лабораторная работа № 5
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 498; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.6.144 (0.007 с.) |



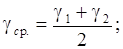
 .
.





