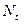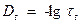Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Зависимость скорости от концентрации реагирующих веществСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
ОСНОВНЫЕ ПОНЯТИЯ ХИМИЧЕСКОЙ КИНЕТИКИ
Скорость химической реакции
Химическая кинетика (от греч. Kinetikos - относящийся к движению) - раздел физической химии, изучающий химическую реакцию, как процесс, протекающий во времени, механизм этого процесса, его зависимость от условий осуществления. Одним из важнейших понятий химической кинетики является скорость реакции. Она определяется изменением количества какого-либо из реагирующих веществ (или продуктов реакции) в единицу времени в единице объема. В частном случае, например, когда реакция происходит в растворе, объем реакционной смеси не меняется. Тогда изменение количества вещества в единице объема есть изменение концентрации. Соответственно, скорость реакции в растворе определяется изменением концентрации вещества в единицу времени. Исходные вещества вступают в реакцию (а продукты образуются) в определенных соотношениях, которые определяются стехиометрическими коэффициентами. Поэтому изменение концентрации для разных реагентов (или продуктов) за один и тот же интервал времени в одной и той же реакции может быть различным. В связи с этим различают понятия «скорость химической реакции» и «скорость изменения концентрации». Скорость изменения концентрации (r) есть производная по времени (t) концентрации (C) какого-либо из реагирующих веществ (или продуктов реакции):
Очевидно, что скорость изменения концентрации может быть различна по величине для разных веществ, участвующих в реакции. К тому же она противоположна по знаку для реагентов и продуктов реакции. Скорость химической реакции ( Запишем уравнение химической реакции. Например:
Или в общем виде:
Формально рассматривая уравнение как математическое, перенесем все слагаемые из левой части в правую. Получим:
Или в более общем виде:
В уравнении коэффициент
где Значение, определяемое по уравнению, всегда положительно и не зависит по величине от выбора
В общем случае скорость химической реакции не постоянна, а зависит от времени. Поэтому величину, определяемую по уравнениям и, часто называют истинной скоростью реакции или мгновенной скоростью реакции. Практически скорость реакции можно определить, поделив разность концентраций в моменты времени
Кинетическая кривая – это зависимость концентрации какого-либо из реагентов (или продуктов реакции) от времени. Именно эта зависимость обычно используется при экспериментальном определении скорости реакции. На рис.1 приведены примеры кинетических кривых для реагентов и продуктов. Из кинетической кривой можно определить не только среднюю скорость, но и мгновенную. Мгновенная скорость в точке
Рис. 1. Кинетические кривые: а – изменение концентрации одного из реагирующих веществ; б – изменение концентрации одного из продуктов реакции. Прямая AB – касательная к кинетической кривой (а) в точке t2.
Время полупревращения
Наряду с константой скорости для характеристики химической реакции иногда пользуются величиной времени полупревращения Получим: для реакции первого порядка для реакции второго порядка для реакции третьего порядка Можно показать, что в общем случае для реакции n-го порядка время полупревращения будет равно:
Уравнение не применяется для реакций 1-го порядка, для них используют уравнение. Как видно, для реакций различных порядков время полупревращения по-разному зависит от концентрации и лишь для реакций первого порядка оно является константой, не зависящей от концентрации.
1.5 Методы определения порядка реакции
Исходные данные для определения порядка реакции обычно берутся из экспериментально определенных кинетических кривых. При этом во всех методах может быть определен либо временной порядок (одна кинетическая кривая), либо концентрационный (несколько кинетических кривых, а концентрации и скорости берутся только для нулевого момента времени). Если в реакции участвует несколько исходных веществ, то, как правило, невозможно определить одновременно все частные порядки. Их значения определяются последовательно для каждого реагента. Для этого используется процедура, известная как «метод изолирования Оствальда». Суть ее состоит в том, что концентрации всех реагентов кроме одного берутся в большом избытке. Тогда в ходе кинетического эксперимента концентрации этих веществ могут считаться примерно постоянными и эффективный (или концентрационный) порядок по этим веществам будет равен нулю. В этом случае кинетическое уравнение упрощается. Например, из уравнения будет получено уравнение. Для определения величины 1.5.1. Метод подстановки (метод проб и ошибок). Этот метод уже был описан ранее, он заключается в подстановке экспериментальных данных в уравнения, и для расчета константы скорости. Если порядок выбран правильно, то значения константы для различных моментов времени (или различных начальных концентраций при определении концентрационного порядка) должны быть приблизительно постоянны. В графической разновидности этого метода строятся графики в координатах 1.5.2. Метод определения порядка по времени полупревращения (метод Раковского). Если прологарифмировать уравнение, то получим:
Это уравнение представляет линейную зависимость в координатах 1.5.3. Дифференциальный метод Вант-Гоффа. Если прологарифмировать уравнение
Построив график в координатах
1.6 Методы определения концентрации
Основой для определения порядков реакций, констант скорости и других кинетических параметров служит кинетическая кривая, то есть экспериментально полученная зависимость от времени концентрации какого-либо из реагентов или продуктов реакции. Методы определения концентраций реагирующих веществ в ходе реакции, применяемые в кинетике, можно разделить на две группы: химические и физико-химические. Последние основаны не на непосредственном определении количеств веществ, а на измерении меняющегося со временем физического свойства системы, связанного с концентрацией известным соотношением. Примером таких физических свойств могут быть коэффициент пропускания, коэффициент поглощения, электропроводность, угол поворота плоскости поляризации света и др. При использовании физико-химических методов нет необходимости в отборе проб, а анализ можно проводить непрерывно в ходе реакции. Значения концентрации рассчитываются на основе известных соотношений, связывающих то или иное физико-химическое свойство с концентрацией вещества. Особый случай составляют реакции первого порядка. Из уравнения можно видеть, что в данном случае для определения необходимы не сами концентрации, а их отношение. Если некоторое физико-химическое свойство (например, оптическая плотность раствора, электропроводность, угол вращения плоскости поляризации и т.п.) пропорционально концентрации какого-либо из участвующих в реакции веществ, то в уравнение можно вместо отношения концентраций подставлять отношение значений подходящего физико-химического свойства в соответствующие моменты времени. При химических методах анализа измеряется изменение количества вещества в ходе реакции. При этом из реакционного сосуда периодически отбирают пробы. Реакцию быстро останавливают, например, путем резкого охлаждения, разбавления или перевода одного из реагентов в нереакционноспособное состояние. Химические методы анализа просты, доступны, имеют достаточно высокую точность, но трудоемки.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Выполнение работы
Приготовить 20% раствор тростникового сахара. Для этого взвесить на технических весах 20 г сахара, поместить его в 100 мл мерную колбу, довести объем дистиллированной водой до метки. Если раствор мутный, то его необходимо отфильтровать. Затем с помощью пипетки или мерного цилиндра в колбе на 50 мл смешать раствора сахара и HCl в соотношении, заданном преподавателем. Время смешения отмечается как время начала реакции. Смесь тщательно перемешать, залить в поляриметрическую трубку и поместить в поляриметр. Оставшееся количество реакционной смеси поместить в термостат (40-60 0С) для определения Периодичность замеров угла вращения зависит от концентрации кислоты. Так при концентрации HCl 0.2М рекомендуется делать три замера с интервалом в 3 мин, два-три измерения с интервалом 10 мин и т.д. Всего необходимо сделать 12-15 замеров, при этом записать показание прибора и соответствующее ему время по часам. После всех измерений следует определить угол вращения, соответствующий концу реакции. Для этого оттермостатированную реакционную смесь охладить до комнатной температуры, налить в трубку и произвести измерение
Построить график зависимости Величину
Результаты опытов и расчетов оформить в виде таблицы 1, предваряя ее следующими данными. Температура опытаºC Концентрация сахарозы% Катализатор, начальная концентрациямоль/литр Объем раствора катализаторамл Концентрация катализаторамоль/литр Вращение конечное Логарифм разности конечного и начального вращения
Таблица 1. Изменение угла вращения во времени и константа скорости реакции инверсии сахара.
В выводах сравнить величины
Порядок выполнения работы
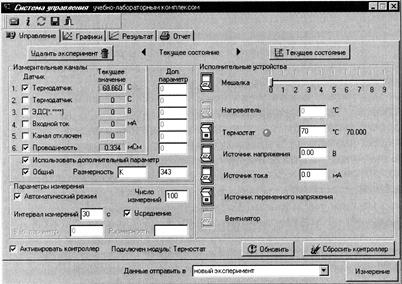
1. Наполнить термостат дистиллированной водой (примерно 100 мл), и установить в него стаканчик с 100 мл дистиллированной воды и магнитной мешалкой (уровень воды в термостате должен быть выше уровня рабочего раствора в стаканчике). Закрыть термостат крышкой. 2. Установить электроды для измерения электропроводности и термодатчик в соответствующие отверстия в крышке. Подсоединить электроды с помощью универсального кабеля к разъемам «I,R», а термодатчик к разъему «1». Оставшиеся отверстия в крышке закрыть пробками. 3. Включить контроллер, компьютер и запустить программу управления УЛК «Химия» - elsms2.exe. 4. В появившемся окне «Добро пожаловать в УЛК» необходимо выбрать вариант «Работа с контроллером» и нажать кнопку «Вход».
5. Для того чтобы в ходе работы проводить измерения температуры и электропроводности в окне «Управление» в группе элементов «Измерительные каналы» нужно поставить галочки напротив датчиков 1 и 6. При этом в столбце «Текущее значение» появятся текущие значения температуры (t, 0С) и электропроводности (L, мСм).
6. Далее необходимо установить следующие «Параметры измерения»: число измерений – 20, интервал измерений – 180 секунд, включить автоматический режим и усреднение. 7. Для быстрого термостатирования ячейки необходимо обеспечить в ней интенсивное перемешивание. Для этого в группе элементов «Исполнительные устройства» установить скорость перемешивания 3 и нажатием на кнопку включить мешалку. 8. Включить «Термостат» и установить требуемую температуру. 9. Т.к. в данном эксперименте измеряется электропроводность, то необходимо включить «Источник переменного напряжения». 10. Когда температура ячейки установится, нужно растворить навеску мочевины (1 г) и одновременно включить секундомер. Через 1 минуту отключить мешалку и нажать кнопку «Измерение». С этого момента начинается отсчет времени опыта. 11. В окне «Обмен данными с контроллером» будет отображаться кривая изменения измеряемого параметра. Для выбора нужной зависимости необходимо выбрать соответствующий канал. 12. Измерения заканчиваются путем нажатия кнопки «Стоп». После этого экспериментальные данные передаются в программу. 13. Чтобы сохранить данные нужно перейти в окно «Результат» и нажать на значок «Добавить график». В специальном окне определяется соответствие между координатами графика и данными, полученными на измерительных каналах. Необходимо выбрать для оси Х «Время», а для оси У – «Проводимость» и нажать кнопку «Принять». Далее нажать на значок «Дискета», который расположен в правой части окна над таблицей с экспериментальными данными, и сохранить в соответствующую папку. 14. Чтобы довести реакцию до конца и определить значение
Экспериментальные и расчетные данные оформить в виде таблицы 2, предваряя ее следующими данными.
Температура опыта 0С Концентрация раствора мочевины моль∙л-1
Таблица 2. Измерение электропроводности во времени и расчет константы скорости разложения мочевины в водном растворе.
k (найденная графически)=
Выполнение работы Перед работой на титраторе в бутыль для титровального раствора залить 200 мл 0,025 М NaOH. Для удалении пузырьков газа необходимо прокачать систему, для этого нажать кнопку F1 (примерно 3 секунды), для активации функции «промывание». В колбы на 250 мл налить по 100 мл водного раствора этилового эфира уксусной кислоты (0,015 моль/л) и раствора NaOH (Cщ=0,025 моль/л). Затем раствор щелочи быстро влить в раствор эфира. Смесь взболтать и сразу отобрать пипеткой первую пробу объемом 20 мл. Все отбираемые пробы сразу же переносят в заранее приготовленные колбы, в каждую из которых предварительно было налито 20 мл соляной кислоты с точно известной концентрацией (CK = 0.025 моль/л). Время отбора первой пробы отметить как время начало реакции. После этих операций в ячейку залить первую пробу реакционной смеси, опустить электроды и бюретку, включить мешалку и нажать кнопку START. Начинается режим «автоматическое титрование», который заканчивается при рН=7. На экране дисплея будет указано количество NaOH в мл, которое ушло на титрование данной пробы. После этого сполоснуть ячейку, мешалку и электроды дистиллированной водой и приступить к титрованию следующей пробы. Объем щелочи, пошедший на титрование избытка кислоты при отборе первой пробы, есть V0. Отбор следующих проб рекомендуется производить через 5, 10, 15, 25, 40 и 60 минут от начала реакции. Поскольку щелочь в пробе нейтрализуется кислотой, то титрование может быть проведено в наиболее удобное время. Колбу с оставшейся реакционной смесью поместить в термостат (40 0С) на 30 минут. После охлаждения реакционной смеси взять последнюю пробу для определения
Экспериментальные и расчетные данные оформить в виде таблицы 3, предваряя ее следующими данными. Температура опытаºC Реакционная смесь: Объем раствора этилацетатамл Концентрация раствора этилацетатамоль/л Объем раствора щелочимл Концентрация раствора щелочимоль/л Титрование: Объем раствора кислоты Концентрация раствора кислоты Концентрация раствора щелочи для титрования Объем раствора щелочи, пошедшей на титрование: в начале реакции по окончанию реакции
Таблица 3. Результаты титрования и расчеты константы скорости реакции омыления этилового эфира уксусной кислоты.
Порядок выполнения работы
1. Налить в термостат 100 мл дистиллированной воды. Установить в него стаканчик с 50 мл раствора NaOH (С=0.01 моль/л) и магнитной мешалкой. Закрыть термостат крышкой. 2. Установить стеклянный, хлоридсеребряный электроды и термодатчик в соответствующие отверстия в крышке. Подсоединить электроды с помощью универсального кабеля к разъемам «3» и « 3. Включить контроллер, компьютер и запустить программу управления УЛК «Химия» - elsms2.exe. 4. В появившемся окне «Добро пожаловать в УЛК» необходимо выбрать вариант «Работа с контроллером» и нажать кнопку «Вход».
5. Для того чтобы в ходе работы проводить измерения температуры и ЭДС в окне «Управление» в группе элементов «Измерительные каналы» нужно поставить галочки напротив датчиков 1 и 3. При этом в столбце «Текущее значение» появятся текущие значения температуры (t1, 0С) и ЭДС (Е, В) составленного гальванического элемента.
6. Далее необходимо установить следующие «Параметры измерения»: число измерений (10), интервал измерений (60 секунд), включить автоматический режим и усреднение. 7. Для быстрого термостатирования ячейки необходимо обеспечить в ней интенсивное перемешивание. Для этого в группе элементов «Исполнительные устройства» установить скорость перемешивания (3) и нажатием на кнопку включить мешалку. 8. Когда температура ячейки установится необходимо отобрать пипеткой предварительно рассчитанный объем эфира (его концентрация в растворе должна составлять 0.1 моль/л), влить его в ячейку и одновременно включить секундомер. Через 20 секунд отключить мешалку и нажать кнопку «Измерение». С этого момента начинается отсчет времени опыта. 9. В окне «Обмен данными с контроллером» будет отображаться кривая изменения измеряемого параметра. Для выбора нужной зависимости необходимо выбрать соответствующий канал. 10. Измерения заканчиваются путем нажатия кнопки «Стоп». После этого экспериментальные данные передаются в программу. 11. Чтобы сохранить данные нужно перейти в окно «Результат» и нажать на значок «Добавить график». В специальном окне определяется соответствие между координатами графика и данными, полученными на измерительных каналах. Необходимо выбрать для оси Х «Время», а для оси У – «ЭДС» и нажать кнопку «Принять». Далее нажать на значок «Дискета», который расположен в правой части окна над таблицей с экспериментальными данными, и сохранить в соответствующую папку. 12. Для проведения опыта при другой температуре (t2=t1+10 0C) необходимо перейти в окно «Управление» и нажать кнопку «Текущее состояние». В пункте «Исполнительные устройства» включить «Термостат» и установить требуемую температуру. Далее действовать согласно вышеприведенной инструкции.
Экспериментальные и расчетные данные оформить в виде таблицы 4, предваряя ее следующими данными.
Реакционная смесь: концентрация раствора щелочи моль∙л-1 концентрация раствора эфира моль∙л-1
Таблица 4. Измерение ЭДС во времени и расчет константы скорости омыления сложного эфира.
Определить константы скорости реакции графическим методом по тангенсам углов наклона прямых на графиках Вычислить энергию активации реакции.
Выполнение работы
Измерения электропроводности проводятся с помощью кондуктометра Conductivity Meter EC 215. Перед работой включить прибор в сеть и прогреть 5 минут. Выбрать шкалу измерения «1999µS». В колбу отобрать пипеткой 0.1 мл 57% раствора йодоводородной кислоты, разбавить водой до 50 мл и затем 15 мл получившегося раствора влить в сосуд для измерения электропроводности. В мерный цилиндр отобрать пипеткой 0.1 мл 30% раствора перекиси водорода и разбавить водой до 15 мл. Добавить раствор перекиси водорода к раствору йодоводородной кислоты и тщательно перемешать. Опустить в смесь электроды. Время смешения принять за начало отсчета. Первое значение электропроводности измерить через 1 минуту. Дальнейшие измерения проводить каждую минуту. Через 40 минут после начала опыта измерения можно прекратить, так как изменение величины электропроводности будет уже незначительным. По полученным данным построить график в координатах Температура опытаºC Концентрация H2O2 в реакционной смесимоль л-1 Логарифм удельной электропроводности в начале реакции
Таблица 5. Изменение удельной электропроводности во времени и расчет константы скорости реакции окисления йодо- водородной кислоты
В выводах сравнить величины
Выполнение работы
Убедитесь в том, что в кюветном отделении спектрофотометра на пути светового пучка ничего не установлено, и крышка кюветного отделения закрыта. Включите спектрофотометр с помощью сетевого выключателя, расположенного на задней панели прибора. Раздастся звуковой сигнал и на дисплее начинает отображаться ход процедуры самодиагностики. По ее завершении начинается прогрев прибора, который длится 20 минут. В кюветное отделение поместить кювету с дистиллированной водой и нажать кнопку «Ноль». На дисплее должно высветиться значение «100». Реакционная смесь готовится в следующей последовательности: в фарфоровый стакан емкостью 20 мл налить 1 мл 0.1М раствора MnSO4, Полученной реакционной смесью заполнить кювету и поместить в кюветное отделение спектрофотометра. Сменить кювету с дистиллированной водой на такую же кювету с реакционной смесью и снимать показания прибора во времени Измерения рекомендуется производить через 1, 2, 4, 6, 10 минут от начала реакции и прекращать при После окончания измерений строится график зависимости Кроме того, экспериментально измеренные и расчетные данные следует занести в таблицу 6, предварив ее следующими данными.
Температура опытаºC Логарифм оптической плотности в начале реакции
Таблица 6. Изменение коэффициента пропускания во времени и расчет константы скорости реакции разложения триоксалата марганца
В выводах сравнить величины Литература
1. Герасимов Я.И. и др. Курс физической химии: В 2 томах. М.: Химия, 1969. 2. Горбачев С.В. и др. Практикум по физической химии. М.: Высшая школа, 1974. 3. Воробьев Н.К. и др. Практикум по физической химии. М.: Химия, 1975. 4. Байрамов В.М. Основы химической кинетики и катализа. М.: Академия, 2003. 5. Химическая энциклопедия / под ред. И.Л.Кнунянца: В 5 томах. М.: Советская энциклопедия, 1990.
Содержание
1. ОСНОВНЫЕ ПОНЯТИЯ ХИМИЧЕСКОЙ КИНЕТИКИ 3 1.1 Скорость химической реакции 3 1.2 Зависимость скорости от концентрации реагирующих веществ 5 1.3 Расчет константы скорости для необратимых реакций 8 1.4 Время полупревращения 10 1.5 Методы определения порядка реакции 11 1.6 Методы определения концентрации 13 1.7 Зависимость скорости реакции от температуры 14 1.8 Влияние катализатора на скорость химической реакции 16 2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ 17 Работа 1. Изучение скорости инверсии тростникового сахара 17 Работа 2. Изучение кинетики реакции разложения мочевины в водных растворах методом измерения электропроводности…………………………………………….. 23 Работа 3. Изучение скорости омыления сложных эфиров щелочью 27 Работа 4. Изучение кинетики реакции омыления уксусноэтилового эфира щелочью методом потенциометрии……………………..31 Работа 5. Определение константы скорости реакции окисления йодоводородной кислоты пероксидом водорода 35 Работа 6. Фотометрическое изучение скорости разложения комплексного иона триоксалата марганца 37 Литература 39
ОСНОВНЫЕ ПОНЯТИЯ ХИМИЧЕСКОЙ КИНЕТИКИ
Скорость химической реакции
Химическая кинетика (от греч. Kinetikos - относящийся к движению) - раздел физической химии, изучающий химическую реакцию, как процесс, протекающий во времени, механизм этого процесса, его зависимость от условий осуществления. Одним из важнейших понятий химической кинетики является скорость реакции. Она определяется изменением количества какого-либо из реагирующих веществ (или продуктов реакции) в единицу времени в единице объема. В частном случае, например, когда реакция происходит в растворе, объем реакционной смеси не меняется. Тогда изменение количества вещества в единице объема есть изменение концентрации. Соответственно, скорость реакции в растворе определяется изменением концентрации вещества в единицу времени. Исходные вещества вступают в реакцию (а продукты образуются) в определенных соотношениях, которые определяются стехиометрическими коэффициентами. Поэтому изменение концентрации для разных реагентов (или продуктов) за один и тот же интервал времени в одной и той же реакции может быть различным. В связи с этим различают понятия «скорость химической реакции» и «скорость изменения концентрации». Скорость изменения концентрации (r) есть производная по времени (t) концентрации (C) какого-либо из реагирующих веществ (или продуктов реакции):
Очевидно, что скорость изменения концентрации может быть различна по величине для разных веществ, участвующих в реакции. К тому же она противоположна по знаку для реагентов и продуктов реакции. Скорость химической реакции (
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 785; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.129.73.6 (0.012 с.) |


 ) по определению есть величина положительная. Она не должна зависеть от того, по какому из реагирующих веществ (или продуктов) ее определяют.
) по определению есть величина положительная. Она не должна зависеть от того, по какому из реагирующих веществ (или продуктов) ее определяют.


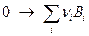
 считается алгебраически положительным (
считается алгебраически положительным ( относится к продуктам, и алгебраически отрицательным (
относится к продуктам, и алгебраически отрицательным (
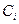 - концентрация вещества
- концентрация вещества 
 и
и  на интервал времени
на интервал времени  . Определенная таким образом скорость называется средней скоростью (
. Определенная таким образом скорость называется средней скоростью ( ). Она равна мгновенной скорости только при
). Она равна мгновенной скорости только при 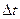 стремящемся к нулю (или если мгновенная скорость не зависит от времени).
стремящемся к нулю (или если мгновенная скорость не зависит от времени).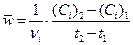

 , равной промежутку времени, в течение которого прореагирует половина исходного количества вещества. Если исходная концентрация вещества равна
, равной промежутку времени, в течение которого прореагирует половина исходного количества вещества. Если исходная концентрация вещества равна  , то связь времени полупревращения с константой скорости для реакций первого, второго и третьего порядков можно получить, подставив
, то связь времени полупревращения с константой скорости для реакций первого, второго и третьего порядков можно получить, подставив 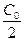 вместо
вместо  и
и 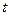 в уравнения, и, соответственно.
в уравнения, и, соответственно.



 в уравнении может быть применен один из трех следующих наиболее типичных методов.
в уравнении может быть применен один из трех следующих наиболее типичных методов. -
- 
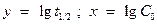 . Угловой коэффициент этой зависимости равен
. Угловой коэффициент этой зависимости равен 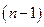 , где
, где  - искомый порядок реакции. Ограничения метода: 1) метод применим только при достаточно полном протекании реакции (то есть когда начальная концентрация реагента изменяется не менее чем в два раза); 2) уравнения и, а значит и этот метод, неприменимы при
- искомый порядок реакции. Ограничения метода: 1) метод применим только при достаточно полном протекании реакции (то есть когда начальная концентрация реагента изменяется не менее чем в два раза); 2) уравнения и, а значит и этот метод, неприменимы при  . Если
. Если  , получим:
, получим:
 , мы должны получить линейную зависимость, угловой коэффициент которой и равен порядку реакции. В отличие от двух предыдущих методов (относящихся к группе интегральных) в методе Вант-Гоффа для построения графика необходимы значения скорости при различных концентрациях. Скорость – это производная концентрации по времени. Эта величина может быть получена из кинетической кривой, как угловой коэффициент касательной в выбранной точке. Дифференциальный метод Вант-Гоффа привлекателен своей простотой и теоретически позволяет найти любое значение
, мы должны получить линейную зависимость, угловой коэффициент которой и равен порядку реакции. В отличие от двух предыдущих методов (относящихся к группе интегральных) в методе Вант-Гоффа для построения графика необходимы значения скорости при различных концентрациях. Скорость – это производная концентрации по времени. Эта величина может быть получена из кинетической кривой, как угловой коэффициент касательной в выбранной точке. Дифференциальный метод Вант-Гоффа привлекателен своей простотой и теоретически позволяет найти любое значение  .
.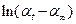 от
от  следует определить графическим путем, экстраполируя прямую зависимость
следует определить графическим путем, экстраполируя прямую зависимость  . Тогда
. Тогда  . Тангенс угла наклона прямой к оси абсцисс, взятый с обратным знаком, равен константе скорости реакции
. Тангенс угла наклона прямой к оси абсцисс, взятый с обратным знаком, равен константе скорости реакции  .
.


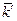 =
=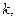 полученные графическим и аналитическим способами.
полученные графическим и аналитическим способами.

 , температуру в термостате необходимо поднять до 950С и выдержать раствор в течение 1 часа. Затем охладить раствор до первоначальной температуры и определить
, температуру в термостате необходимо поднять до 950С и выдержать раствор в течение 1 часа. Затем охладить раствор до первоначальной температуры и определить  , мСм
, мСм


 =
= .
. мл
мл моль/л
моль/л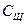 моль/л
моль/л мл
мл
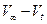
 , л.мин-1.моль-1
, л.мин-1.моль-1
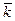 =
= », а термодатчик к разъему «1». Оставшееся отверстие в крышке закрыть пробкой.
», а термодатчик к разъему «1». Оставшееся отверстие в крышке закрыть пробкой.
 , В
, В
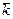 =
= 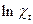 -
- 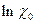 . Константу скорости реакции определить расчетным путем и графическим методом. Экспериментально измеренные и расчетные данные занести в таблицу 5, предварив ее следующими данными:
. Константу скорости реакции определить расчетным путем и графическим методом. Экспериментально измеренные и расчетные данные занести в таблицу 5, предварив ее следующими данными: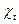
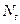 .
.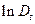 -
-  .
.