
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Работа 4. Изучение кинетики реакции омыления уксусноэтилового эфира щелочью методом потенциометриииСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Реакция окисления уксусноэтилового эфира протекает по уравнению
Данная реакция практически необратима, протекает с заметной скоростью и является реакцией второго порядка. В общем случае выражение для скорости этой реакции можно записать
Для определения частного порядка реакции по гидроксид-иону и константы скорости применяется "метод избытка реагента". При избытке эфира уравнение для константы скорости будет иметь вид
где
В данной работе концентрация щелочи определяется методом потенциометрии. В качестве индикаторного используется стеклянный электрод. Потенциал стеклянного электрода зависит от активности ионов водорода:
Активность ионов водорода связана с активностью гидроксид-ионов
где
где Таким образом, мы установили, что потенциал стеклянного электрода линейно зависит от концентрации гидроксид-ионов. Составим гальваническую цепь из стеклянного электрода и электрода сравнения, погруженных в исследуемый раствор. В работе в качестве электрода сравнения используется насыщенный хлоридсеребряный электрод (ХСЭ). Измеряемая ЭДС такой цепи будет равна
Из этого уравнения находим концентрацию гидроксид-ионов
и подставляем в уравнение (1)
где Константу скорости реакции вычисляем по уравнению
Для определения
Т.е. по тангенсу угла наклона прямой в координатах
Порядок выполнения работы
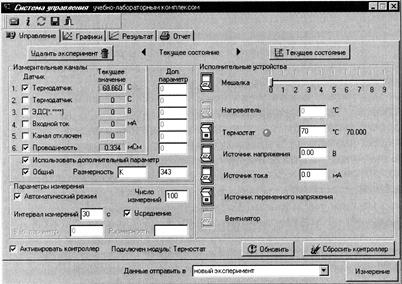
1. Налить в термостат 100 мл дистиллированной воды. Установить в него стаканчик с 50 мл раствора NaOH (С=0.01 моль/л) и магнитной мешалкой. Закрыть термостат крышкой. 2. Установить стеклянный, хлоридсеребряный электроды и термодатчик в соответствующие отверстия в крышке. Подсоединить электроды с помощью универсального кабеля к разъемам «3» и « 3. Включить контроллер, компьютер и запустить программу управления УЛК «Химия» - elsms2.exe. 4. В появившемся окне «Добро пожаловать в УЛК» необходимо выбрать вариант «Работа с контроллером» и нажать кнопку «Вход».
5. Для того чтобы в ходе работы проводить измерения температуры и ЭДС в окне «Управление» в группе элементов «Измерительные каналы» нужно поставить галочки напротив датчиков 1 и 3. При этом в столбце «Текущее значение» появятся текущие значения температуры (t1, 0С) и ЭДС (Е, В) составленного гальванического элемента.
6. Далее необходимо установить следующие «Параметры измерения»: число измерений (10), интервал измерений (60 секунд), включить автоматический режим и усреднение. 7. Для быстрого термостатирования ячейки необходимо обеспечить в ней интенсивное перемешивание. Для этого в группе элементов «Исполнительные устройства» установить скорость перемешивания (3) и нажатием на кнопку включить мешалку. 8. Когда температура ячейки установится необходимо отобрать пипеткой предварительно рассчитанный объем эфира (его концентрация в растворе должна составлять 0.1 моль/л), влить его в ячейку и одновременно включить секундомер. Через 20 секунд отключить мешалку и нажать кнопку «Измерение». С этого момента начинается отсчет времени опыта. 9. В окне «Обмен данными с контроллером» будет отображаться кривая изменения измеряемого параметра. Для выбора нужной зависимости необходимо выбрать соответствующий канал. 10. Измерения заканчиваются путем нажатия кнопки «Стоп». После этого экспериментальные данные передаются в программу. 11. Чтобы сохранить данные нужно перейти в окно «Результат» и нажать на значок «Добавить график». В специальном окне определяется соответствие между координатами графика и данными, полученными на измерительных каналах. Необходимо выбрать для оси Х «Время», а для оси У – «ЭДС» и нажать кнопку «Принять». Далее нажать на значок «Дискета», который расположен в правой части окна над таблицей с экспериментальными данными, и сохранить в соответствующую папку. 12. Для проведения опыта при другой температуре (t2=t1+10 0C) необходимо перейти в окно «Управление» и нажать кнопку «Текущее состояние». В пункте «Исполнительные устройства» включить «Термостат» и установить требуемую температуру. Далее действовать согласно вышеприведенной инструкции.
Экспериментальные и расчетные данные оформить в виде таблицы 4, предваряя ее следующими данными.
Реакционная смесь: концентрация раствора щелочи моль∙л-1 концентрация раствора эфира моль∙л-1
Таблица 4. Измерение ЭДС во времени и расчет константы скорости омыления сложного эфира.
Определить константы скорости реакции графическим методом по тангенсам углов наклона прямых на графиках Вычислить энергию активации реакции.
|
||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 712; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.75.169 (0.011 с.) |



 ,
,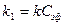 , и кинетика этой реакции будет подчиняться кинетике реакции первого порядка, а выражение для константы скорости будет
, и кинетика этой реакции будет подчиняться кинетике реакции первого порядка, а выражение для константы скорости будет (1)
(1) (2)
(2)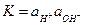 (3)
(3) - ионное произведение воды, величина постоянная при заданной температуре. Из уравнения (3) находим концентрацию ионов водорода и подставляем в (2):
- ионное произведение воды, величина постоянная при заданной температуре. Из уравнения (3) находим концентрацию ионов водорода и подставляем в (2): ,
, ;
; 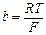


 (4),
(4), - разность потенциалов в момент времени t от начала опыта, а
- разность потенциалов в момент времени t от начала опыта, а  - в начальный момент времени.
- в начальный момент времени.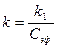 (5)
(5)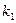 графическим методом уравнение (4) запишем в виде
графическим методом уравнение (4) запишем в виде
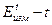 можно оценить
можно оценить  , а затем по уравнению (5) найти константу скорости реакции. Зная константы скорости при двух температурах Т1 и Т2 можно вычислить энергию активации Еа по уравнению
, а затем по уравнению (5) найти константу скорости реакции. Зная константы скорости при двух температурах Т1 и Т2 можно вычислить энергию активации Еа по уравнению (6)
(6) », а термодатчик к разъему «1». Оставшееся отверстие в крышке закрыть пробкой.
», а термодатчик к разъему «1». Оставшееся отверстие в крышке закрыть пробкой.
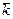 =
= 


