
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема. Агрегатное состояние веществаСодержание книги
Поиск на нашем сайте Задачи, относящиеся к этой теме решаются с использованием уравнений законов Бойля-Мариотт, Шарля, Гей-Люсака, уравнение Менделеева-Клайнерона, а также с использованием формул, позволяющих определить вязкость и поверхностное натяжение. Пример: Вычислите поверхностное натяжение толуола при 50 оС, если при медленном истечении его из сталагмометра масса 38 капель равна 1,4864 г. При истечении из этого же сталагмометра 25 капель, равна 2,6570 г, поверхностное натяжение воды при 50 оС равно 67,91×10-3 н/м. Дано:
s1 =? Ответ: поверхностное натяжение толуола при 50оС равно 38,88×10-3 н/м.
Тема. Химическая кинетика Задачи, относящиеся к теме «Химическая кинетика» можно разделить на следующие группы: 1. Определение скорости реакции в зависимости от температуры. 2. Определение скорости реакции в зависимости от изменения концентрации. 3. Решение задач на расчет констант равновесия, равновесных и исходных концентраций. Задача 2 Определить во сколько раз увеличится скорость реакции, протекающей в газовой фазе при повышении температуры от 20оС до Дано:
Ответ: скорость реакции при нагревании до 60 оС увеличивается в 81 раз.
Задача 3 Взаимодействие между оксидом углерода (II) и хлором идет по уравнению СО + Cl2 ® COCl2 Концентрация оксида углерода 0,3 моль/л, а хлора 0,2 моль/л. Как изменится скорость реакции, если увеличить концентрацию хлора до 0,6 моль/л, а концентрацию оксида углерода (II) до 1,2 моль/л? Дано:
Ответ: При увеличении концентрации хлора до 1,2 моль/л и концентрации оксида углерода (II) до 0,6 моль/л скорость реакции увеличивается в 64 раза.
Задача 4 Равновесие в системе Н2 + J2 ® 2HJ установилось при следующих концентрациях, участвующих в ней веществ [H2] = 0,25 моль/л, [J2] = 0,05 моль/л, [HJ] = 0,9 моль/л. Определите значение константы равновесия и исходной концентрации йода и водорода.
2х = 0,9 х = 0,45 [H2]исх = 0,45 + 0,25 = 0,7 моль/л [J2]исх = 0,05 + 0,25 = 0,3 моль/л
Ответ: исходная концентрация водорода 0,7 моль/л, а йода – 0,3 моль/л. Константа равновесия 64,6.
Тема. Растворы Задачи этой темы решаются с использованием законов Вант-Гоффа, Рауля, уравнений ионного произведения воды и водородного показателя. Задача с использованием уравнения закона Вант-Гоффа: Задача 5 Определите молярную массу электролита, если в 5 л раствора содержится 2,5 г его. Осмотическое давление этого раствора при 20оС равно 0,23×105 Па.
кг×Дж/моль×к×К кг×н×м×к×м2 кг [m] = --------------------- = ---------------- = ------- Н/м2×м3 н×моль×к×м3 моль Ответ: молярная масса электролита равна 52,96×10–3 кг/моль.
Задача 6 Решение задач с использованием второго закона Рауля. Δtкип. = кэбл · С Δtзам. = ккр · С Пример: Определите температуру кипения и замерзания раствора, состоящего из 1000 г воды и 100 г сахара. Дано:
tокип. = 0о – 0,58о = – 0,58о Ответ: температура кипения раствора сахара 100,15оС, а температура замерзания того же раствора –0,58оС.
Задачи с использованием полного произведения воды [H+]·[OH–] =
Задача 7 Дано:
[H+]·[OH–] = 10–14
рН = –lg7,25·10–9 = –(lg7,25 + lg10–9) = –(0,86 – 9) = 0,86 + 9 = 8,14 Ответ: рН = 8,14, значит среда щелочная.
Раздел III. Коллоидная химия Тема. Коллоидные растворы Зная строение коллоидных частиц студенты должны уметь составлять схемы строения и формулы мицелл. Для правильного составления мицеллы используется следующий план: 1. Записывается уравнение химической реакции. Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl 2. С помощью таблицы растворимости следует установить, какое из полученных веществ выпало в осадок. В данном случае это BaSO4. Этот осадок будет образовывать ядро коллоидной частицы, состоящее из множества молекул. mBaSO4-ядро. 3. На ядре идут адсорбционные процессы, за счет свободной поверхностной энергии. 4. На ядре адсорбируются ионы электролита, взятого в избытке по правилу Пескова-Фолиса. 5. Допустим в избытке взят BaCl2, значит он будет в растворе находиться в виде ионов BaCl2 → Ba2+ + 2Cl– Эти ионы и будут участвовать в образовании адсорбционного и диффузного слоев.
ядро адсорбционный диффузный слой слой
мицелла
Контрольные задания Вариант № 1 1. Дайте обоснование титриметрического метода анализа. Покажите преимущества и недостатки данного метода.
2. Электрокинетические явления коллоидных растворов (электрофорез и электроосмос), их значение. Схема опыта Рейсса.
3. Дайте определение и раскройте сущность основных понятий качественного химического анализа: аналитическая реакция, аналитический сигнал. Перечислите требования, предъявляемые к аналитическим реакциям. Ответ подтвердите уравнениями реакций.
Вариант № 2
1. Покажите роль осадителя в гравиметрическом анализе. Примеры расчета осадителя в реакции.
2. Очистка золей: диализ, электродиализ, ультрафильтрация, схема и принцип работы прибора диализатора и электродиализатора.
3. Назовите принципы, положенные в основу классификации катионов и анионов на группы. Укажите общие аналитические признаки групп и действие группового реагента для 1 группы анионов.
Вариант № 3
1. Раскройте основы метода аргентометрии (метода Фаянса): обоснование, основное уравнение, особенности приготовления рабочих растворов: установочные вещества, индикация, способы титрования, возможности метода. Рассчитайте навеску вещества, необходимую для приготовления рабочих растворов, концентрации 0,05 моль /л AgNO3, объемом 250 мл.
2. Опишите получение коллоидных растворов методом пептизации. Напишите формулы мицеллы золя BaSO4, полученного при взаимодействии H2SO4 с избытком Ba(NO3)2. Укажите все части мицеллы.
3. Дайте определение и раскройте сущность основных понятий качественного химического анализа: реагент, групповой реагент. Перечислите требования, предъявляемые к нему. Ответ подтвердите примерами.
Вариант № 4 1. Раскройте основы метода аргентометрии (метод Фольгарда): обоснование, основное уравнение, особенности приготовления рабочих растворов; установочные вещества, индикация, способы титрования, возможности метода. Рассчитайте навеску вещества, необходимую для приготовления рабочих растворов, концентрации 0,05 моль/л NH4SCN, объемом 1 л.
2. Золь серы был получен добавлением 5 см3 раствора серы в этаноле к дистиллированной воде. Каким методом получен золь? Чем объясняется, что в прошедшем свете золь имеет красновато-оранжевый оттенок, а в отражённом - голубоватый?
3. Назовите принципы, положенные в основу классификации катионов и анионов на группы. Укажите общие аналитические признаки группы и действие группового реагента для 2 группы катионов.
Вариант № 5
1. Укажите основные требования к реакциям, применяемым в титриметрическом анализе. Какие дополнительные требования предъявляются к реакциям окисления – восстановления, осаждения и комплексообразования? Приведите примеры используемых реакций. Рассчитайте навеску MgSO4 · 7H2O, необходимую для приготовления 100 мл 0,1 Н раствора.
2. При пропускании избытка сероводорода в подкисленный раствор хлорида мышьяка (III) образовался золь сульфида мышьяка (III). Напишите формулу мицеллы золя и укажите её части.
3. Дайте определение и раскройте сущность основных понятий качественного химического анализа: чувствительность аналитических реакций, способы ее выражения. Каким образом ее можно повысить?
Вариант № 6
1. Дайте определения понятия: титрованный раствор. Типы и способы приготовления титрованных растворов. Примеры. Фиксаналы. Рассчитайте молярную концентрацию 10% раствора NaOH (р = 1,11 г/см).
2. Коагуляция золей. Факторы, вызывающие коагуляцию. Коллоидная защита. Изоэлектрическое состояние. Порог коагуляции.
3. Назовите принципы, положенные в основу кислотно-основной классификации катионов. Укажите общие аналитические признаки групп и действие группового реагента для 3 группы катионов.
Вариант № 7
1. Рассчитайте факторы эквивалентности, эквиваленты реагирующих веществ. Укажите, является ли эквивалент веществ постоянной величиной, от чего он зависит?
2. Напишите формулу мицеллы золя АgВr, полученного при взаимодействии АgNО3 с избытком КВr. Укажите все части мицеллы.
3. Дайте определение и раскройте сущность основных понятий качественного анализа: групповые, характерные, специфические, селективные аналитические реакции и реагенты. Ответ подтвердите примерами.
Вариант № 8
1. Оптические свойства золей: опалесценция, эффект Фарадея-Тиндаля, окраска. Оптические свойства бульона, чая, вин, молока.
2. Какую эмульсию будет стабилизировать сажа: эмульсию бензола в воде или воды в бензоле? Объясните и покажите на схеме механизм стабилизации.
3. Назовите принципы, положенные в основу классификации катионов и анионов на группы. Укажите общие аналитические признаки групп и действие группового реагента для 4 группы катионов.
Вариант № 9
1. Методы исследования дисперсных систем: ультрамикроскопия, нефелометрия.
2. Деэмульгирование и его значение. Опишите свойства и получение порошков, суспензий, паст, применяемых в технологии приготовления пищи. 3. Дайте определение и раскройте сущность основных понятий качественного химического анализа: способы выполнения реакций. Назовите имена ученых, предложивших тот или иной способ выполнения реакций. Ответ подтвердите примерами.
Вариант № 10
1. Раскройте основы метода алкалиметрии: обоснование, основное уравнение, особенности приготовления рабочих растворов; установочные вещества, индикация, способы титрования, возможности метода. Рассчитайте навеску вещества, необходимую для приготовления рабочих растворов, концентрации 0,5 моль/л КОН V=250 мл. 2. Молекулярно-кинетические свойства дисперсных систем: броуновское движение, диффузия, осмотическое давление. Седиментация, центрифугирование.
3. Назовите принципы, положенные в основу кислотно-основной классификации катионов на группы. Укажите общие аналитические признаки групп и действие группового реагента для 5 группы катионов.
Вариант № 11
1. Раскройте основы метода титриметрического анализа: обоснование, основное уравнение, особенности приготовления рабочих растворов, установочные вещеcтва, индикация, способы титрирования, возможности метода ацидиметрии. Рассчитайте навеску вещества, необходимую для приготовления рабочих растворов, концентрации 1 моль/л H2SO4, V=2 л.
2. Опишите получение коллоидных растворов методом диспергирования (механическое, электрическое, ультразвуком).
3. Дайте определение и раскройте сущность основных понятий качественного химического анализа: дробный анализ. Напишите реакции дробного обнаружения Mg2+, Fe2+, Fe3+, NO2-, J-. Способы устранения влияния мешающих компонентов.
Вариант № 12
1. Рассчитайте факторы эквивалентности, эквиваленты реагирующих веществ. Укажите, являются ли эквивалент вещества постоянной величиной, от чего он зависит? K2CO3 + 2HCl =2KCl + CO2 + H2O K2CO3 + H3PO4 = KH2PO4 + KHCO3 MnSO4 + 2KOH = Mn(OH)2 + K2SO4 MnSO4 + 2Cl2 + 8KOH = K2MnO4 + 4KCl + K2SO4 + 4H2O 2. Деэмульгирование и его значение. Опишите свойства и получение порошков, суспензий, паст, применяемых в технологии приготовления пищи.
3.Назовите принципы, положенные в основу кислотно-основной классификации катионов на группы. Укажите общие аналитические признаки групп и действие группового реагента для 6 группы катионов. Вариант № 13
1. Раскройте основы метода аргентометрии (метода Фаянса): обоснование, основное уравнение, особенности приготовления рабочих растворов: установочные вещества, индикация, способы титрования, возможности метода. Рассчитайте навеску вещества, необходимую для приготовления рабочих растворов, концентрации 0,05 моль/л AgNO3, объемом 250 мл.
2. При пропускании избытка сероводорода в подкисленный раствор хлорида мышьяка (III) образовался золь сульфида мышьяка (III). Напишите формулу мицеллы золя и укажите её части.
3. Составьте в молекулярном и ионном виде уравнения следующих химических реакций в водном растворе: ZnCl2 + K4[Fe(CN)6]; ® MnCl2 + NaBiO3 + HNO3 ®
Вариант № 14
1. Поясните роль исходных (стандартных, установочных) веществ в титриметрическом анализе. Укажите требования к ним. Приведите примеры таких веществ.
2. Оптические свойства золей: опалесценция, эффект Фарадея-Тиндаля, окраска. Оптические свойства бульона, чая, вин, молока.
3. Назовите принципы, положенные в основу классификации анионов по Алимарину-Блоку на группы. Укажите общие аналитические признаки групп и действие группового реагента для 1 группы анионов.
Вариант № 15
1. Раскройте основы метода алкалиметрии: обоснование, основное уравнение, особенности приготовления рабочих растворов; установочные вещества, индикация, способы титрования, возможности метода. Рассчитайте навеску вещества, необходимую для приготовления рабочих растворов, концентрации 0,5 моль/л КОН V=250 мл.
2. Методы исследования дисперсных систем: ультрамикроскопия, нефелометрия. 3. Дайте определение и раскройте сущность основных понятий качественного химического анализа: органические реагенты. Их роль в качественном химическом анализе. Ответ подтвердите примерами реакций.
Вариант № 16
1. Раскройте основы метода титриметрического анализа: обоснование, основное уравнение, особенности приготовления рабочих растворов, установочные вещеcтва, индикация, способы титрирования, возможности метода ацидиметрии. Рассчитайте навеску вещества, необходимую для приготовления рабочих растворов, концентрации 1 моль/л H2SO4, V=2 л.
2. Понятие об агрегативной и кинетической устойчивости коллоидных растворов. Напишите формулу мицеллы золя АgВr, полученного при взаимодействии АgNО3 с избытком КВr. Укажите все части мицеллы.
3. Составьте в молекулярном и ионном виде уравнения следующих химических реакций в водном растворе: CuSO4 + H2S ® MgCl2 + (NH4)2HPO4 ®
Вариант № 17
1. Покажите способы выражения концентраций растворов в титриметрическом анализе: молярная концентрация, молярная концентрация эквивалента, титр, титр раствора по определяемому веществу. Что такое поправочный коэффициент? Его значение, формулы расчета.
2. Коагуляция золей. Факторы, вызывающие коагуляцию. Коллоидная защита Изоэлектрическое состояние. Порог коагуляции.
3. Дайте определение и раскройте сущность основных понятий качественного химического анализа: экстракционные методы разделения и обнаружения ионов (Co2+, Cr3+, CH3COO-,SCN-).
Вариант № 18
1. Раскройте основы метода титриметрического анализа: обоснование, основное уравнение, особенности приготовления рабочих растворов, установочные вещеcтва, индикация, способы титрирования, возможности метода ацидиметрии. Рассчитайте навеску вещества, необходимую для приготовления рабочих растворов, концентрации 1 моль/л H2SO4, V=2 л.
2. Молекулярно-кинетические свойства дисперсных систем: броуновское движение, диффузия, осмотическое давление. Седиментация, центрифугирование. 3. Назовите принципы, положенные в основу классификации анионов по Алимарину-Блоку на группы. Укажите общие аналитические признаки групп и действие группового реагента для 3 группы анионов.
Вариант № 19
1. Деэмульгирование и его значение. Опишите свойства и получение порошков, суспензий, паст, применяемых в технологии приготовления пищи.
2. Методы исследования дисперсных систем: ультрамикроскопия, нефелометрия.
3. Составьте в молекулярном и ионном виде уравнения следующих химических реакций в водном растворе: (NH4)2C2O4 + CaCl2 ®; NaOHизб. + ZnCl2 ®
Вариант № 20
1. Раскройте основы метода алкалиметрии: обоснование, основное уравнение, особенности приготовления рабочих растворов; установочные вещества, индикация, способы титрования, возможности метода. Рассчитайте навеску вещества, необходимую для приготовления рабочих растворов, концентрации 0,5 моль/л КОН V=250 мл.
2. Молекулярно-кинетические свойства дисперсных систем: броуновское движение, диффузия, осмотическое давление. Седиментация, центрифугирование.
3. Назовите принципы, положенные в основу классификации катионов и анионов на группы. Укажите общие аналитические признаки групп и действие группового реагента для 4 группы анионов (по классификации Алимарина-Блока).
Вариант № 21 1. Дайте обоснование титриметрического метода анализа. Покажите преимущества и недостатки данного метода.
2. Электрокинетические явления коллоидных растворов (электрофорез и электроосмос), их значение. Схема опыта Рейсса.
3. Предложите рациональную схему анализа и приведите уравнения реакций, лежащих в основе разделения и обнаружения анионов при совместном присутствии CO32-, SO42-, S2-.
Вариант № 22
1. Покажите роль осадителя в гравиметрическом анализе. Примеры расчета осадителя в реакции.
2. Пищевые кислоты и их определение в лабораторном практикуме.
3. Объясните и напишите уравнения химических реакций. Что называется «содовой вытяжкой» или «приготовленным раствором» для открытия анионов? Приведите примеры.
Вариант № 23
1. Раскройте основы метода аргентометрии (метода Фаянса): обоснование, основное уравнение, особенности приготовления рабочих растворов: установочные вещества, индикация, способы титрования, возможности метода. Рассчитайте навеску вещества, необходимую для приготовления рабочих растворов, концентрации 0,05 моль /л AgNO3, объемом 250 мл.
2. Опишите получение коллоидных растворов методом пептизации. Напишите формулы мицеллы золя BaSO4, полученного при взаимодействии H2SO4 с избытком Ba(NO3)2. Укажите все части мицеллы.
3. Предложите рациональную схему анализа и приведите уравнения реакций, лежащих в основе разделения и обнаружения анионов при совместном присутствии J-,NO2-, CH3COO-.
Вариант № 24
1. Раскройте основы метода аргентометрии (метод Фольгарда): обоснование, основное уравнение, особенности приготовления рабочих растворов; установочные вещества, индикация, способы титрования, возможности метода. Рассчитайте навеску вещества, необходимую для приготовления рабочих растворов, концентрации 0,05 моль/л NH4SCN, объемом 1 л.
2. Золь серы был получен добавлением 5 см3 раствора серы в этаноле к дистиллированной воде. Каким методом получен золь? Чем объясняется, что в прошедшем свете золь имеет красновато-оранжевый оттенок, а в отражённом - голубоватый? 3. Объясните и напишите уравнения химических реакций. Что произойдет при подкислении раствора, содержащего Na+, J-, NO2-,SO32- ионы?
Вариант № 25
1. Укажите основные требования к реакциям, применяемым в титриметрическом анализе. Какие дополнительные требования предъявляются к реакциям окисления – восстановления, осаждения и комплексообразования? Приведите примеры используемых реакций. Рассчитайте навеску MgSO4 7H2O, необходимую для приготовления 100 мл 0,1 Н раствора.
2. При пропускании избытка сероводорода в подкисленный раствор хлорида мышьяка (III) образовался золь сульфида мышьяка (III). Напишите формулу мицеллы золя и укажите её части.
3. Предложите рациональную схему анализа и приведите уравнения реакций, лежащих в основе разделения и обнаружения анионов при совместном присутствии SO42-, S2-, SO32-, S2O32-.
Вариант № 26
1. Дайте определения понятия: титрованный раствор. Типы и способы приготовления титрованных растворов. Примеры. Фиксаналы. Рассчитайте молярную концентрацию 10% раствора NaOH (р = 1,11 г/см).
2. Коагуляция золей. Факторы, вызывающие коагуляцию. Коллоидная защита. Изоэлектрическое состояние. Порог коагуляции.
3. Объясните и напишите уравнения химических реакций. Почему мешающее влияние сульфит и тиосульфат – ионов при обнаружении карбонат – ионов устраняют в нейтральной среде перманганатом калия?
Вариант № 27
1. Рассчитайте факторы эквивалентности, эквиваленты реагирующих веществ. Укажите, является ли эквивалент веществ постоянной величиной, от чего он зависит? 3KJ + KBrO3 + 6HCl = 3JCl + KBr + 3KCl + 3H2O 2KJ + H2O2 + H2SO4 = J2 + K2SO4 +2H2O 2KJ + Hg(NO3)2 = HgJ2 + 2KNO3. 2. Напишите формулу мицеллы золя АgВr, полученного при взаимодействии АgNО3 с избытком КВr. Укажите все части мицеллы.
3. Предложите рациональную схему анализа и приведите уравнения реакций, лежащих в основе разделения и обнаружения анионов при совместном присутствии Cl-, Br-, J-.
Вариант № 28
1. Оптические свойства золей: опалесценция, эффект Фарадея-Тиндаля, окраска. Оптические свойства бульона, чая, вин, молока.
2. Какую эмульсию будет стабилизировать сажа: эмульсию бензола в воде или воды в бензоле? Объясните и покажите на схеме механизм стабилизации.
3. Cколько воды потребуется прибавить к 200г 25% раствора NH3*H2O, чтобы получить 5% раствор?
Вопросы для подготовки к экзамену заочной формы обучения
1. Предмет аналитическая химия и физико-химические методы анализа. 2. Аналитические реакции и требования к ним. Чувствительность химических реакций: открываемый минимум, предельная концентрация, предельное разбавление, показатель чувствительности. Условия проведения аналитических реакций (температура, рН, концентрации и т.д.). Примеры. 3. Способы выполнения аналитических реакций «сухим» и «мокрым» путем: «порошковый» анализ, реакции: пирохимические, капельные (пробирочные, микрокристаллоскопические, хроматографические, экстракционные, в «газовой камере»), применяемые в анализе катионов и анионов. Примеры. 4. Химические реагенты: общие, групповые и характерные (специфические и селективные). Примеры. Требования к групповым реагентам. 5. Дробный и систематический анализ. Раскрыть на примере анализа катионов I и III аналитических групп. 6. Кислотно-основная классификация катионов, её достоинства и недостатки. Групповые реагенты. 7. Классификации анионов (по И.П. Алимарину и Н.И. Блок; по Н.А. Тананаеву). Групповые и общие реагенты. Особенности анализа анионов. 8. Равновесие в водных растворах комплексных соединений. Константы устойчивости и нестойкости, их значение в качественном анализе. Химико-аналитические свойства комплексных соединений и их применение в качественном анализе для обнаружения, разделения, маскировки, растворения осадков. Разрушение комплексных соединений в целях анализа. Примеры. 9. Окислительно-восстановительные реакции. Стандартный и реальный окислительно-восстановительный потенциалы. Уравнение Нернста. Направление и глубина протекания окислительно-восстановительных реакций. Использование их в качественном анализе для обнаружения, разделения, удаления и маскировки мешающих ионов, растворения осадков. Примеры. 10. Органические реагенты и их использование в качественном анализе катионов и анионов. 11. Общая характеристика катионов I-VI аналитических групп и анионов I-IV аналитических групп (способность вступать в химические реакции различных типов, свойства образуемых ими соединений: солей, гидроксидов, кислот, отношение к общим и групповым реагентам). Реакции обнаружения катионов и анионов, способы их выполнения. Обнаружение карбонат-ионов в присутствии сульфит- и тиосульфат-ионов. Обнаружение хлорид-, бромид- и иодид-ионов при совместном присутствии. Обнаружение иодид- и ацетат-ионов при совместном присутствии. 12. Титриметрический анализ, его сущность. Требования к реакциям, применяемым в различных методах титриметрии. 13. Основной закон титриметрии и его математическое выражение. 14. Инструментальные методы анализа, их особенности и возможности. Использование в качественном и количественном анализе. Примеры. Классификация инструментальных методов анализа (по измеряемому аналитическому сигналу, способу измерения). Достоинства и недостатки. 15. Основные способы определения концентрации веществ в инструментальных методах анализа (по градуировочному графику, метод одного стандарта, метод добавок стандарта). Их сущность, примеры использования. 16. Основные этапы и оптимальные условия фотометрических определений (выбор фотометрической реакции, аналитической длины волны, концентрации вещества и толщины поглощающего слоя, раствора сравнения). Требования к фотометрическим реакциям. Способы определения концентрации веществ в фотометрии на примере определения содержания пара-аминосалицилата натрия в растворе. 17. Коллоидная химия. Предмет и содержание. 18. Классификация дисперсных систем. 19. Строение мицеллы. Получение коллоидных растворов. 20. Свойства коллоидных растворов (оптические, молекулярно-кинетические, электрокинетические). 21. Стабилизация и коагуляция дисперсных систем. 22. Коллоидные поверхностно-активные вещества. Моющее действие мыл. Солюбилизация. 23. Грубодисперсные системы. Эмульсии. Пены. Порошки. Взвеси. Аэрозоли. Их строение, получение и использование в пищевой промышленности.
Литература Основная 1. Горбунцова И.П. Физическая и коллоидная химия.- М.: Альфа, 2008.– 269 с. 2. Гельфман Я.И. Коллоидная химия.- Изд-во: С-Пб-Москва-Краснодар, 2008. – 333 с. 3. Васильев В.П. Аналитическая химия. Т.1,2. - Теоретические основы физико-химических методов анализа. - М.: Дрофа, 2002. – 752 с. Дополнительная 4. Алексеев В.Н. Количественный анализ. - М.: Химия, 1972. – 204 с. 5. Пономарёв В.Д. Аналитическая химия. - М.: Высшая школа, Т.2. Количественный анализ, 1987. – 228 с. 6. Лурье Ю.Ю. Справочник по аналитической химии.- М.: Химия, 1974. 7. Шестакова Г.Е. Титриметрический анализ (Учебное пособие).- Пермь, 2005. 8. Шестакова Г.Е. Анализ коллоидных систем (Учебно-методическое пособие).- МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ ПЕРМСКИЙ ИНСТИТУТ (ФИЛИАЛ) федерального государственного бюджетного образовательного учреждения высшего профессионального образования РОССИЙСКИЙ ЭКОНОМИЧЕСКИЙ УНИВЕРСИТЕТ ИМЕНИ Г.В. ПЛЕХАНОВА
Факультет Коммерции Кафедра Технологии и организации питания и услуг
Контрольная работа по дисциплине: «Физико-химические методы исследования» Вариант № ___
Выполнил(а) студент(ка) _____ курса, группы _____ Направление: 100800 – Товароведение ________________________________________ (фамилия, имя, отчество студента) «____» ___________________20_ г.
Пермь, 20 г.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 295; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.102 (0.011 с.) |

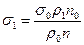 ;
; 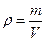
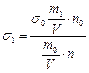 ;
;
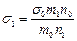
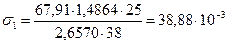 н/м
н/м
 (раз)
(раз)
 =?
=? раза
раза


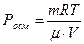


 г/моль
m = 100 г
А = 1000 г
ккр = 1,86 о
г/моль
m = 100 г
А = 1000 г
ккр = 1,86 о







 [(mBaSO4) ∙ nBa2+ ∙ 2(n–x) Cl–]2x+ ∙ 2xCl–
[(mBaSO4) ∙ nBa2+ ∙ 2(n–x) Cl–]2x+ ∙ 2xCl–



 гранула
гранула


