
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Доктор медицинских наук, профессор С.Н. СимоновСодержание книги
Поиск на нашем сайте
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ ТАМБОВСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ИМЕНИ Г.Р. ДЕРЖАВИНА
А.В. Гулин С.Е. Синютина А.Г. Шубина
БИОХИМИЯ (часть 1)
Допущено Редакционно-издательским советом ТГУ имени Г.Р. Державина в качестве учебного пособия для студентов, обучающихся по специальностям 060101.65 – Лечебное дело 060103.65 – Педиатрия 060105.65 – Стоматология
Тамбов 2014
Рецензенты: Доктор медицинских наук, профессор С.Н. Симонов Доктор биологических наук, профессор Е.В. Малышева
СОдержАНИЕ
ПРЕДМЕТ БИОХИМИИ
Биохимия – наука, изучающая химические основы процессов жизнедеятельности, химические компоненты живых клеток, а также реакции и процессы, протекающие с их участием. Предметом медицинской биохимии являются химические процессы, происходящие в организме человека в норме и при патологии.
Основная цель биохимии – 1.изучение молекулярных основ физиологических функций человека в норме с учетом онтогенеза, 2.молекулярных механизмов развития патологических процессов, 3.предупреждения и лечения болезней, 4. биохимических методов диагностики болезней и контроля состояния здоровья человека.
Ряд выдающихся открытий в биохимии и в некоторых ее разделах –молекулярной биологии, энзимологии, биоэнергетике, биохимической генетике и др., - выдвинули ее в раздел фундаментальных научных дисциплин, сделав орудием решения важных биологическх и медицинских проблем. ХИМИЯ БЕЛКОВ Белки - высокомолекулярные азотсодержащие органические вещества, молекулы которых построены из остатков аминокислот, соединенных пептидными связями. Используют также термин «протеины» (от греч. рrotos – первый). Белки получили свое название, когда в тканях животных и растений были обнаружены вещества, схожие с белком куриного яйца. Белки являются основой структуры и функций живых организмов. Природные белки построены из 20 различных аминокислот. Эти аминокислоты чередуются в разнличной последовательности, поэтому способны образовывать порядка 1018 разнообразных белков. Белки обеспечивают существование сотен тысяч видов живых организмов - от простейших вирусов до человека. Каждый организм характеризуется уникальным набором белков.
Содержание белков в тканях даже одного организма различается. Так, содержание белков в организме человека в % сухой массы: в мышцах – 80, в мозге – 45, в костях – 20. Элементный состав белков в пересчете на сухое вещество, %: С - 50-54; Н - 6,5-7,3; О - 21-23; N - 15-17; S - до 0,5. Некоторые белки содержат небольшие количества фосфора, железоа, марганеца, магния, йода и др. Содержание азота в белках относительно постоянно - около 16%, поэтому по белковому азоту можно определять количество белка в биологических объектах.
ФУНКЦИИ БЕЛКОВ Структурная функция. В комплексе с липидами белки участвуют в образовании биомембран клеток. Структурные белки цитоскелета придают форму клеткам и многим органоидам. Примерами структурных белков являются коллаген в соединительной ткани, кератин в волосах, коже, ногтях. Сократительная (двигательная) функция. Сократительную функцию выполняют мышечные белки (актин и миозин). Белки цитоскелета необходимы для расхождения хромосом в процессе митоза. Питательная (резервная) функция. Овальбумины(белки яйца) - источники питания для плода. Казеин - белок молока - также выполняет питательную функцию. Каталитическая функция. Большинство известных в настоящее время ферментов (биологических катализаторов) является белками. Транспортная функция. Белок эритроцитов гемоглобин участвует в переносе кислорода и углекислого газа, выполняя дыхательную функцию. Альбумины сыворотки крови участвуют в транспорте липидов. Защитная функция. В ответ на поступление в организм вирусов, бактерий, чужеродных белков, токсинов образуются защитные белки - антитела (иммунная защита). Специфические белки плазмы крови способны к свертыванию, что предохраняет от кровопотери при кровотечениях (физическая защита). Рецепторная функция. Клеточные белки образуют специфические рецепторы и участвуют в передаче гормонального сигнала. Гормональная функция. Группа гормонов являются белками или полипептидами, например, гормон гипофиза вазопрессин. Другие важные функции белков - буферные свойства (обеспечение физиологического значенияе рН внутренней среды), поддержаниеь онкотического давлениея в клетках и крови, и др. КЛАССИФИКАЦИЯ БЕЛКОВ Согласно функциональному принципу различают 12 главных классов белков: 1) каталитически активные (ферменты); 2) гормоны; 3) регуляторы активности генома; 4) защитные (антитела, белки свертывающей и противосвертывающей систем крови); 5) ингибиторы ферментов; 6) транспортные; 7) мембранные; 8) сократительные; 9) рецепторные; 10) токсические; 11) белки вирусной оболочки; 12) белки с прочими функциями. Различают a-, β-, a+β- и a/β-белки: - a-белки содержат a-спирали (более 60%); - β-белки имеют β-структуру (не менее двух антипараллельных цепей); - a+β–белки включают те и другие структуры в одной полипептидной цепи; - a/β-белки состоят из a- и β-структур, которые чередуются вдоль домена или полипептидной цепи. По химическому составу белки делят на 2 группы. Простые белки состоят только из остатков аминокислот. При гидролизе образуют только свободные аминокислоты. Сложные белки двухкомпонентны: состоят из простого белка и небелковой части (простетической группы). ПРОСТЫЕ БЕЛКИ Альбумины и глобулины. Альбумины – белки, широко представленные в составе тканей животных и растений. Содержатся в сыворотке крови, белке яиц, молоке, в семенах растений. Хорошо растворимы в воде, солевых растворах, кислотах и щелочах. На альбумины приходится около 75-80% осмотического давления белков сыворотки крови. Функцией альбуминов крови является также транспорт жирных кислот.
Глобулины - группа животных и растительных белков, широко распространённых в природе. Относятся к глобулярным белкам. Растворимы в слабых растворах нейтральных солей, разбавленных кислотах и щелочах. a-Фракция глобулинов содержится в крови в комплексе с билирубином и с липопротеинами высокой плотности. Представителем фракции β-глобулинов является протромбин -предшественник тромбина, участвующего в свертывании крови. Фракция g-глобулинов наиболее гетерогенная. Важнейшие g-глобулины - иммуноглобулины. Содержание альбуминов и глобулинов в плазме крови человека около 7%. Белковй коэффициент - отношение альбумин/глобулин - имеет диагностическое значение. В норме он близко к 2, а при ряде заболеваний может изменяться, например, уменьшается при воспалительных заболеваниях. Протамины и гистоны. Протамины – низкомолекулярные белки, содержащие 60-85% аргинина и обладающие основными свойствами. Хорошо растворяются в воде, кислой и нейтральной среде и осаждаются в щелочных средах. Обнаружены в ядрах сперматозоидов у рыб и птиц. В ядрах клеток находятся в комплексе с ДНК. Гистоны - белки основного характера с небольшой молекулярной масой. В их состав входят лизин и аргинин, содержание которых не превышает Проламины и глютелины. Проламины - белки растительного происхождения. Содержат 20-25% глутаминовой кислоты и 10-15% пролина. Растворимы в 60-80% водном растворе этанола (тогда как все прочие простые белки в этих условиях обычно осаждаются). Глютелины - простые белки, содержатся в зеленых частях растений, в семенах злаков. Характеризуются высоким содержанием глутаминовой кислоты и наличием лизина. Растворимы в разбавленных растворах щелочей. Глютелины являются запасными белками.
СЛОЖНЫЕ БЕЛКИ 1. Хромопротеины (от греч. chroma - краска) сложные белки, состоящие из простого белка и связанного с ним небелкового окрашенного компонента. Различают гемопротеины и флавопротеины. Хромопротеины участвуют в процессе дыхания, окислительно-восстановительных реакциях, транспорте кислорода и диоксида углерода, свето- и цветовосприятии и др.
К группе гемопротеинов относятся гемоглобин, цитохромы, миоглобин, каталаза, пероксидаза. Все гемопротеины содержат железопорфирины, но различаютсяе по составу и структуре белковой части, и выполняют различные биологические функции. Так, различия гемоглобина различных биологических видов обусловлены различиами в структуре глобина. Рассмотрим строение гемоглобина – белка крови. Небелковым компонентом гемоглобина является гем - пигмент, придающий крови красный цвет. Основу его структуры составляет протопорфирин IX (рис. 6). В центре гема расположен ион железа в степени окисления +2, связанный с двумя атомами азота ковалентными связами и с двумя другими атомами азота - координационными связями. Вокруг гемма «обернута» полипептидная цепь. Железо в гемоглобине соединяется с атомом азота имидазольной группы гистидина молекулы белка пятой координационной связью. Шестая координационная связь железа используется для присоединения кислорода или других лигандов (рис. 7).
Гемоглобин взрослого человека НbА (от англ. аdult - взрослый) имеет четыре полипептидные цепи, составляющие глобин (рис. 8) - белковую часть молекулы. Две α-цепи содержат по 141 аминокислотному остатку, две β-цепи - по 146.
В крови взрослого человека присутствуют также гемоглобин НbА2 (2α-, 2δ-цепи, 2,5%) и НbA3 (менее 1%, отличается строением b-цепи). Фетальный гемоглобин (гемоглобин плода и новорожденных) HbF состоит из 2α- и 2γ-цепей. Гемоглобин F обладает повышенным сродством к кислороду и позволяет сравнительно малому объему крови плода выполнять функцию снабжения кислородом более эффективно. Кровь новорожденного содержит до 80% HbF, к концу 1-го года жизни фетальный гемоглобин почти полностью заменяется на НbА. Гемоглобинозы – болезни гемоглобинов. 1. Гемоглобинопатии. В их основе лежит наследственное изменение структуры какой-либо цепи нормального гемоглобина. В крови человека открыто около 150 различных типов аномальных гемоглобинов. Ониразличаются по физико-химическим свойствам (растворимость, электрофоретическая подвижность, изоэлектрическая точка, способность связывать кислород). Пример гемоглобинопатии - серповидно-клеточная анемия. Заболевание распространено в странах Южной Африки, Южной Америки и Юго-Восточной Азии. Химический дефект - замена глутаминовой кислоты в 6-м положении с N-конца на валин в β-цепях молекулы гемоглобина, что является результатом мутации в молекуле ДНК. У HbS снижены растворимость и сродство к кислороду. Эритроциты в условиях низкого парциального давления кислорода пимеют форму серпа. Отдавая кислорода в тканях, HbS превращается в плохо растворимую дезоксиформу и выпадает в осадок в виде тактоидов (веретенообразных кристаллов). Тактоиды деформируют клетку и приводят к гемолизу. Гетерозиготная форма заболевания протекает бессимптомно либо сопровождается легкой гемолитической анемией. У гомозиготных особей тяжелая форма серповидноклеточной анемии развивается с первых месяцев жизни. Болезнь протекает остро, и дети часто умирают в раннем возрасте.
Примерами аномальных гемоглобинов являются также гемоглобин С (в b-цепи на 6 месте вместо глутаминовой кислоты находится лизин) и гемоглобин D (в b-цепи на 28 месте вместо глутаминовой кислоты находится лейцин). Данные мутации обнаружены в основном в Африке. 2. Талассемии - группа заболеваний с наследственным нарушением синтеза одной из цепей глобина. Различают α-талассемии, когда не происходит синтез α-цепи, и β-талассемии (не синтезируются β-цепи). Гемоглобинопатия Н (один из вариантов a-талассемии) характеризуется гемолитической анемией, выпадением в осадок гемоглобина Н, спленомегалией, тяжелыми изменениями костей. 3. Железодефицитные анемии – заболевания, возникающие при нарушение синтеза гемоглобина вследствие дефицита железа. Основными причинами железодефицитных анемий являются кровопотери, а также недостаток богатой железом пищи - мяса и рыбы. Производные гемоглобина Оксигемоглобин HbO2. Молекулярный кислород присоединяется к каждому гему Hb при помощи координационных связей железа. Присоединение каждой молекулы кислорода облегчает присоединение последующей. Эта аллостерическая зависимость получила название эффекта Бора. Оксигемоглобин, попадая в ткани, теряет кислород, превращаясь в дезоксигемоглобин. Карбгемоглобин HbCO2 - соединение гемоглобина с углекислым газом. Он нестоек и быстро диссоциирует в легочных капиллярах с отщеплением СО2. Карбоксигемоглобин HbCO - продукт присоединения оксида углерода CO (угарного газа) к гемоглобину. Гемоглобин имеет высокое сродство к СО и прочно с ним связывается, теряя способность к транспорту кислорода, что приводит к смерти от удушья. Метгемоглобин MtHb -форма гемоглобина, в которой железо гема находится в трехвалентном состоянии.Не способен переносить кислород. Образуется из свободного гемоглобина под действием различных окислителей, а в организме - при отравлениях нитробензолом, оксидами азота. Метгемоглобинемия - появление в крови метгемоглобина. Выделяют наследственные и приобретенные метгемоглобинемии. Наследственные развиваются в результате наличия нестабильных или аномальных гемоглобинов. Приобретенные метгемоглобинемии могут быть экзогенного токсического происхождения, возникающие при воздействии ряда химических веществ окружающей среды, и эндогенного происхождения, развивающиеся вследствие нарушения образования и всасывания нитратов при энтероколитах. При значительной метгемоглобинемии развивается кислородное голодание (гипоксия). Качественное определение производных гемоглобина проводится путем исследования их спектров поглощения. Миоглобин - глобулярный белок, функцией которого является запасание молекулярного кислорода в мышцах и передача его системам оксиления клеток. Состоит из одной полипептидной цепи. Активным центром, связывающим O2, как и в гемоглобине, является гем. Миоглобин определяет цвет мышц. К хромопротеинам относятся также ферменты каталаза и пероксидаза, входящие в антиоксидантную систему организма, и цитохромы, участвующие в окислительно-восстановительных реакциях и служащие переносчиками электронов. Флавопротеины – хромопротеины, простетические группы которых представлены производными витамина В2 - флавинмононуклеотидом (ФМН) и флавинадениндинуклеотидом (ФАД). Флавопротеины являются кофакторами оксидоредуктаз. 2. Липопротеины состоят из белка и простетической группы, представленной липидом (фосфолипиды, нейтральные жиры, производные холестерина, жирные кислоты). В образовании липопротеинов участвуют нековалентные связи различной природы, например, гидрофобные или ионные (если в состав входит фосфолипид). Липопротеины широко распространены и выполняют разнообразные биологические функции (белок ткани легких, липовителлин желтка куриного яйца и т.д.). Липопротеины существуют в свободном состоянии в плазме крови. Липопротеины сыворотки крови содержат гидрофобное липидное ядро, окруженное полярными липидами и оболочкой из белков, получивших название апобелки. Их функция - транспорт липидов, нерастворимых в воде. Липиды, ковалентно связанные с белком, выполняют функцию прикрепления белков к мембране клетки. Это структурированные липопротеины (липиды мембран клетки, миелиновой оболочки нервных волокон). 3. Фосфопротеины - сложные белки, в состав которых в качестве небелкового компонента входит фосфорная кислота, присоединенная к полипептидной цепи сложноэфирной связью через остатки серина или треонина. Возможен также ионный тип связи.
Представителями фосфопротеинов являются казеиноген молока, овальбумин белка куриного яйца, ряд ферментов (РНК-полимеразы). Фосфопротеины широко представлены в клетках ЦНС. Фосфопротеины являются ценным источником энергетического и пластического материала в процессе эмбриогенеза и постнатального роста и развития организма, участвуют в регуляции активности ядра клетки, в окислительных процессах в митохондриях, в транспорте ионов. 4. Гликопротеины -сложные белки, содержащие, помимо полипептидной цепи, линейные или разветвленные гетероолигосахаридные цепи из 2 - 15 остатков гексоз либо пентоз и конечный углевод
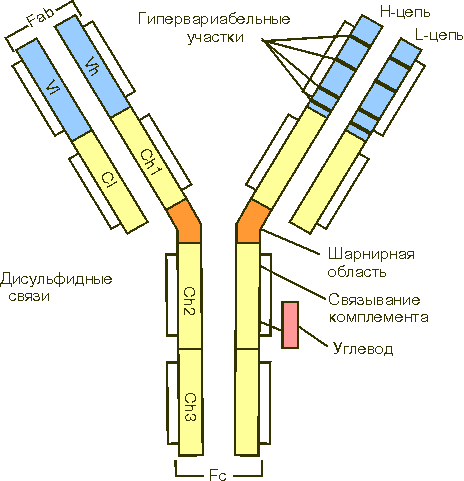
Представителями гликопротеинов являются белки плазмы крови (кроме альбуминов), муцин слюны, некоторые ферменты, белки хрящевой и костной тканей. Гликопротеины являются важным структурным компонентом клеточных мембран. Они обеспечивают клеточную адгезию, молекулярное и клеточное узнавание. Углеводные компоненты не только выполняют информативную функцию. Они повышают стабильность молекул гликопротеинов к различным химическим и физическим воздействиям, а также защищают их от действия протеиназ. Гликопротеины мембран эритроцитов определяют группу крови у человека. Типичными представителями гликопротеинов являются интерфероны, иммуноглобулины. Интерфероны – белки-ингибиторы размножения многих типов вирусов. Они образуются в клетке в ответ на внедрение вирусной нуклеиновой кислоты. Интерфероны являются также защитными белками при опухолевых поражениях. Иммуноглобулины, или антитела, выполняют защитную функцию, обезвреживая поступающие в организм чужеродные вещества – антигены - любой химической природы. Выделяют три основных класса иммуноглобулинов: IgG, IgA, IgM; минорные классы иммуноглобулинов плазмы человека обозначаются как IgD и IgE. Иммуноглобулины разных классов отличаются по молекулярной массе, по концентрации в крови, по биологическим свойствам. Структура иммуноглобулина G приведена на рис. 9. Он состоит из двух идентичных легких L-цепей (от англ. light) и двух идентичных тяжелых
Рис. 9. Структура иммуноглобулина Ряд заболеваний (например, ревматоидные артриты) сопровождается синтезом аномальных антител с аномально короткими суглеводными цепями, что вызывает стимуляцию иммунной системы против самого организма. Протеогликаны - комплексы белка и гликозаминогликанов. Углевод в этих соединениях составляет основную часть молекулы (до 95%). Типичными представителями гликозаминогликанов являются гиалуроновая кислота (ее основная функция - связывание воды в соединительной ткани) и гепарин, участвующий в регуляции свертывания крови. 5. Металлопротеины – белки, помимо полипептидной цепи содержащие ионы одного или нескольких металлов. Белки, содержащие негемовое железо: - ферритин (около 20% железа) сосредоточен главным образом в селезенке, печени, костном мозге. Выполняет роль депо железа в организме; - трансферрин сыворотки крови (около 0,13% железа) транспортирует ионы железа в ретикулоциты, в которых осуществляется биосинтез гемоглобина. Металлоферменты - белки, обладающие ферментативной активностью и содержащие катионы металлов. Алкогольдегидрогеназа содержит ионы Zn, АТФ-аза - ионы Na, K, Са, Мg, цитохромоксидаза – Cu, протеиназы - Mg, K. 6. Нуклеопротеины (НП) – сложные белки, небелковым компонентом которых являются нуклеиновые кислоты. Нуклеиновые кислоты (НК) - ДНК и РНК–полимеры нуклеотидов. ДНК находится в основном в ядре клетки, а также в митохондриях. РНК присутствует во всех частях клетки. Различают мРНК (определяет порядок аминокислот в молекуле белка), рРНК (входит в состав рибосом), тРНК (транспортирует аминокислоты к месту синтеза белка), мяРНК (выполняет каталитические функции). НК обеспечивают хранение и передачу наследственной информации путем программирования синтеза клеточных белков. В состав нуклеиновых кислот входят азотистые основания (ДНК - аденин, гуанин, цитозин, тимин, РНК - аденин, гуанин, цитозин, урацил), углеводы (дезоксирибоза и рибоза соответственно), остатки фосфорной кислоты. Нуклеотиды (рис. 10) состоят из пиримидинового или пуринового основания, пентозы (рибозы) и фосфорной кислоты. Нуклеотиды – нуклеозидфосфаты.
ДНК, выделенная из различных тканей одного и того же вида, имеет одинаковый состав азотистых оснований. Закономерности состава и количественного содержания азотистых оснований были впервые установлены Э. Чаргаффом Правила Чаргаффа: 1. Молярная доля пуриновых оснований равна молярной доле пиримидиновых оснований: А + Г = Ц + Т. 2. Количество аденина и цитозина равно количеству гуанина и тимина: А + Ц = Г + Т. 3. Количество аденина равно количеству тимина, количество гуанина равно количеству цитозина: А = Т, Г = Ц. 4. Коэффициент специфичности равен (Г + Ц)/(А + Т) (у животных ФЕРМЕНТЫ Ферменты или энзимы - вещества преимущественно белковой природы, обладающие каталитической активностью. Первоначально считали, что все ферменты являются белками. В начале 80-х годов XX в. были открыты низкомолекулярные рибонуклеиновые кислоты (рибозимы), спопобные выполнять каталитическую функцию. Термин «энзим» происходит от греч. en zyme - в дрожжах, «фермент» - от лат. fermentatio - брожение. Энзимология – наука о ферментах. В настоящее время возможен лабораторный синтез некоторых ферментов (рибонуклеазы, лизоцима). Однако единственным практическим способом получения ферментов является их извлечение из биологических объектов. Для выделения ферментов из клеток необходимо тонкое измельчение такней, вплоть до разрушения субклеточных структур. Все операции проводят в условиях, исключающих денатурацию белка (использование защитных добавок, низкая температура). Содержание ферментов в различных субклеточных структурах неодинаково, так, например, ферменты гликолиза сосредоточены преимущественно в цитоплазме, ферменты цикла Кребса - в митохондриях.
МЕХАНИЗМ ДЕЙСТВИЯ ФЕРМЕНТОВ Фермент Е обратимо соединяется с субстратом S, образуя нестойкий промежуточный фермент-субстратный комплекс ES, который в конце реакции распадается с освобождением фермента и продуктов реакции Р:
Подобные представления о взаимодействии фермента и субстрата легли в основу теории «ключ-замок» Э. Фишера (1890). Структура активного центра комплементарна молекулярной структуре субстрата, что обеспечивает высокую специфичность фермента (рис. 16а). В образовании фермент-субстратных комплексов участвуют электростатические и гидрофобные взаимодействия, водородные связи, а также ковалентные либо координационные связи.
Рис. 16. Теории ферментативного катализа Д. Кошлендом была разработана теория «индуцированного соответствия» (1958). Согласно данной теории, пространственное соответствие структуры активного центра фермента и субстрата возникает в момент их взаимодействия друг с другом. Это было образно охарактеризовано формулой «перчатка - рука». Субстрат индуцирует конформационные изменения активного центра фермента таким образом, что он принимает пространственную ориентацию, необходимую для связывания субстрата (рис. 16б). Т.е. фермент только в момент присоединения субстрата будет находиться в активной (напряженной) Т-форме (tensile) в отличие от неактивной R-формы (relaxe). В настоящее время все более популярной становится гипотеза топохимического соответствия. Сохраняя основные положения теории «индуцированного соответствия», она объясняет специфичность действия ферментов узнаванием той части субстрата, которая не изменяется при катализе. В момент присоединения субстрата к активному центру фермента последний индуцирует переход субстрата в напряженное состояние (рис. 17).
Рис. 17. Гипотеза топохимического соответствия
Ферменты ускоряют химические реакции за счет снижения энергии активации (рис. 18). Энергия активации - энергия, необходимая для перевода всех молекул 1 моль вещества в активированное состояние при данной температуре. Химическая реакция, как катализируемая ферментом, так и им не катализируемая, имеет одинаковую величину стандартного изменения свободной энергии (ΔG). Однако энергия активации ферментативной реакции ниже. Увеличивая скорость реакции, ферменты, однавко, не изменяют положения равновесия между прямой и обратной реакциями, а лишь ускоряют его достижение.
Рис. 18. Энергетическая диаграмма ферментативной реакции СВОЙСТВА ФЕРМЕНТОВ Ферменты отличаются от обычных катализаторов рядом свойств. Термолабильность, или чувствительность к повышению температуры (рис. 22).
Рис. 22. Зависимость скорости ферментативной реакции от температуры При температуре, не превышающей 45–50 °С, скорость большинства биохимических реакций повышается в 2 раза при повышении температуры на 10 °С согласно правилу Вант-Гоффа. При температуре выше 50 °С на скорость реакции влияниет тепловая денатурация белка-фермента, постепенно приводящая к его полной дезактивации. Температура, при которой каталитическая активность фермента максимальна, называется его температурным оптимумом. Температурный оптимум для большинства ферментов млекопитающих находится в пределах 37-40 °С. При низких температурах (0 °С и ниже) ферменты, как правило, не разрушаются, хотя активность их снижается практически до нуля. Зависимость активности фермента от значения рН среды (рис. 23). Для каждого фермента существует оптимальное значение рН среды, при котором он проявляет максимальную активность. рН-оптимум действия ферментов животных тканей лежит в пределах узкой зоны концентрации водородных ионов, соответствующей выработанным в процессе эволюции физиологическим значениям рН среды 6,0-8,0. Исключения составляют пепсин – 1,5-2,5; аргиназа – 9,5-10.
Влияние изменений рН среды на молекулу фермента заключается в воздействии на степень ионизации его активных групп, а, следовательно, на третичную структуру белка и состояние активного центра. рН меняет также ионизацию кофакторов, субстратов, фермент-субстратных комплексов и продуктов реакции. Специфичность. Высокая специфичность действия ферментов обусловлена конформационной и электростатической комплементарностью между молекулами субстрата и фермента и уникальной структурной организацией активного центра, обеспечивающими избирательность протекания реакции. Абсолютная специфичность – способностьфермента катализировать единственную реакцию. Например, уреаза катализирует реакцию гидролиза мочевины до NH3 и СО2, аргиназа – гидролиз аргинина. Относительная (групповая) специфичность – способность фермента катализировать группу реакций определенного типа. Относительной специфичностью, например, обладают гидролитические ферменты пептидазы, гидролизующие пептидные связи в молекулах белков и пептидов, липаза, гидролизующая сложноэфирные связи в молекулах жиров. Стереохимической специфичностью обладают ферменты, катализирующие превращения только одного из пространственных изомеров. Фермент фумараза катализирует превращение транс-изомера бутендиовой кислоты - фумаровой кислоты в яблочную, и не действует на цис-изомер - малеиновую кислоту. Высокая специфичность действия ферментов обеспечивает протекание лишь определенных химических реакций из всех возможных превращений. Аллостерическая регуляция. Во многих случаях главным типом регуляции скорости многостадийного ферментативного процесса является ингибирование по принципу обратной связи. Конечный продукт подавляет активность фермента, катализирующего первую стадию синтеза, которая является ключевой для данной цепи реакции. Он связывается с аллостерическим центром молекулы фермента. Это ингибирование по принципу обратной связи, или ретроингибирование. ФЕРМЕНТЫ В МЕДИЦИНЕ Ферменты применяют как лечебные препараты (таблица 2): - при их отсутствии или недостатке (наследственном или приобретенном); - для специфического разрушения некоторых продуктов обмена.
Таблица 2. Использование ферментов как лечебных препаратов
Ферменты используют в клинике в качестве аналитических реактивов (таблица 3). Для анализа часто применяются иммобилизованные ферменты, которые искусственно связаны с нерастворимым в воде носителем, что облегчает использование и повышает стабильность ферментов. Таблица 3. Использование ферментов как аналитических реагентов
Анализ кинетики появления и исчезновения ферментов в сыворотке крови используется в диагностике. Состав ферментов и их распределение в тканях у взрослого человека в норме в основном постоянны, и могут изменяться при болезнях. Почти все ферменты организма функционируют внутриклеточно. При повреждении тканей внутриклеточные ферменты появляются в сыворотке крови. При воспалительных процессах повышается проницаемость клеточных мембран и в сыворотку крови попадают цитоплазматические ферменты. Некроз ткани сопровождается разрушением всех клеточных структур, и в сыворотке могут быть обнаружены митохондриальные, ядерные и другие ферменты. Такие ферменты называют индикаторными. Появление в плазме или сыворотке крови ряда тканевых ферментов в повышенных количеств
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-07-14; просмотров: 280; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.42.247 (0.025 с.) |




 Рис. 8. Гемоглобин
Рис. 8. Гемоглобин





 б. Теория «индуцированного соответствия»
б. Теория «индуцированного соответствия»







