Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Глава 30. Сложные эфиры. ЖирыСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Номенклатура и изомерия Среди функциональных производных карбоновых кислот особое место занимают сложные эфиры – соединения, представляющие карбоновые кислоты, у которых атом водорода в карбоксильной группе заменен углеводородным радикалом. Общая формула сложных эфиров
Молекула сложного эфира состоит из остатка кислоты (1) и остатка спирта (2). Названия сложных эфиров производят от названия углеводородного радикала и названия кислоты, в котором вместо окончания «-овая кислота» используют суффикс «ат», например:
Часто сложные эфиры называют по тем остаткам кислот и спиртов, из которых они состоят. Так, рассмотренные выше сложные эфиры могут быть названы: уксусноэтиловый эфир, кротоновометиловый эфир. Для сложных эфиров характерны три вида изомерии: 1. Изомерия углеродной цепи, начинается по кислотному остатку с бутановой кислоты, по спиртовому остатку – с пропилового спирта, например:
2. Изомерия положения сложноэфирной группировки – СО–О–. Этот вид изомерии начинается сосложных эфиров, в молекулах которых содержится не менее 4 атомов углерода, например:
3. Межклассовая изомерия, например:
Для сложных эфиров, содержащих непредельную кислоту или непредельный спирт, возможны еще два вида изомерии: изомерия положения кратной связи и цис-транс- изомерия. Физические свойства Сложные эфиры низших карбоновых кислот и спиртов представляют собой летучие, малорастворимые или практически нерастворимые в воде жидкости. Многие из них имеют приятный запах. Так, например, HCOOC2H5 – запах рома, HCOOC5H11 – вишни, HCOOC5H11-изо – сливы, СН3СООС5Н11-изо – груши, С3Н7СООС2Н5 – абрикоса, С3Н7СООС4Н9 – ананаса, С4Н9СООС5Н11 – яблок и т.д Сложные эфиры имеют, как правило, более низкую температуру кипения, чем соответствующие им кислоты. Например, стеариновая кислота кипит при 232 °С, а метилстеарат – при 215°С. Объясняется это тем, что между молекулами сложных эфиров отсутствуют водородные связи. Сложные эфиры высших жирных кислот и спиртов – воскообразные вещества, не имеют запаха, в воде не растворимы, хорошо растворимы в органических растворителях. Например, пчелиный воск представляет собой в основном мирицилпальмитат (С15Н31COOC31Н63) Химические свойства 1. Реакция гидролиза или омыления. Реакция этерификации является обратимой, поэтому в присутствии кислот будет протекать обратная реакция, называемая гидролизом, в результате которой образуются исходные жирные кислоты и спирт:
Реакция гидролиза ускоряется под действием щелочей; в этом случае гидролиз необратим:
так как получающаяся карбоновая кислота со щелочью образует соль:
2. Реакция присоединения. Сложные эфиры, имеющие в своем составе непредельную кислоту или спирт, способны к реакциям присоединения. Например, при каталитическом гидрировании они присоединяют водород. 3. Реакция восстановления. Восстановление сложных эфиров водородом приводит к образованию двух спиртов:
4. Реакция образования амидов. Под действием аммиака сложные эфиры превращаются в амиды кислот и спирты:
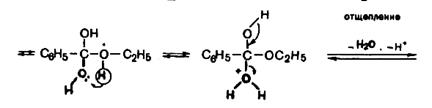
Механизм протекания реакции этерификации. Рассмотрим в качестве примера получение этилового эфира бензойной кислоты:
Каталитическое действие серной кислоты состоит в том, что она активирует молекулу карбоновой кислоты. Бензойная кислота протонируется по атому кислорода карбонильной группы (атом кислорода имеет неподеленную пару электронов, за счет которой присоединяется протон). Протонирование приводит к превращению частичного положительного заряда на атоме углерода карбоксильной группы в полный, к увеличению его электрофильности. Резонансные структуры (в квадратных скобках) показывают делокализацию положительного заряда в образовавшемся катионе. Молекула спирта за счет своей неподеленной пары электронов присоединяется к активированной молекуле кислоты. Протон от остатка спирта перемещается к гидроксильной группе, которая при этом превращается в «хорошо уходящую» группу Н2О. После этого отщепляется
Этерификация – обратимый процесс. Прямая реакция – образование сложного эфира, обратная – его кислотный гидролиз. Для того чтобы сдвинуть равновесие вправо, необходимо удалять из реакционной смеси воду. Жиры и масла
Среди сложных эфиров особое место занимают природные эфиры – жиры и масла, которые образованы трехатомным спиртом глицерином и высшими жирными кислотами с неразветвленной углеродной цепью, содержащими четное число углеродных атомов. Жиры входят в состав растительных и животных организмов и играют важную биологическую роль. Они служат одним из источников энергии живых организмов, которая выделяется при окислении жиров. Общая формула жиров:
где R', R'', R''' - углеводородные радикалы. Жиры бывают «простыми» и «смешанными». В состав простых жиров входят остатки одинаковых кислот (т.е. R' = R'' = R'''), в состав смешанных – различных. В жирах наиболее часто встречаются следующие жирные кислоты: Алкановые кислоты Масляная кислота СН3–(СН2)2–СООН Капроновая кислота СН3–(СН2)4–СООН Каприловая кислота СН3–(СН2)6–СООН Каприновая кислота СН3–(СН2)8–СООН Лауриновая кислота СН3–(СН2)10–СООН Миристиновая кислота СН3–(СН2)12–СООН Пальмитинования кислота СН3–(СН2)14–СООН Стеариновая кислота СН3–(СН2)16–СООН Арахиновая кислота СН3–(СН2)18–СООН Алкеновые кислоты Олеиновая кислота Алкадиеновые кислоты Линолевая кислота Алкатриеновые кислоты Линоленовая кислота Природные жиры представляют собой смесь простых и смешанных эфиров. По агрегатному состоянию при комнатной температуре жиры делятся на жидкие и твердые. Агрегатное состояние жиров определяется природой жирных кислот. Твердые жиры, как правило, образованы предельными кислотами, жидкие жиры (их часто называют маслами)– непредельными. Температура плавления жира тем выше, чем больше в нем содержание предельных кислот. Она также зависит от длины углеводородной цепи жирной кислоты; температура плавления растет с ростом длины углеводородного радикала. В состав животных жиров преимущественно входят насыщенные кислоты, в состав растительных – ненасыщенные. Поэтому животные жиры, как правило, твердые вещества, а растительные – чаще всего жидкие (растительные масла). Жиры растворимы в неполярных органических растворителях (углеводороды, их галогенпроизводные, диэтиловый эфир) и нерастворимы в воде. 1. Гидролиз, или омыление жиров происходит под действием воды (обратимо) или щелочей (необратимо):
При щелочном гидролизе образуются соли высших жирных кислот, называемые мылами. 2. Гидрогенизацией жиров называют процесс присоединения водорода к остаткам непредельных кислот, входящих в состав жиров. При этом остатки непредельных кислот переходят в остатки предельных кислот, и жиры из жидких превращаются в твердые:
3. Жидкие жиры (масла, содержащие олеиновую, линолевую и линоленовую кислоты), взаимодействуя с кислородом воздуха, способны образовывать твердые пленки – «сшитые полимеры». Такие масла называют «высыхающими». Они служат основой для натуральной олифы и красок. 4. При длительном хранении под действием влаги, кислорода воздуха, света и тепла жиры приобретают неприятный запах и вкус. Этот процесс называется «прогорканием». Неприятные запах и вкус обусловлены появлением в жирах продуктов их превращения: свободных жирных кислот, гидроксикислот, альдегидов и кетонов. Жиры играют важную роль в жизни человека и животных. Они являются одним из основных источников энергии для живых организмов. Жиры широко используются в пищевой, косметической и фармацевтической промышленности.
Глава 31. УГЛЕВОДЫ (САХАРА) Углеводы – это природные органические соединения, имеющие общую формулу Сm(Н2О)n (т, п > 3). Углеводы подразделяют на три большие группы: моносахариды, олигосахариды и полисахариды. Моносахаридами называют такие углеводы, которые не могут гидролизоваться с образованием более простых углеводов. Олигосахариды – это продукты конденсации небольшого числа моносахаридов, например сахароза – С12Н22О11. Полисахариды (крахмал, целлюлоза) образованы большим числом молекул моносахаридов. Моносахариды Номенклатура и изомерия Простейший моносахарид – глицериновый альдегид, С3Н6О3:
Остальные моносахариды по числу атомов углерода подразделяют на тетрозы (С4Н8О4), пентозы (С5Н10O5) и гексозы (С6Н12О6). Важнейшие гексозы – глюкоза и фруктоза.Все моносахариды представляют собой бифункциональные соединения, в состав которых входят неразветвленный углеродный скелет, несколько гидроксильных групп и одна карбонильная группа. Моносахариды с альдегидной группой называют альдозами а с кетогруппой – кетозами. Ниже приведены структурные формулы важнейших моносахаридов:
Все эти вещества содержат три или четыре асимметрических атома углерода, поэтому они проявляют оптическую активность и могут существовать в виде оптических изомеров. Знак в скобках в названии углевода обозначает направление вращения плоскости поляризации света: (–) обозначает левое вращение, (+) – правое вращение. Буква D перед знаком вращения означает, что во всех этих веществах асимметрический атом углерода, наиболее удаленный от карбонильной группы, имеет такую же конфигурацию (т.е. направление связей с заместителями), что и глицериновый альдегид, структура которого приведена выше. Углеводы с противоположной конфигурацией относятся к L-ряду:
Обратите внимание на то, что углеводы D- и L-ряда являются зеркальными отражениями друг друга. Большинство природных углеводов относится к D-ряду. Установлено, что в кристаллическом состоянии моносахариды существуют исключительно в циклических формах. Например, глюкоза в твердом виде обычно находится в α-пиранозной форме. При растворении в воде α-глюкопираноза медленно превращается в другие таутомерные формы вплоть до установления равновесия. Это является своеобразной кольчатоцепной таутомерной системой.
|
||||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 794; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.196.150 (0.008 с.) |











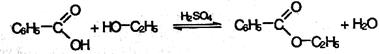
 молекула воды с одновременным выбросом протона (возврат катализатора).
молекула воды с одновременным выбросом протона (возврат катализатора).