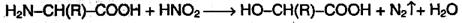Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Глава 33. Аминокислоты, пептиды и белкиСодержание книги
Поиск на нашем сайте
Многие биологически активные молекулы включают несколько химически различных функциональных групп, способных к взаимодействию между собой или с функциональными группами других молекул. Один из примеров – моносахариды, в состав которых входят несколько гидроксильных групп и одна карбонильная группа. Другой важный пример бифункциональных природных соединений – аминокислоты. Аминокислоты Номенклатура и изомерия Аминокислоты – это органические бифункциональные соединения, в состав которых входят карбоксильная группа –СООН и аминогруппа –NH2. В зависимости от взаимного расположения обеих функциональных групп различают α-, β-аминокислоты и т.д.
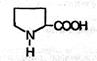
Греческая буква при атоме углерода обозначает его удаленность от карбоксильной группы. Рассматрим только α- аминокислоты, поскольку другие аминокислоты в природе встречаются значительно реже. В состав белков входят 19 основных аминокислот и одна иминокислота. Все природные аминокислоты имеют тривиальные названия. Иминокислота пролин (молекулярная формула C5H9NO2) имеет структуру
Простейшая аминокислота – глицин (аминоуксусная кислота). Остальные природные аминокислоты можно разделить на следующие основные группы: 1) гомологи глицина – аланин, валин, лейцин, изолейцин; 2) серосодержащие аминокислоты – цистеин, метионин; 3) аминокислоты с алифатической гидроксильной группой – серии, треонин; 4) ароматические аминокислоты – фенилаланин, тирозин, триптофан; 5) аминокислоты с кислотным радикалом – аспарагиновая и глутаминовая кислоты; 6) аминокислоты с амидной группой – аспарагин, глутамин; 7) аминокислоты с основным радикалом – гистидин, лизин, аргинин. Изомерия. Во всех α-аминокислотах, кроме глицина, α-углеродный атом связан с четырьмя разными заместителями, поэтому все эти аминокислоты могут существовать в виде двух изомеров (энантиомеров), являющихся зеркальными отражениями друг друга (оптическая изомерия). Каждый изомер относят к D- или L-ряду в зависимости от того, совпадает его конфигурация с конфигурацией D-глицеринового альдегида или нет:
В состав белков животных организмов входят только α-аминокислоты L-ряда.
Физические свойства Аминокислоты представляют собой кристаллические вещества, растворимые в воде, плавятся при высокой температуре с разложением. Эти свойства указывают на солеобразное ионное строение аминокислот. Многие аминокислоты имеют сладкий вкус. Получение Основной способ получения аминокислот – замещение атома галогена на аминогруппу в галогензамещенных кислотах. Этот способ аналогичен получению аминов из алкилгалогенидов и аммиака. Выделяющийся при замещении галогеноводород связывают избытком аммиака:
Химические свойства Аминокислоты – это органические амфотерные соединения. Они содержат в составе молекулы две функциональные группы противоположного характера: аминогруппу с основными свойствами и карбоксильную группу с кислотными свойствами. Аминокислоты реагируют как с кислотами, так и с основаниями:
В твердом состоянии и в водных растворах аминокислоты существуют в виде биполярных ионов (внутренних солей), которые образуются при переносе протона от карбоксильной группы к аминогруппе:
В твердом состоянии аминокислоты имеют структуру цвиттер-иона (биполярного иона), который в кислом растворе превращается в катион, а в щелочном растворе – в анион:
Водные растворы аминокислот имеют нейтральную, щелочную или кислую среду в зависимости от количества функциональных групп. Так, глутаминовая кислота образует кислый раствор (две группы –СООН, одна –NH2), лизин – щелочной (одна группа –СООН, две –NН2). Подобно первичным аминам, аминокислоты реагируют с азотистой кислотой, при этом аминогруппа превращается в гидроксогруппу, а аминокислота – в гидроксикислоту:
Измерение объема выделившегося азота позволяет определить количество аминокислоты (метод Ван-Слайка). Аминокислоты могут реагировать со спиртами в присутствии газообразного хлороводорода, превращаясь в сложный эфир (точнее, в хлороводородную соль эфира):
Сложные эфиры аминокислот не имеют биполярной структуры и являются летучими соединениями. Качественные реакции: 1) Все аминокислоты окисляются нингидрином с образованием продуктов, окрашенных в сине-фиолетовый цвет.
Иминокислота пролин дает с нингидрином желтое окрашивание. Эта реакция может быть использована для количественного определения аминокислот спектрофотометрическим методом. 2) При нагревании ароматических аминокислот с концентрированной азотной кислотой происходит нитрование бензольного кольца, и образуются соединения, окрашенные в желтый цвет. Эту реакцию называют ксантопротеиновой (от греч. ксантос – желтый). Пептиды Пептиды можно рассматривать как продукты конденсации двух или более молекул аминокислот. Две молекулы аминокислоты могут реагировать друг с другом с отщеплением молекулы воды и образованием продукта, в котором фрагменты связаны пептидной связью –CO–NH–.
Полученное соединение называют дипептидом. Молекула дипептида, подобно аминокислотам, содержит аминогруппу и карбоксильную группу и может реагировать еще с одной молекулой аминокислоты:
Продукт реакции называется трипептидом. Процесс наращивания пептидной цепи может продолжаться, в принципе, неограниченно и приводить к веществам с очень высокой молекулярной массой (белкам). Число пептидов, которые могут быть построены из 20 природных аминокислот, огромно. Теоретически можно получить 20n пептидов, содержащих п остатков. Таким образом, может существовать 400 дипептидов, 8000 трипептидов и т.д. При п = 62 число возможных пептидов превосходит число атомов во Вселенной (1080). Формулы пептидов обычно записывают так, что свободная аминогруппа находится слева (на N-конце цепи), а свободная карбоксильная группа – справа (на С-конце). Основная часть пептидной цепи построена из повторяющихся участков -CH-CO-NH- и боковых групп R, R' и т.д. Структуру пептидов, содержащих большое число остатков аминокислот, записывают в сокращенном виде с использованием обозначений. Например, строение молекулы вазопрессина – пептида, построенного из 9 аминокислотных остатков, можно изобразить в сокращенном виде следующим образом:
Обратите внимание на то, что в этом пептиде остатки цистеина связаны дисульфидным мостиком. С-конец цепи содержит амидную группу –CO–NH2 вместо карбоксильной. Основное свойство пептидов – способность к гидролизу. При гидролизе происходит полное или частичное расщепление пептидной цепи, и образуются более короткие пептиды с меньшей молекулярной массой или α-аминокислоты, составляющие цепь. Анализ продуктов полного гидролиза позволяет установить аминокислотный состав пептида. Полный гидролиз происходит при длительном нагревании пептида с концентрированной соляной кислотой. Последовательность аминокислот в цепи может быть установлена путем частичного гидролиза пептида. Для этого необходимо последовательно, одну за другой, отщеплять аминокислоты от одного из концов цепи и устанавливать их структуру. Гидролиз пептидов может происходить в кислой или щелочной среде, а также под действием ферментов. В кислой и щелочной средах образуются соли аминокислот. Ферментативный гидролиз важен тем, что протекает селективно, т.е. позволяет расщеплять строго определенные участки пептидной цепи. Интересно, что селективный гидролиз может протекать и под действием неорганических реагентов. Так, бромистый циан (BrCN) расщепляет полипептидную цепь только по пептидной связи, образованной карбоксильной группой метионина. Биологическое значение. Многие пептиды проявляют биологическую активность. Простейший из них – трипептид глутатион, который относится к классу гормонов – веществ, регулирующих процессы жизнедеятельности. Этот гормон построен из остатков глицина, цистеина и глутаминовой кислоты. Известны гормоны, содержащие 9 аминокислотных остатков, – вазопрессин и окситоцин. Вазопрессин повышает кровяное давление, а окситоцин стимулирует выделение молока молочными железами. Белки Белки – это природные полипептиды с высокими значениями молекулярной массы (от 10 000 до десятков миллионов). Они входят в состав всех живых организмов и выполняют разнообразные биологические функции. Можно выделить четыре уровня в строении полипептидной цепи. Первичная структура белка – это конкретная последовательность аминокислот в полипептидной цепи. Пептидная цепь имеет линейную структуру только у небольшого числа белков. В большинстве белков пептидная цепь определенным образом свернута в пространстве. Вторичная структура – это конформация полипептидной цепи, т.е. способ скручивания цепи в пространстве за счет водородных связей между группами NH и СО. Существует два основных способа укладки цепи – α-спираль и β-структура. В α-спирали на одном витке укладываются четыре аминокислотных остатка. Все радикалы аминокислот находятся снаружи спирали. Между группами NH и СО, находящимися на соседних витках, образуются водородные связи, которые стабилизируют спираль. В β-структуре (складчатом слое) полипептидная цепь растянута, ее участки располагаются параллельно друг другу и удерживаются водородными связями. Третичная структура образуется за счет дисульфидных мостиков -S-S- между цистеиновыми остатками, находящимися в разных местах полипептидной цепи. В образовании третичной структуры участвуют также ионные взаимодействия противоположно заряженных групп NH3+ и COO- и гидрофобные взаимодействия, т.е. стремление молекулы белка свернуться так, чтобы гидрофобные углеводородные остатки оказались внутри структуры. Третичная структура – высшая форма пространственной организации белков. Однако, некоторые белки (например, гемоглобин) имеют четвертичную структуру, которая образуется за счет взаимодействия между разными полипептидными цепями: Ключевой этап определения структуры белка – расшифровка последовательности аминокислот в первичной структуре. Для этого белок сначала разделяют на полипептидные цепи (если их несколько), а затем анализируют аминокислотный состав цепей путем последовательного отщепления аминокислот. Это – чрезвычайно трудоемкая процедура, поэтому первичная структура надежно установлена только для достаточно простых белков. Первый белок, у которого была расшифрована первичная структура, – гормон инсулин (1955г.). Это – простой белок, состоящий из двух полипептидных цепей (одна цепь содержит 21 аминокислотный остаток, другая – 30 остатков), соединенных двумя дисульфидными мостиками. На установление его структуры английскому биохимику Ф. Сангеру потребовалось 10 лет. Пространственную структуру белков анализируют, изучая данные рассеяния рентгеновского излучения (рентгеноструктурный анализ) или нейтронов (нейтронография). Часто применяют спектроскопические методы, особенно для исследования структуры белков в водных растворах. Принципиальная возможность синтеза белков была доказана на примере двух гормонов – вазопрессина и окситоцина. Впоследствии были синтезированы более сложные белки – инсулин и рибонуклеаза (124 аминокислотных остатка). Для синтеза белков широко используют твердофазный метод, разработанный в начале 1960-х гг. американским химиком Б. Меррифилдом. В этом методе первая аминокислота закрепляется на полимерном носителе, и к ней последовательно подшиваются новые аминокислоты. По окончании синтеза готовая полипептидная цепь отрывается от носителя. В настоящее время искусственное получение белков осуществляется не с помощью химического, а с помощью микробиологического синтеза, путем использования микроорганизмов. В живой природе синтез белков происходит чрезвычайно быстро, всего за несколько секунд. Живые клетки – это хорошо организованные «фабрики», в которых четко налажена система поставки сырья (аминокислот) и технология сборки. Информация о первичной структуре всех белков организма содержится в дезоксирибонуклеиновой кислоте (ДНК). Физические свойства Физические свойствабелков весьма разнообразны и определяются их строением. По физическим свойствам белки делят на два класса: глобулярные белки растворяются в воде или образуют коллоидные растворы, фибриллярные белки в воде нерастворимы. Химические свойства 1. Разрушение вторичной и третичной структуры белка с сохранением первичной структуры называется денатурацией. Она происходит при нагревании, изменении кислотности среды, действии излучения. Пример денатурации – свертывание яичных белков при варке яиц. Денатурация бывает обратимой и необратимой. Необратимая денатурация может быть вызвана образованием нерастворимых веществ при действии на белки солей тяжелых металлов – свинца или ртути. 2. Гидролиз белков – это необратимое разрушение первичной структуры в кислом или щелочном растворе с образованием аминокислот. Анализируя продукты гидролиза, можно установить количественный состав белков. 3. Для белков известны несколько качественных реакций. Все соединения, содержащие пептидную связь, дают фиолетовое окрашивание при действии на них солей меди (II) в щелочном растворе. Эту реакцию называют биуретовой. Белки, содержащие остатки ароматических аминокислот (фенилаланина, тирозина), дают желтое окрашивание при действии концентрированной азотной кислоты (ксантопротеиновая реакция).
|
||||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 145; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.139.104.140 (0.01 с.) |