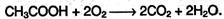Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Глава 28. Карбонильные соединения (оксосоединения)Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
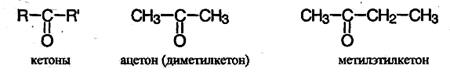
Номенклатура и изомерия Органические соединения, в молекуле которых имеется карбонильная группа В молекулах альдегидов карбонильная группа связана с атомами водорода или с одним углеводородным радикалом:
метан аль этан аль а в молекулах кетонов – с двумя углеводородными радикалами:
Для альдегидов часто используют тривиальные названия, например формальдегид Н2С=О. По международной номенклатуре названия альдегидов образуют, прибавляя окончание - аль к названию углеводорода с самой длинной углеродной цепью, включающей карбонильную группу, от которой и начинают нумерацию цепи. Кетоны часто называют по наименованию радикалов, связанных с карбонильной группой, например метилэтилкетон СН3-СО-СН2-СН3. По международной номенклатуре к названию предельного углеводорода добавляют окончание - он и указывают номер атома углерода, связанного с карбонильным кислородом. Нумерацию начинают с ближайшего к карбонильной группе конца цепи, например: метилэтилкетон – это то же самое, что бутанон-2. Углеводородные радикалы могут быть алифатическими (насыщенными или ненасыщенными), алициклическими и ароматическими. В молекуле кетона радикалы могут быть одинаковыми или разными. Поэтому кетоны, как и простые эфиры, бывают симметричные и смешанные. Рассмотрим только алифатические карбонильные соединения. Общая формула предельных альдегидов и кетонов СnН2nО. В карбонильной группе связь между атомами углерода и кислорода – двойная. Атом углерода находится в состоянии sр2-гибридизации и образует 3 δ-связи (две связи С-Н и одну связь С-О), которые располагаются в одной плоскости под углом 120º друг к другу, π-связь С-O образована при перекрывании негибридных 2p-орбиталей атомов углерода и кислорода. Двойная связь С=О является сочетанием одной σ- и одной π-связей. В силу большей электроотрицательности атома кислорода электронная плотность двойной связи смещена в сторону атома кислорода:
Полярность связи С=О сказывается на физических и химических свойствах карбонильных соединений. Изомерия альдегидов связана только со строением углеродного скелета, например:
Изомерия кетонов связана со строением углеродного скелета и с положением карбонильной группы, например:
Кроме того, альдегиды и кетоны с одинаковым числом атомов углерода изомерны друг другу, например ацетон и пропаналь или глюкоза и фруктоза. Физические свойства Карбонильные соединения не образуют водородных связей, поскольку в их молекулах нет атомов водорода с положительным зарядом. По этой причине температуры кипения альдегидов и кетонов значительно ниже, чем соответствующих спиртов. Низшие альдегиды и кетоны – легкокипящие жидкости (формальдегид – газ) с резким запахом, хорошо растворимы в воде. Получение 1. Гидратация алкинов. Из ацетилена получают альдегид, из его гомологов – кетоны:
Из-за своей относительной дороговизны, а также из-за того, что: получаемые соединения загрязнены токсичными соединениями ртути, в настоящее время этот способ находит ограниченное применение. 2. Общий способ получения карбонильных соединений – окисление спиртов. В качестве окислителя можно использовать не только дихромат или перманганат калия, но и другие соединения, например, оксид меди (II) при нагревании:
3. При щелочном гидролизе дигалогеналканов, содержащих два атома галогена при одном атоме углерода, образуются двухатомные спирты, в которых две группы ОН соединены с одним атомом углерода. Эти вещества неустойчивы и отщепляют воду, превращаясь в карбонильные соединения:
4. Дегидрирование спиртов. Одним из промышленных способов получения альдегидов и кетонов является дегидрирование спиртов в газовой фазе над металлическими медью, серебром, хромом, никелем, оксидом цинка и др., например:
5. Окисление алкенов. Альдегиды и кетоны получают окислением углеводородов ряда этилена кислородом воздуха в присутствии хлоридов палладия (II) и меди. (II), например:
Этим экономичным способом в промышленности получают низшие альдегиды и кетоны. 6. Простейший кетон – ацетон – получают кумольным методом вместе с фенолом. Химические свойства Химические свойства альдегидов и кетонов определяются тем, что в состав их молекул входит карбонильная группа с полярной двойной связью.
Альдегиды и кетоны – химически активные соединения, которые склонны к реакциям присоединения по связи С=О. Эти реакции протекают по механизму нуклеофильного присоединения, обозначается AN (от англ. addition nucleophilic). Активность альдегидов и кетонов в реакциях присоединения определяется величиной положительного заряда δ+ на атоме углерода в карбонильной группе. Электронодонорные группы, связанные с группой СО, уменьшают величину этого заряда. Карбонильная группа кетонов связана с двумя углеводородными радикалами (которые являются электронодонорными группами), поэтому кетоны менее активны, чем альдегиды (в которых группа СО связана только с одним радикалом). Самый активный из альдегидов – формальдегид Н2СО. Важнейшие реакции присоединения: 1. Присоединение водорода (восстановление). При взаимодействии альдегидов с водородом получаются первичные спирты:
Кетоны в аналогичной реакции дают вторичные спирты. В лабораторных условиях для восстановления карбонильных соединений используют алюмогидрид лития LiAlH4. 2.Присоединение циановодородной (синильной) кислоты:
Образовавшееся соединение содержит на один атом углерода больше, чем исходный альдегид или кетон, поэтому подобные реакции используют для удлинения углеродной цепи. 3. Взаимодействие со спиртами. Альдегиды могут взаимодействовать с одной или двумя молекулами спирта, образуя соответственно полуацетали и ацетали. Полуацеталями называют соединения, содержащие при одном атоме углерода гидроксильную и алкоксильную (OR) группы. Ацетали – это соединения, содержащие при одном атоме углерода две алкоксильные группы:
Реакцию получения ацеталей широко используют в органических синтезах для «защиты» активной альдегидной группы от нежелательных реакций:
Особенно важное значение подобные реакции имеют в химии углеводов. 4. Присоединение гидросульфитов служит для выделения альдегидов из смесей с другими веществами и для получения их в чистом виде, поскольку полученное сульфопроизводное очень легко гидролизуется:
5. Присоединение реактива Гриньяра. В органическом синтезе часто используют реактив Гриньяра – одно из простейших металлоорганических соединений. При добавлении раствора галогеналкана в диэтиловом эфире к магниевой стружке легко происходит экзотермическая реакция, магний переходит в раствор и образуется реактив Гриньяра:
где R – алкильный или арильный радикал, X – галоген. а) Взаимодействием реактива Гриньяра с формальдегидом можно получить практически любой первичный спирт (кроме метанола). Для этого продукт присоединения реактива Гриньяра гидролизуют водой:
б) При использовании любых других алифатических альдегидов могут быть получены вторичные спирты:
в) Взаимодействием реактивов Гриньяра с кетонами получают третичные спирты:
6. Присоединение воды. Альдегиды в водных растворах существуют в виде гидратных форм, образующихся в результате присоединения воды к карбонильной группе:
Реакция обратима, положение равновесия зависит от реакционной способности карбонильного соединения. Например, формальдегид гидратирован на 100%, менее активный ацетальдегид – только на 51%. Кетоны в водных растворах практически не гидратируются. Реакции окисления. Альдегиды и кетоны по-разному относятся к действию окислителей. Альдегиды легко (значительно легче, чем спирты) окисляются в соответствующие карбоновые кислоты. Для их окисления можно использовать такие мягкие окислители, как оксид серебра и гидроксид меди (II).
Кетоны к действию окислителей инертны, в частности, они не окисляются кислородом воздуха. Кетоны реагируют только с очень сильными окислителями, способными разорвать связи С–С в их молекуле. 7. Реакция «серебряного зеркала» – это окисление альдегидов аммиачным раствором оксида серебра. В водном растворе аммиака оксид серебра образует комплексное соединение [Ag(NH3)2]OH, при действии которого на альдегид происходит окислительно-восстановительная реакция с образованием соли аммония:
Иногда эту реакцию записывают в упрощенном виде:
8. При окислении альдегидов гидроксидом меди (II) последний превращается в желтый гидроксид меди (I), который при нагревании разлагается с образованием оксида меди (I) красного цвета:
Данная реакция и реакция серебряного зеркала являются качественными реакциями на альдегиды. 9. Реакции поликонденсации. Для альдегидов характерны реакции поликонденсации – см. схему реакции фенола с формальдегидом.
Применение Формальдегид – газ с резким раздражающим запахом. 40% водный раствор формальдегида называется формалином. Формальдегид получают в промышленности в крупных масштабах окислением метана или метанола. При нагревании формальдегида с аммиаком А.М. Бутлеров синтезировал гексаметилентетрамин (уротропин, сухое горючее): 6СН2О + 4 NН3 → (СН2)6N4 + 6Н2О Уротропин применяется в медицине как противовоспалительное средство, используется в больших количествах в производстве полимеров, взрывчатых веществ. Формальдегид обладает бактерицидным действием и применяется в качестве дезинфицирующего средства для обработки зерно- и овощехранилищ, для протравливания семян, для консервации анатомических препаратов. На основе реакции поликонденсации формальдегида с фенолом получают фенолформальдегидные смолы, с мочевиной – карбамидные смолы. Ацетальдегид – легкокипящая жидкость (температура кипения 21°С) с запахом зеленой листвы. Применяется для получения многих органических соединений уксусной кислоты, этилацетата, хлороформа и др.
Ацетон – бесцветная жидкость с характерным запахом, смешивается с водой во всех Соотношениях, хороший растворитель органических веществ. Основным способом синтеза ацетона является кумольный метод совместного получения фенола и ацетона. Ацетон используют как растворитель лаков, красок, в производстве ацетатного волокна, бездымного пороха и других химических продуктов.
Номенклатура и изомерия Карбоновыми кислотами называют соединения, содержащие карбоксильную группу
По числу карбоксильных групп карбоновые кислоты делят на монокарбоновые, или одноосновные (одна группа –СООН), дикарбоновые, или двухосновные (две группы –СООН) и т.д. В зависимости от строения углеводородного радикала, с которым связана карбоксильная группа, карбоновые кислоты бывают алифатическими (например, уксусная или акриловая), алициклическими (например, циклогексанкарбоновая) или ароматическими (бензойная, фталевая). В основе названий карбоновых кислот лежат названия соответствующих углеводородов. Наличие карбоксильной группы отражается окончанием -овая кислота. Низшие карбоновые кислоты часто имеют тривиальные названия: муравьиная, уксусная, масляная и др.
Часто карбоксильную группу рассматривают как заместитель в молекуле углеводорода. При этом в названии употребляют словосочетание «карбоновая кислота» и в нумерацию атомов углерода цепи атом углерода карбоксильной группы не включают:
Названия дикарбоновых кислот производят от названия соответствующего углеводорода с добавлением суффикса «диовая» и слова «кислота». Например, этандиовая кислота (НООС-СООН). При рассмотрении карбоксильной группы как заместителя, название двухосновной кислоты производят от названия углеводородного радикала с добавлением словосочетания «дикарбоновая кислота». Например, малоновую кислоту (НООС-СН2-СООН) называют метандикарбоновой кислотой.
Если в углеводородном радикале карбоновых кислот атом (атомы) водорода замещен на другие функциональные группы, то такие кислоты называют гетерофункциональными. Среди них различают галогенкарбоновые (например, СН2Сl–СООН), нитрокислоты (например, NO2–C6H4COOH), аминокислоты, оксикислоты (например, молочная СН3–СН(ОН)–СООН) и др.
Карбоновые кислоты с числом атомов углерода выше 6 называют высшими (жирными) кислотами. Название «жирные» эти кислоты получили потому, что большинство из них могут быть выделены из жиров. Карбоксильная группа –СООН состоит из карбонильной группы –С=О и гидроксильной группы –ОН. Свойства карбоксильной группы отличаются от свойств составляющих ее групп, которые оказывают взаимное влияние друг на друга. В группе СО атом углерода несет частичный положительный заряд и притягивает к себе неподеленную электронную пару атома кислорода в группе ОН. При этом электронная плотность на атоме кислорода уменьшается, и связь О–Н ослабляется:
В свою очередь, группа ОН «гасит» положительный заряд на группе СО, которая из-за этого теряет способность к реакциям присоединения, характерным для карбонильных соединений. Карбоновые кислоты не единственный (хотя и самый многочисленный) класс органических веществ, обладающих кислотными свойствами; кислотные свойства имеет фенолы, пятичленный азотсодержащий гетероцикл пиррол.
Очень сильными органическими кислотами являются сульфокислоты – соединения, содержащие сульфогруппу –SO3H (например, метансульфокислота CH3SO3H). Особенно важное значение имеют сульфокислоты ароматического ряда и их производные. Они являются промежуточными продуктами для синтеза различных органических веществ. У карбоновых кислот возможны следующие виды изомерии: 1. Изомерия углеродной цепи. Она начинается с бутановой кислоты (С3Н7СООН), которая существует в виде двух изомеров:
2. Изомерия положения кратной связи, например:
3. Цис- транс- изомерия, например.
4. Межклассовая изомерия: например, масляной кислоте (СН3СН2СН2СООН) изомерны метиловый эфир пропановой кислоты (СН3СН2-СО-О-СН3) и этиловый эфир уксусной кислоты (СН3-СО-О-СН2СН3). 5. У гетерофункциональных кислот имеется изомерия, связанная с положением функциональных групп, например, существуют три изомера хлормасляной кислоты:
Для гетерофункциональных кислот возможна также оптическая изомерия (например, оптические изомеры молочной кислоты или аминокислот). Физические свойства Насыщенные алифатические монокарбоновые кислоты образуют гомологический ряд, который характеризуется общей формулой CnH2n+1COOH. Низшие члены этого ряда при обычных условиях представляют собой жидкости, обладающие характерным острым запахом. Например, этановая (уксусная) кислота имеет характерный «уксусный» запах. Безводная уксусная кислота при комнатной температуре представляет собой жидкость; при 17 °С она замерзает, превращаясь в льдистое вещество, которое получило название «ледяная» уксусная кислота. Средние представители этого гомологического ряда – вязкие, «маслообразные» жидкости; начиная с С10 – твердые вещества. Кислоты, содержащие 1-3 атома углерода, неограниченно смешиваются с водой. С дальнейшим ростом углеводородного радикала растворимость монокарбоновых кислот уменьшается, твердые высшие жирные кислоты в воде не растворяются. В жидком состоянии и в неводных растворах молекулы монокарбоновых кислот димеризуются в результате образования между ними водородных связей. Это объясняет гораздо более высокие температуры кипения карбоновых кислот по сравнению со При одной и той же длине углеводородного радикала температуры плавления (и кипения) зависят от наличия кратных связей – сростом их числа соответствующие температуры уменьшаются.Ненасыщенные кислоты при комнатной температуре являются, как правило, жидкостями. Все дикарбоновые и ароматические кислоты при комнатной температуре – кристаллические вещества. Получение 1. Окисление первичных спиртов – общий способ получения карбоновых кислот. В качестве окислителей применяют КМnО4 и К2Сr2O7.
2. Другой общий способ – гидролиз галогензамещенных углеводородов, содержащих три атома галогена у одного атома углерода. При этом образуются спирты, содержащие три группы ОН у одного атома углерода, такие спирты неустойчивы и отщепляют воду с образованием карбоновой кислоты:
3. Получение карбоновых кислот из цианидов (нитрилов) - это важный способ, позволяющий наращивать углеродную цепь при получении исходного цианида. Дополнительный атом углерода вводят в состав молекулы, используя реакцию замещения галогена в молекуле галогенуглеводорода цианидом натрия, например:
Образующийся нитрил уксусной кислоты (ацетонитрил, или метил-цианид) при нагревании гидролизуется с образованием ацетата аммония:
При подкислении раствора выделяется кислота:
5. Гидролиз сложных эфиров:
6. Гидролиз ангидридов кислот:
7. Для отдельных кислот существуют специфические способы получения. Муравьиную кислоту получают нагреванием оксида углерода (II) спорошкообразным гидроксидом натрия под давлением и обработкой полученного формиата натрия сильной кислотой:
Уксусную кислоту получают каталитическим окислением бутана кислородом воздуха:
Для получения бензойной кислоты можно использовать окисление монозамещенных гомологов бензола кислым раствором перманганата калия:
Кроме того, бензойную кислоту можно получить из бензальдегида с помощью реакции Канниццаро. В этой реакции бензальдегид обрабатывают 40-60%-ным раствором гидроксида натрия при комнатной температуре. Одновременное окисление и восстановление приводит к образованию бензойной кислоты и бензилового спирта:
Химические свойства Карбоновые кислоты – более сильные кислоты, чем спирты, поскольку атом водорода в карбоксильной группе обладает повышенной подвижностью благодаря влиянию группы –СО. В водном растворе карбоновые кислоты диссоциируют:
Тем не менее, из-за ковалентного характера молекул карбоновых кислот указанное выше равновесие диссоциации достаточно сильно сдвинуто влево. Таким образом, - карбоновые кислоты – это, как правило, слабые кислоты. Например, уксусная кислота характеризуется константой диссоциации Ка = 1,7*10-5. Заместители, присутствующие в молекуле карбоновой кислоты, сильно влияют на ее кислотность вследствие оказываемого ими индуктивного эффекта. Такие заместители, как хлор или фенильный радикал, оттягивают на себя электронную плотность и, следовательно, вызывают отрицательный индуктивный эффект (–I). Оттягивание электронной плотности от карбоксильного атома водорода приводит к повышению кислотности карбоновой кислоты. В отличие от этого такие заместители, как алкильные группы, обладают электронодонорными свойствами и создают положительный индуктивный эффект (+I). Они понижают кислотность. Взаимное влияние атомов в молекулах дикарбоновых кислот приводит к тому, что они являются более сильными, чем одноосновные. 1. Образование солей. Карбоновые кислоты обладают всеми свойствами обычных кислот. Они реагируют с активными металлами, основными оксидами, основаниями и солями слабых кислот:
Карбоновые кислоты – слабые, поэтому сильные минеральные кислоты вытесняют их из соответствующих солей:
Соли карбоновых кислот в водных растворах гидролизованы:
Отличие карбоновых кислот от минеральных заключается в возможности образования ряда функциональных производных. 2. Образование функциональных производных карбоновых кислот. При замещении группы ОН в карбоновых кислотах различными группами (X) образуются функциональные производные кислот, имеющие общую формулу R–CO–X; здесь R обозначает алкильную либо арильную группу. Хотя нитрилы имеют другую общую формулу (R–CN), обычно их также рассматривают как производные карбоновых кислот, поскольку они могут быть получены из этих кислот. Хлорангидриды получают действием хлорида фосфора (V) на кислоты:
Ангидриды образуются из карбоновых кислот при действии водоотнимающих средств:
Сложные эфиры образуются при нагревании кислоты со спиртом в присутствии серной кислоты (обратимая реакция этерификации):
Механизм реакции этерификации установлен методом «меченых атомов». Сложные эфиры можно также получить при взаимодействии хлорангидридов кислот и алкоголятов щелочных металлов:
Кроме того, амиды могут быть получены при нагревании аммонийных солей карбоновых кислот:
Реакции хлорангидридов карбоновых кислот с аммиаком приводят к образованию амидов: При нагревании амидов в присутствии водоотнимающих средств они дегидратируются с образованием нитрилов:
Функциональные производные низших кислот – летучие жидкости (за исключением амидов, которые при обычных условиях – твердые вещества). Все они гидролизуются с образованием исходной кислоты:
В кислой среде эти реакции могут быть обратимы. Гидролиз в щелочной среде необратим и приводит к образованию солей карбоновых кислот, так:
3. Ряд свойств карбоновых кислот обусловлен наличием углеводородного радикала. Так, при действии галогенов на кислоты в присутствии красного фосфора образуются галогензамещенные кислоты, причем на галоген замещается атом водорода при соседнем с карбоксильной группой атоме углерода (α-атоме):
Непредельные карбоновые кислоты способны к реакциям присоединения:
Две последние реакции протекают против правила Марковникова, Непредельные карбоновые кислоты и их производные способны к реакциям полимеризации:
4. Окислительно-восстановительные реакции карбоновых кислот. Карбоновые кислоты при действии восстановителей в присутствии катализаторов способны превращаться в альдегиды, спирты и даже углеводороды:
Насыщенные карбоновые кислоты устойчивы к действию концентрированных серной и азотной кислот. Исключение составляет муравьиная кислота:
Муравьиная кислота НСООН отличается рядом особенностей, поскольку в ее составе есть альдегидная группа:
Муравьиная кислота – сильный восстановитель и легко окисляется до СО2. Она дает реакцию «серебряного зеркала»:
или в упрощенном виде:
Кроме того, муравьиная кислота окисляется хлором
В атмосфере кислорода карбоновые кислоты окисляются до СО2 и Н2О:
5. Реакции декарбоксилирования. Насыщенные незамещенные монокарбоновые кислоты из-за большой прочности связи С-С при нагревании декарбоксилируются с трудом. Для этого необходимо сплавление соли щелочного металла карбоновой кислоты со щелочью:
Появление электронодонорных заместителей в углеводородном радикале способствует реакции декарбоксилирования:
Двухосновные карбоновые кислоты легко отщепляют СО2 при нагревании:
Применение Насыщенные кислоты. Муравьиная кислота НСООН. Название связано с тем, что кислота содержится в выделениях муравьев. Широко применяется в фармацевтической и пищевой промышленности. Уксусная кислота СН3СООН. Известна с глубокой древности, ее 5-10% растворы («столовый уксус») используют как вкусовую приправу и консервант. Консервирующее действие кислоты связано с подавлением развития гнилостных бактерий и плесневых грибков. Для пищевых целей уксусную кислоту получают ферментативным брожением винного спирта:
Основную часть производимой уксусной кислоты используют для производства искусственных волокон на основе целлюлозы. Пальмитиновая С15Н31СООН и стеариновая С17Н35СООН кислоты входят в состав животных жиров и растительных масел. Натриевые и калиевые соли этих кислот входят в состав мыла. Щавелевая кислота НООС-СООН.Широко распространена в растительном мире. В виде солей (оксалатов) содержится в листьях щавеля, кислицы, ревеня. Качественной реакцией для обнаружения щавелевой кислоты и ее солей служит образование нерастворимого оксалата кальция:
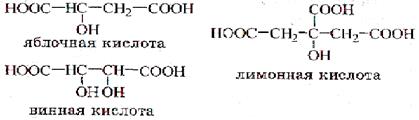
Применяется в текстильной и кожевенной промышленности. Малоновая кислота НООС-СН2-СООН. Содержится в виде кальциевой соли в соке сахарной свеклы. Широко используется в фармацевтической промышленности. Янтарная кислота НООС-СН2-СН2-СООН своим названием обязана тому, что содержится в янтаре (впервые выделена при сухой перегонке янтаря в XVI в.). Применяется в фармацевтической и текстильной промышленности, а также в производстве инсектицидов, смол, фотоматериалов. Ненасыщенные кислоты. Характерной особенностью простейших ненасыщенных кислот – акриловой и метакриловой (СН2=С(СН3)-СООН) – является склонность к полимеризации. При полимеризации эфиров или нитрилов этих кислот получают ценные вещества. В частности, полиакрилонитрил – основа волокна нитрон, используемого для производства лечебного белья. Жирные ненасыщенные кислоты. Одной из наиболее распространенных во многих растениях и организмах животных является олеиновая кислота; она содержится в оливковом масле (от которого и произошло ее название), а также в свином жире. Особенно нужно подчеркнуть роль линоленовой и линоленовой кислот как соединений, незаменимых для человека (в организме они не могут быть синтезированы и должны поступать с пищей в количестве около 5 г в день). По этой причине эти кислоты относят к так называемым незаменимым жирным кислотам. Линолевая и линоленовая кислоты содержатся в основном в растительных маслах. Они способствуют снижению содержания в крови холестерина – одного из факторов развития атеросклероза. Ароматические кислоты. Бензойная кислота широко распространена в природе. Содержится в различных растительных смолах, ягодах клюквы, брусники, черники. Применяют в фармацевтической промышленности для синтеза душистых веществ и красителей, а также в качестве консерванта для пищевых продуктов. Фталевые кислоты находят широкое применение в производстве высокомолекулярных соединений. Гетерофункциональные кислоты. Наиболее известные представители оксокислот – молочная, яблочная (гидроксибутандиовая), лимонная (2-гидроксипропан-1,2,3-трикарбоновая) и салициловая (2-гидроксибензойная). Яблочная и лимонная кислоты являются метаболитами цикла Кребса, который также называют циклом лимонной кислоты. Молочная кислота образуется в мышцах человека и животных при интенсивной мышечной работе. Молочная кислота образуется при молочнокислом брожении:
Такие процессы идут при квашении капусты, приготовлении сыра, силосовании кормов. Молочная кислота используется как консервирующее средство в пищевой промышленности. Она применяется также в текстильной промышленности, в кожевенном производстве, как исходное вещество во многих синтезах. Яблочная и лимонная кислоты применяются в пищевой промышленности. Лимонная кислота находит применение в медицине, входит в состав комбинированного препарата «цитрамон» и других лекарственных средств. 5% раствор цитрата натрия используется для консервирования крови. Мыла и моющие средства. Натриевые и калиевые соли высших жирных кислот называют мылами, т.к. они обладают хорошими моющими свойствами. Натриевые соли составляют основу твердых мыл, в то время как калиевые соли – жидких. Их получают кипячением животного сала либо растительного масла с гидроксидом натрия или калия– отсюда старинное название щелочного гидролиза жиров – «омыление». Очищающие (моющие) свойства мыла объясняются смачивающей способностью растворимых солей высших жирных кислот, т.е. анионы мыла обладают сродством, как к жирным загрязнениям, так и к воде. Анионная карбоксигруппа обладает сродством к воде: она гидрофильна. Углеводородная же цепь жирной кислоты обладает сродством к жирным загрязнениям. Она представляет собой гидрофобный конец молекулы мыла. Этот конец растворяется в капле грязи, в результате чего происходит ее трансформация и превращение в мицеллу. Удаление «пенообразных» мицелл с загрязненной поверхности достигается ее промыванием водой. В так называемой жесткой воде, содержащей ионы Са2+ и Мg2+ происходит уменьшение моющей способности мыла, поскольку, взаимодействуя с ионами кальция и магния, мыла образуют нерастворимые кальциевые и магниевые соли, например:
В результате этого мыло образует вместо пены хлопья на поверхности воды и расходуется бесполезно. Этого недостатка лишены синтетические моющие средства (детергенты), представляющие собой натриевые соли различных сулъфокислот общей формулы:
Распространенными синтетическими моющими средствами (детергентами) являются алкилбензолсульфонаты:
Правда, повсеместное использование синтетических детергентов (стиральные порошки) создает свои проблемы. Типичный стиральный порошок содержит приблизительно 70% синтетического моющего средства и приблизительно 30% неорганических фосфатов. Фосфаты удаляют растворимые соли кальция. К сожалению, эти фосфаты попадают в сточные воды, которые сбрасываются в ручьи, реки, озера или океаны. Фосфаты являются питательной средой для определенных водорослей. Это приводит к сильному разрастанию цианобактерий, особенно в замкнутых водоемах, например, в озерах.
|
|||||||||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 698; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.139.86.58 (0.021 с.) |

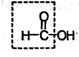
 , называют карбонильными соединениями, или оксосоединениями. Они делятся на две родственные группы – альдегиды и кетоны.
, называют карбонильными соединениями, или оксосоединениями. Они делятся на две родственные группы – альдегиды и кетоны.


























 Глава 29. КАРБОНОВЫЕ КИСЛОТЫ
Глава 29. КАРБОНОВЫЕ КИСЛОТЫ
 Углеводородную цепь нумеруют начиная с атома углерода карбоксильной группы, например:
Углеводородную цепь нумеруют начиная с атома углерода карбоксильной группы, например:








 спиртами и альдегидами с тем же числом атомов углерода; температуры плавления и кипения с ростом молекулярной массы возрастают.
спиртами и альдегидами с тем же числом атомов углерода; температуры плавления и кипения с ростом молекулярной массы возрастают.