Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Глава 2. Строение атома и периодический законСодержание книги
Поиск на нашем сайте
Модели строения атома Прямым доказательством сложности строения атома было открытие самопроизвольного распада атомов некоторых элементов, названное радиоактивностью (А. Беккерель, 1896 г.). Последовавшее за этим установление природы α-, β- и γ-лучей, образующихся при радиоактивном распаде и открытие ядер атомов позволили Э. Резерфорду (1911 г.) предложить одну из первых моделей строения атома. Планетарная модель Резерфорда. Суть планетарной модели строения атома можно свести к следующим утверждениям: 1. В центре атома находится положительно заряженное ядро, занимающее ничтожную часть пространства внутри атома. 2. Весь положительный заряд и почти вся масса атома сосредоточены в его ядре. 3. Вокруг ядра вращаются электроны. Их число равно положительному заряду ядра. Эта модель оказалась очень наглядной и полезной для объяснения многих экспериментальных данных, но обнаружила и свои недостатки. Теория Бора. В 1913 г. Н. Бор предложил свою теорию строения атома, в основу положено два необычных постулата: 1. Электрон может вращаться вокруг ядра не по произвольным, а только по строго определенным (стационарным) круговым орбитам. 2. При движении по стационарным орбитам электрон не излучает и не поглощает энергии. Таким образом, Бор предположил, что электрон в атоме не подчиняется законам классической физики. Согласно Бору, излучение или поглощение энергии определяется переходом из одного состояния в другое, что соответствует переходу электрона с одной стационарной орбиты на другую. При таком переходе излучается или поглощается энергия ∆ Е, величина которой определяется соотношением: ∆ Е = Е 1 – Е 2 = hν, где ν – частота излучения, h = 6,626∙10–34 Дж∙с (постоянная Планка). Квантовая модель строения атома. Теорию Бора сменила квантовая теория, которая учитывает волновые свойства электрона и других элементарных частиц, образующих атом. В основе современной теории строения атома лежат следующие основные положения: 1. Электрон имеет двойственную природу (корпускулярно-волновой дуализм). Он может вести себя и как частица, и как волна: подобно частице, электрон обладает определенной массой и зарядом; в то же время, движущийся электрон проявляет волновые свойства, например, характеризуется способностью к дифракции. Длина волны электрона λ и его скорость υ связаны соотношением де Бройля: λ = h / тυ, где т – масса электрона (9,1∙10–19 г или 0,00055 а.е.м., заряд –1). 2. Для электрона невозможно одновременно точно измерить координату и скорость. Чем точнее мы измеряем скорость, тем больше неопределенность в координате, и наоборот. Вероятностное нахождение электрона в определенном положении в любой момент времени соответствует принципу неопределенности Гейзенберга: положение и момент электрона не поддаются одновременному определению с абсолютной точностью. 3. Электрон в атоме не движется по определенным траекториям, а может находиться в любой части околоядерного пространства, однако вероятность его нахождения в разныхчастях этого пространства неодинакова. Орбиталь – совокупность положений электрона в атоме, т.е. область пространства, в которой наиболее вероятно нахождение электрона. 4. Ядра атомов состоят из протонов и нейтронов (общее название – нуклоны). Число протонов в ядре равно порядковому номеру элемента, а числе протонов и нейтронов соответствует его массовому числу. Протон (р) – элементарная частица, с массой 1,00728 а.е.м. и положительным зарядом, нейтрон (n) – тоже элементарная частица, с массой 1,00867 а.е.м., не обладающая зарядом. Число нейтронов равняется разности между массовым числом и порядковым номером: 20381Tl (81 р, 122 n); талий 20581Tl (81 р, 124 n). Число нейтронов в ядрах всех элементов может быть различным. Атомы с одинаковым зарядом ядра (и соответственно химическими свойствами), но разным числом нейтронов называются изотопами (3517Cl, 3717Cl). Каждый элемент представляет собой совокупность нескольких изотопов. Этим и объясняются дробные значения атомных масс: так, изотоп 35Cl в природе составляет 75,5%, а 37Cl – 24,5%; в результате средняя атомная масса хлора равна 35,5%. Изобары – химические элементы с одинаковыми массовыми числами, по разным зарядам ядер (4018Ar, 4019K, 4020Ca). Сформулированные выше положения составляют суть новой теории, описывающей движение микрочастиц, – квантовой механики. Наибольший вклад в развитие этой теории внесли Л. де Бройль, В. Гейзенберг, Э. Шредингер, П. Дирак. В соответствии с квантовой механикой движение электрона вокруг ядра атома нельзя рассматривать просто как механическое перемещение. Сложность и своеобразие такого движения детально и описывается уравнением Шредингера (иногда это уравнение называют волновым). Поскольку электрон обладает волновыми свойствами, то его движение можно описать с помощью так называемой волновой функции, обозначаемой греческой буквой ψ. Физический смысл волновой функции (х, у, z) таков, что квадрат абсолютного значения волновой функции |ψ(х,у,z)|2 пропорционален вероятности нахождения электрона в какой-либо точке пространства с координатами x, у, z. Наиболее важным следствием из квантовой механики является то, что вся совокупность сложных движений электрона в атоме описывается четырьмя квантовыми числами, главным п, побочным l, магнитным ml, спиновым ms.
Квантовые числа электронов
Главное квантовое число п определяет общую энергию электрона на данной орбитали (п = 1, 2, 3,...). Главное квантовое число для атомов известных элементов имеет семь значений: 1, 2, 3, 4, 5, 6, 7. Число энергетческих уровней в атом равно номеру периода, в котором элемент расположен. Побочное (орбитальное) квантовое число l (l = 0, 1, ..., п - 1) определяет различное энергетическое состояние электронов принадлежащих к различным подуровням данного энергетического уровня. Обычно численные значения l принято обозначать буквенными символами s, p, d, f. В этом случае говорят о s-, p-, d‑, f- орбиталях. Электрон с наибольшей вероятностью движется вокруг ядра, образуя электронное облако, форма которого в s-, p-, d‑, f- состояниях различна. Форма электронного облака зависит от значения побочного квантового числа l. Так, если l = 0 (s -орбиталь), то электронное облако имеет шаровидную форму (сферическую симметрию) и не обладает направленностью в пространстве. При l = 1 (р -орбиталь) электронное облако имеет форму гантели, т.е. форму тела вращения, полученного из «восьмерки». Формы электронных облаков d- и f -электронов намного сложнее. Форма и направленность в пространстве электронных облаков s - и р- орбиталей:
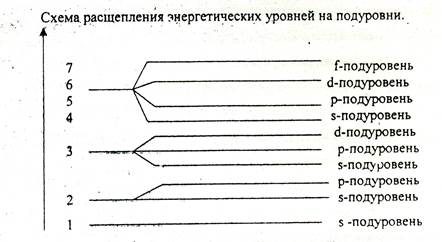
Первый уровень имее только s -подуровень, второй расщепляется на s - и р -подуровни, третий – на s-, p-, d- подуровни, четвертый, пятый, шестой и седьмой на s-, p-, d-, f- подуровни.
Магнитное квантовое число ml характеризует ориентацию орбитали в пространстве, обусловленную орбитальным магнитным моментом электрона, т.е. появлением магнитного поля (от - l до + l, включая 0, т.е. всего 2 l + 1). Каждый энергетический подуровень содержит определенное число орбиталей: s -подуровень состоит из одной орбитали, р -подуровень – из трех, d -подуровень – из пяти, f -подуровень – из семи орбиталей. Графически орбиталь изображается в виде квантовой (энергетической) ячейки.
Максимальное число электронов на одной орбитали определяется числом значений спинового квантового числа. Спиновое квантовое число тs отражает наличие у электрона собственного момента импульса (от анг. spin – вращение). Для всех электронов абсолютное значение спина всегда равно s = ½ (+½ или -½). Графически электроны с тs = +½ изображаются стрелкой ↑, а электроны с тs = -½ стрелкой ↓. Одну орбиталь могут занимать только электроны, имеющие противоположные спины, называют электронами с антипараллельными спинами и обозначают ↑↓.
|
||||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 336; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.36.215 (0.007 с.) |