Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Глава 24. Алкадиены (диеновые углеводороды)Содержание книги
Поиск на нашем сайте
Номенклатура и изомерия Алкадиены – непредельные углеводороды, содержащие две двойные связи. Общая формула алкадиенов СnН2n-2. Если двойные связи разделены в углеродной цепи двумя или более одинарными связями (например, пентадиен-1,4), то такие двойные связи называются изолированными. Химические свойства алкадиенов с изолированными двойными связями не отличаются от свойств алкенов с той лишь разницей, что в реакции могут вступать не одна, а две двойные связи независимо друг от друга. Если двойные связи разделены в цепи только одной σ-связью, то их называют сопряженными. Важнейшие представители сопряженных диенов:
Существуют также диены с системой С=С=С,называемые алленами; такие двойные связи называют кумулированными. Главную цепь в диенах выбирают так, чтобы она содержала обе двойные связи, и нумеруют с того конца, при котором сумма номеров положений двойных связей минимальна. В названии соответствующего алкана окончание - ан заменяется на - диен. В сопряженных диенах π-электронные облака двойных связей перекрываются между собой и образуют единое π-электронное облако. В сопряженной системе π-электроны уже не принадлежат определенным связям, они делокализованы по всем атомам, поэтому структуру диенов можно изобразить следующим образом (на примере бутадиена):
Пунктирные линии показывают область делокализации электронов и обозначают промежуточный порядок связи между С–С и С=С. Цепь сопряжения может включать большое число двойных связей. Чем она длиннее, тем больше делокализация π-электронов и тем устойчивее молекула. Для алкадиенов характерны те же виды изомерии, что и для алкенов: 1) изомерия углеродного скелета, 2) изомерия положения двойных связей и 3) цис- транс- изомерия. Физические свойства АлленСН2=С=СН2 – бесцветный газ tкип = –34,5 °С. Бутадиен-1,3 – легко сжижающийся газ с неприятным запахом. Изопрен – жидкость с tкип = 34 °С. Получение Основной промышленный способ получения диенов – дегидрирование алканов. Бутадиен-1,3 (дивинил) получают из бутана:
Изопрен (2-метилбутадиен-1,3) получают из 2-метилбутаца:
Бутадиен-1,3 можно также получить по реакции Лебедева путем одновременного дегидрирования и дегидратации этанола:
Химические свойства Для алкадиенов характерны обычные реакции электрофилъного присоединения АЕ, свойственные алкенам. Особенность сопряженных диенов состоит в том, что две двойные связи в их молекулах функционируют как единое целое, поэтому реакции присоединения могут протекать в двух направлениях: а) к одной из двойных связей (1,2-присоединение) или б) в крайние положения сопряженной системы с образованием новой двойной связи в центре системы (1,4-присоединение). Так, присоединение брома к бутадиену может привести одновременно к двум продуктам:
Подбор реагентов и условий реакций позволяет направлять присоединение по любому из двух направлений. Важнейшее свойство диенов – их способность к полимеризации, которая используется для получения синтетических каучуков. При полимеризации бутадиена-1,3, которая протекает как 1,4-присоединение, получают бутадиеновый каучук:
Использование металлоорганических катализаторов в этой реакции позволяет получить каучук с регулярным строением, в котором всезвенья цепи имеют цис-конфигурацию. Аналогичная реакция с изопреном дает синтетический изопреновый каучук, который по строению и свойствам близок к природному каучуку:
Применение Основная область применения алкадиенов – синтез каучуков. Глава 25. АЛКИНЫ (АЦЕТИЛЕНЫ) Номенклатура и изомерия Алкинами называют непредельные углеводороды, молекулы которых содержат одну тройную связь. Общая формула гомологического ряда алкиновСnН2n-2. Она совпадает с общей формулой алкадиенов, поэтому алкины и алкадиены являются межклассовыми изомерами. Первый представитель этого класса – ацетилен НС≡СН, в связи с чем алкины также называют ацетиленовыми углеводородами. Ближайшие гомологи ацетилена:
В алкинах с неразветвленной углеродной цепью нумерацию начинают с того конца, ближе к которому находится тройная связь. В названии соответствующего алкана окончание - ан заменяется на - ин. В разветвленных алкинах выбирают главную цепь так, чтобы она содержала тройную связь, даже если она при этом и не будет самой длинной. Перед названием главной цепи указывают номер атома углерода, при котором находится заместитель, и название этого заместителя. Номер после названия главной цепи указывает положение тройной связи, например:
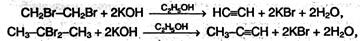
Атомы углерода при тройной связи находятся в состоянии sp-гибридизации. Две σ-связи, образованные гибридными орбиталями, располагаются по одной линии под углом 180° друг к другу; две π-связь образованы при перекрывании двух пар негибридных 2p-орбиталей соседних атомов углерода. Дополнительное связывание двух атомов углерода приводит к тому, что расстояние между ядрами уменьшается, поскольку тройная связь является сочетанием одной а- и двух π-связей. Длина тройной связи С≡С составляет 0,120 нм, что меньше длины как одинарной, так и двойной связи. Энергия тройной связи составляет 828 кДж/моль. Структурная изомерия алкинов обусловлена изомерией углеродного скелета (например, 3-метилбутин-1 и пентин-1) и изомерией положения тройной связи (бутин-1 и бутин-2). Пространственная изомерия для алкинов не характерна. Физические свойства Физические свойства алкинов похожи на свойства алканов и алкенов. При обычных условиях (С2 – С4) – газы, (C5 – C16) – жидкости, начиная с С17 – твердые вещества. Температуры кипения алкинов выше, чем у соответствующих алкенов. Так, этилен имеет tкип = –103 °С, ацетилен кипит при –83,6 °С; пропен и пропин соответственно при –47 °С и –23 °С. Растворимость низших алкинов в воде несколько выше, чем алкенов и алканов, однако она все же очень мала. Алкины хорошо растворимы в неполярных органических растворителях. Получение 1. Общий способ получения алкинов – отщепление двух молекул галогеноводорода от дигалогеналканов, которые содержат два атома галогена либо у соседних, либо у одного атома углерода, под действием спиртового раствора щелочи:
2. Гомологи ацетилена можно также получать, действуя галогеналканами на соли ацетиленовых углеводородов (ацетилениды):
Эта реакция представляет собой пример нуклеофильного замещения, а нуклеосфилом в ней является апетиленидный карбанион:
3. Ацетилен получают в промышленности путем высокотемпературного крекинга метана:
или его ближайших гомологов – этана и пропана, причем в этом случае ацетилен образуется при более низких температурах:
Сырьем в этих способах служит природный газ или нефть. В лабораторных условиях ацетилен получают гидролизом карбида кальция:
Химические свойства Химические свойства алкинов обусловлены наличием в их молекулах тройной связи. Типичными реакциями для ацетилена и его гомологов являются реакции электрофильного присоединения АE Отличие алкинов от алкенов заключается в том, что реакции присоединения могут протекать в две стадии. На первой стадии идет присоединение к тройной связи с образованием двойной связи, а на второй стадии – присоединение к двойной связи. Реакции присоединения для алкинов протекают медленнее, чем для алкенов. Этой объясняется тем, что π-электронная плотность тройной связи расположена более компактно, чем в алкенах, и поэтому менее доступна для взаимодействия с различными реагентами. 1. Галогенирование. Галогены присоединяются к алкинам в две стадии. Например, присоединение брома к ацетилену приводит к образованию дибромэтена, который, в свою очередь, реагирует с избытком брома с образованием тетрабромэтана:
суммарно:
Алкины, так же как и алкены, обесцвечивают бромную воду. 2. Гидрогалогенирование. Галогеноводороды присоединяются к тройной связи труднее, чем к двойной. Для активации галогеноводорода используют АlСl3 – сильную кислоту Льюиса. Из ацетилена при этом можно получить винилхлорид (хлорэтен), который используют для получения важного полимера – поливинилхлорида.
В случае избытка галогеноводорода происходит полное гидрогалогенирование, причем для несимметричных алкинов на каждой стадии присоединение идет по правилу Марковникова, например:
3. Гидратация (реакции Кучерова). Присоединение воды к алкинам катализируется солями ртути (II):
На первой стадии реакции образуется непредельный спирт, в котором гидроксильная группа находится непосредственно у атома углерода при двойной связи. Такие спирты принято называть виниловыми или енолами. Отличительной чертой енолов является их неустойчивость. В момент образования они изомеризуются в более стабильные карбонильные соединения (альдегиды или кетоны) за счет переноса протона от гидроксильной группы к соседнему атому углерода при двойной связи. При этом π-связь между атомами углерода разрывается, и образуется π-связь между атомом углерода и атомом кислорода. Причиной изомеризации является большая прочность двойной связи С=О по сравнению с двойной связью С=С. В результате реакции гидратации только ацетилен превращается в альдегид; гидратация гомологов ацетилена протекает по правилу Марковникова, и образующиеся енолы изомеризуются в кетоны. Так, например, пропин превращается в ацетон:
4. Кислотные свойства. Особенностью алкинов, имеющих концевую тройную связь, является их способность отщеплять протон под действием сильных оснований, т.е. проявлять слабые кислотные свойства. Возможность отщепления протона обусловлена сильной поляризацией σ-связи: ≡С←Н. Причиной поляризации является высокая электроотрицательность атома углерода в sp-гибридном состоянии. Поэтому алкины, в отличие от алкенов и алканов, способны образовывать соли, называемые ацетиленидами:
Ацетилениды серебра и меди (I) легко образуются и выпадают в осадок при пропускании ацетилена через аммиачный раствор оксида серебра или хлорида меди (I). Эти реакции служат для обнаружения алкинов с тройной связью на конце цепи.
Ацетилениды серебра и меди как соли очень слабых кислот легко разлагаются при действии хлороводородной кислоты свыделением исходного алкина:
Таким образом, используя реакции образования и разложения ацетиленидов, можно выделять алкины из смесей с другими углеводородами 5. Полимеризация. В присутствии катализаторов алкины могут реагировать друг с другом, причем в зависимости от условий образуются различные продукты. Так, под действием водного раствора CuCl и NH4CI ацетилен димерзуется, давая винилакдетилен:
Винилацетелен обладает большой реакционной способностью; присоединяя хлороводород, он образует хлоропрен, используемый для получения искусственного каучука:
При пропускании ацетилена над активированным углем при 600 °С происходит тримеризацш ацетилена с образованием бензола:
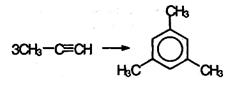
В аналогичные реакции тримергоации могут вступать также и ближайшие гомологи ацетилена, например:
6. Реакции окисления и восстановления. Алкины легко окисляются различными окислителями, в частности перманганатом калия. При этом раствор перманганата калия обесцвечивается, что служит указанием на наличие тройной связи. При окислении обычно происходит расщепление тройной связи, и образуются карбоновые кислоты:
В присутствии металлических катализаторов алкины восстанавливаются путем последовательного присоединения молекул водорода, превращаясь сначала в алкены, а затем в алканы:
Применение На основе ацетилена развились многие отрасли промышленности органического синтеза. Выше уже отмечена возможность получения уксусного альдегида из ацетилена и различных кетонов из гомологов ацетилена по реакции Кучерова. В свою очередь, большой интерес представляют реакции алкинов с кетонами. Например, реакцией ацетилена с ацетоном можно получить изопрен – исходный продукт для получения синтетического каучука. Хлоропрен также получают из винилацетилена (см. выше реакцию димеризации ацетилена). Ацетилен используется для сварки (кислородно-ацетиленовая сварка) металлов, поскольку при его горении развивается высокая температура.
Номенклатура и изомерия Ароматическими углеводородами (аренами) называют вещества, в молекулах которых содержится одно или несколько бензольных колец – циклических групп атомов углерода с особым характером связей. Рассмотрим строение молекулы бензола. Молекулярная формула бензола – СбН6. Первая структура бензола была предложена в 1865 г. немецким ученым А. Кекуле:
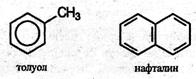
Эта формула правильно отражает равноценность шести атомов углерода, однако не объясняет ряд особых свойств бензола. Например, несмотря на ненасыщенность, бензол не проявляет склонности к реакциям присоединения: он не обесцвечивает бромную воду и раствор перманганата калия, т.е. не дает типичных для непредельных соединений качественных реакций. Поэтому вопрос о строении бензола привлекал внимание исследователей на протяжении десятков лет. Условно арены можно разделить на два ряда. К первому относят производные бензола (например, толуол), ко второму – конденсированные арены (простейший из них – нафталин):
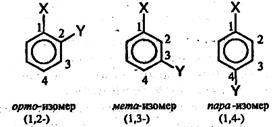
Рассмотрим гомологический ряд бензола с общей формулой CnH.2n-6. Структурная изомерия в ряду бензола обусловлена взаимным расположением заместителей в кольце. Если в бензольном кольце только один заместитель, то такое соединение не имеет ароматических изомеров, так как все атомы углерода в бензольном кольце равноценны. Если с кольцом связаны два заместителя, то они могут находиться в трех разных положениях относительно друг друга. Положение заместителей указывают цифрами или обозначают словами: орто (о-), мета (м-), пара ( n-):
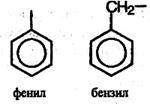
При отщеплении атома водорода от молекул ароматических углеводородов образуются ароматические радикалы общей формулы СnН2n-7 (их называют арильными радикалами), простейшие из которых – фенил и бензил:
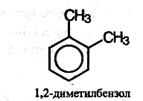
Название ароматических углеводородов происходит от слова «бензол» с указанием заместителей в бензольном кольце и их положения, например:
Особенности строения и свойств бензола удалось полностью объяснить только после развития современной квантовомеханической теории химических связей. По современным представлениям, все шесть атомов углерода в молекуле бензола находятся в sр2-гибридном состоянии. Каждый атом углерода образует σ-связи с двумя другими атомами углерода и одним атомом водорода, лежащие в одной плоскости. Валентные углы между тремя σ-связями равны 120°. Таким образом, все шесть атомов углерода лежат в одной плоскости, образуя правильный шестиугольник ( σ -скелет молекулы бензола). Каждый атом углерода имеет одну негибридную p-орбиталь. Шесть таких орбиталей располагаются перпендикулярно плоскому σ-скелету и параллельно друг другу. Все шесть р -электронов взаимодействуют между собой, образуя π -связи, не локализованные в пары, как при образовании обычных двойных связей, а образующие единое π -электронное облако. Таким образом, в молекуле бензола осуществляется круговое сопряжение. Наибольшая π-электронная плотность в этой сопряженной системе располагается над и под плоскостью σ-скелета. В результате все связи между атомами углерода в бензоле выравнены и имеют длину 0,139 нм. Эта величина является промежуточной между длиной одинарной связи в алканах (0,154 нм) и длиной двойной связи в алкенах (0,133 нм). Равноценность связей принято изображать кружком внутри цикла. Круговое сопряжение дает выигрыш в энергии 150 кДж/моль. Это значение составляет энергию сопряжения – количество энергии, которое нужно затратить, чтобы разрушить ароматическую систему бензола (сравните – энергия сопряжения в бутадиене равна всего 12 кДж/моль). Такое электронное строение объясняет все особенности бензола. В частности, понятно, почему бензол трудно вступает в реакции Совокупность свойств бензола принято называть проявлением ароматического характера, или ароматичности. В общем виде понятие ароматичности было сформулировано немецким физиком Э. Хюккелем в виде так называемого правила Хюккеля. Согласно этому правилу, ароматические молекулы должны иметь плоский циклический σ-скелет и число обобщенных π-электронов, равное 4n + 2, где n= 1, 2, 3 и т.д. Только в этом случае молекула будет обладать ароматическим характером. Число обобщенных π-электронов может быть 6, 10, 14 и т.д. Примерами служат выделяемые из каменноугольной смолы полиядерные конденсированные ароматические углеводороды – нафталин, антрацен, фенантрен. В них бензольные кольца соединены друг с другом линейно (как в антрацене) или нелинейно (как в фенантрене):
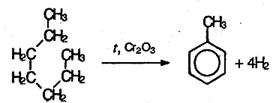
Физические свойства Первые члены гомологического ряда бензола – бесцветные жидкости со специфическим запахом. Они легче воды и в ней не растворимы. Хорошо растворяются в органических растворителях и сами являются хорошими растворителями для многих органических веществ. Бензол имеет характерный, достаточно приятный запах, но при этом сильно токсичен. Вдыхание паров бензола вызывает головокружение и головную боль. При высоких концентрациях бензола возможны случаи потери сознания. Его пары раздражают глаза и слизистую оболочку. Жидкий бензол проникает в организм через кожу, и это может привести к отравлению. Особенно опасно выпить бензол. Поэтому работа с бензолом (и его гомологами) требует особой осторожности. Способы получения 1. Получение из алифатических углеводородов. Для получения бензола и его гомологов в промышленности используют ароматизацию предельных углеводородов, входящих в состав нефти. При пропускании алканов с неразветвленной цепью, имеющих не менее 6 атомов углерода в молекуле, над нагретой платиной или оксидом хрома происходит дегидрирование с одновременным замыканием цикла (дегидроциклизация):
Из гексана при этом получается бензол, а из гептана – толуол. 2. Дегидрирование циклоалканов также приводит к ароматическим углеводородам. Реакция происходит при пропускании паров циклогексана и его гомологов над нагретой платиной:
3. Бензол можно получить при тримерпзации ацетилена. Реакция происходит при пропускании ацетилена над активированным углем при 600 °С:
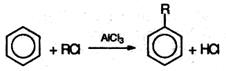
4. Гомологи бензола получают из бензола при его взаимодействии с алкилгалогенидами в присутствии галогенидов алюминия (реакция алкилирования, или Фриделя-Крафтса ):
5. При сплавлении солей ароматических кислот со щелочью выделяются арены в газообразном виде:
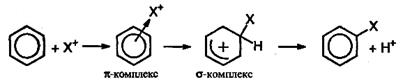
Химические свойства Ароматическое ядро, обладающее подвижной системой π-электронов, является удобным объектом для атаки электрофильными реагентами. Этому способствует также пространственное расположение π-электронного облака с двух сторон плоского σ-скелета молекулы. Для аренов наиболее характерны реакции, протекающие по механизму электрофилъного замещения, обозначаемого символом SE (от англ. substitution electrophilic). Механизм реакции SE можно представить следующим образом:
На первой стадии электрофильная частица X притягивается к π-электронному облаку и образует с ним π-комплекс. Затем два из шести π-электронов кольца образуют σ-связь между X и одним из атомов углерода. При этом ароматичность системы нарушается, т.к. в кольце остается только четыре π-электрона, распределенные между пятью атомами углерода (σ-комплекс). Для восстановления ароматичности σ-комплекс выбрасывает протон, а два электрона связи С-Н переходят в π-электронную систему.
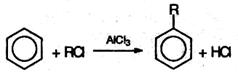
1. Галогенирование. Бензол и его гомологи взаимодействуют с хлором или бромом в присутствии катализаторов – безводных AlCl3, FeCl3,AlBr3 :
Из толуола по этой реакции получается смесь орто- и пара- изомеров (см.ниже). Роль катализатора заключается в поляризации нейтральной молекулы галогена с образованием из нее электрофильной частицы:
Нитрование. Бензол очень медленно реагирует с концентрированной азотной кислотой даже при сильном нагревании. Однако при действии нитрующей смеси (смеси концентрированных азотной и серной кислот) реакция нитрования проходит достаточно легко:
3. Сульфирование. Реакция легко проходит под действием «дымящей» серной кислоты (олеума):
4. Алкилирование по Фриделю-Крафтсу:
5. Алкилирование алкенами. Эти реакции широко используются в промышленности для получения этилбензола и изопропилбензола (кумола). Алкилирование проводят в присутствий катализатора АlСl3.Механизм реакции сходен с механизмом предыдущей реакции:
Все рассмотренные выше реакции протекают по механизму электрофильного замещения Se. Наряду с реакциями замещения, ароматические углеводороды могут вступать в реакции присоединения, однако эти реакции приводят к разрушению ароматической системы и поэтому требуют больших затрат энергии и протекают только в жестких условиях: 6. Гидрирование бензола идет при нагревании и высоком давлении в присутствии металлических катализаторов (Ni, Pt, Pd). Бензол превращается в циклогексан:
Гомологи бензола при гидрировании дают производные циклогексана:
7. Радикальное галогенирование бензола происходит при взаимодействии его паров с хлором только под воздействием жесткого ультрафиолетового излучения. При этом бензол присоединяет три молекулы хлора и образует твердый продукт – гексахлорциклогексан (гексахлоран) СбН6Сlб:
(атомы водорода в молекуле СбН6Сlб не указаны). 8. Окисление кислородом воздуха. По устойчивости к действию окислителей бензол напоминает алканы. Только при сильном нагревании (400 °С) паров бензола с кислородом воздуха в присутствии катализатора V2O5получается смесь малеиновой кислоты и ее ангидрида:
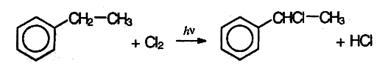
Гомологи бензола имеют ряд отличных от бензола химических свойств, связанных со взаимным влиянием алкильного радикала и бензольного кольца. Реакции в боковой цепи. По химическим свойствам алкильные радикалы подобны алканам. Атомы водорода в них замещаются на галоген по радикальному механизму (SR). Поэтому в отсутствие катализатора при нагревании или УФ облучении идет радикальная
Замещение в бензольном кольце возможно только по механизму Se в присутствии катализатора (АlСl3 или FeCl3). Замещение в: кольце происходит в орто- и пара- положения по отношению к алкильному радикалу:
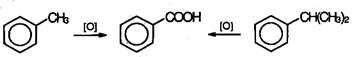
При действии перманганата калия и других сильных окислите лей на гомологи бензола боковые цепи окисляются. Какой бы сложной ни была цепь заместителя, она разрушается, за исключением он атома углерода, который окисляется в карбоксильную группу. Гомологи бензола с одной боковой цепью дают бензойную кислоту:
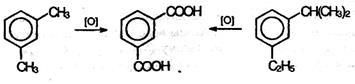
Гомологи, содержащие две боковые цепи, дают двухосновные кислоты:
|
||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 980; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.169 (0.011 с.) |

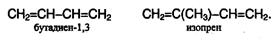
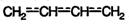
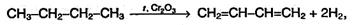
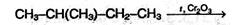

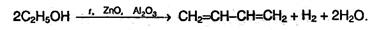
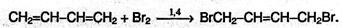
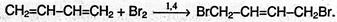

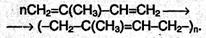

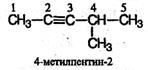
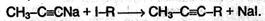
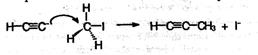
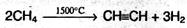


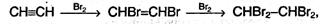
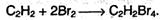


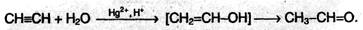
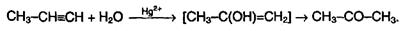
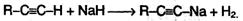
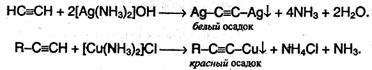
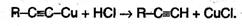

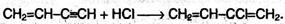
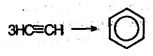

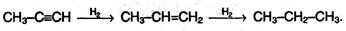
 Глава 26. АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ (АРЕНЫ)
Глава 26. АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ (АРЕНЫ)
 присоединения – это приводит к нарушению сопряжения. Такие реакции возможны только в очень жестких условиях.
присоединения – это приводит к нарушению сопряжения. Такие реакции возможны только в очень жестких условиях.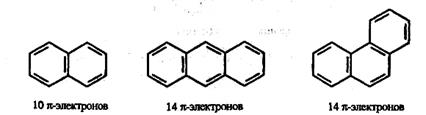

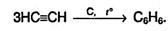
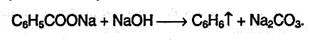
 По механизму электрофильного замещения протекают следующие реакции ароматических углеводородов:
По механизму электрофильного замещения протекают следующие реакции ароматических углеводородов: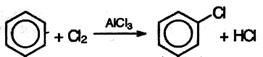
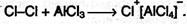
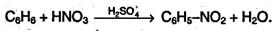


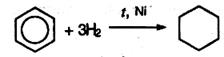
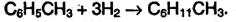
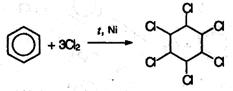

 реакция замещения в боковой цепи. Влияние бензольного кольца на алкильные заместители приводит к тому, что в первую очередь замещается атом водорода у атома углерода, непосредственно связанного с бензольные кольцом (α-атома углерода).
реакция замещения в боковой цепи. Влияние бензольного кольца на алкильные заместители приводит к тому, что в первую очередь замещается атом водорода у атома углерода, непосредственно связанного с бензольные кольцом (α-атома углерода).