Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Биологическое значение белковСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Биологическое значение белковчрезвычайно велико. 1.Абсолютно все химические реакции в организме протекают в присутствии катализаторов – ферментов. Даже такая простая реакция как гидратация углекислого газа катализируется ферментом карбоангидразой. Все известные ферменты представляют собой белковые молекулы. Белки – это очень мощные и, самое главное, селективные катализаторы. Они ускоряют реакции в миллионы раз, причем для каждой реакции существует свой фермент. 2. Некоторые белки выполняют транспортные функции и пере носят молекулы или ионы в места синтеза или накопления. Например, содержащийся в крови белок гемоглобин переносит кислород к тканям, а белок миоглобин запасает кислород в мышцах. 3. Белки – это строительный материал клеток. Из них построены опорные, мышечные, покровные ткани. 4 Белки играют важную роль в иммунной системе организма. Существуют специфические белки (антитела), которые способны распознавать и связывать чужеродные объекты – вирусы, бактерии, чужие клетки. 5. Белки-рецепторы воспринимают и передают сигналы, поступающие от соседних клеток или из окружающей среды. Например, действие света на сетчатку глаза воспринимается фоторецептором родопсином. Рецепторы, активизируемые низкомолекулярными веществами типа ацетилхолина, передают нервные импульсы в местах соединения нервных клеток. Из приведенного перечня функции белков ясно, что белки жизненно необходимы любому организму и являются, следовательно, важнейшей составной частью продуктов питания. В процессе пищеварения белки гидролизуются до аминокислот, которые служат исходным сырьем для синтеза белков, необходимых данному организму. Существуют аминокислоты, которые организм не в состоянии синтезировать сам и приобретает их только с пищей. Эти аминокислоты называют незаменимыми. Для человека незаменимы триптофан, лейцин, изолейцин, валин, треонин, лизин, метионин и фенилаланин. Глава 34. ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
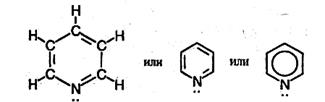
Гетероциклические соединения – органические соединения, содержащие в своих молекулах циклы, в образовании которых принимают участие неуглеродные атомы (гетероатомы). Гетероциклические соединения классифицируют по числу атомов в цикле и по типу гетероатома. В данной главе мы рассмотрим только некоторые азотсодержащие гетероциклы, производные которых имеют важное биохимическое значение. Шестичленные гетероциклы Пиридин C5H5N – простейший шестичленный ароматический гетероцикл с одним атомом азота. Его можно рассматривать как аналог бензола, в котором одна группа СН заменена на атом азота:
По электронному строению пиридин напоминает бензол. Все атомы углерода и атом азота находятся в состоянии sp2-гибридизации. Шесть электронов (по одному от каждого атома), находящихся на негибридных орбиталях, образуют π-электронную ароматическую систему. Из трех гибридных орбиталей атома азота две вступают в образование σ-связей C-N, a третья содержит неподеленную пару электронов. Пиридин – бесцветная жидкость, немного легче воды, с характерным неприятным запахом; с водой смешивается в любых отношениях. Пиридин выделяют из каменноугольной смолы, в которой его содержание 0,08%. В лабораторных условиях пиридин можно синтезировать из синильной кислоты и ацетилена:
Химические свойствапиридина определяются наличием ароматической системы и атома азота с неподеленной электронной парой. 1. Основные свойства. Пиридин – более слабое основание, чем алифатические амины (Кb = 1,7-10-9). Его водный раствор окрашивает лакмус в синий цвет:
При взаимодействии пиридина с сильными кислотами образуются соли пиридиния:
1. Основные свойства. Пиридин – более слабое основание, чем алифатические амины (Кb = 1,7-10-9). Его водный раствор окрашивает лакмус в синий цвет: 2. Ароматические свойства. Подобно бензолу, пиридин вступает в реакции электрофильного замещения, однако его активность в этих реакциях ниже, чем бензола, из-за большой электроотрицательности атома азота. Пиридин нитруется при 300 °С с низким выходом:
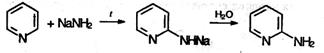
Атом азота в реакциях электрофильного замещения ведет себя как заместитель 2-го рода, поэтому электрофильное замещение происходит в мета -положение. В отличие от бензола, пиридин способен вступать в реакции нуклеофильного замещения, поскольку атом азота оттягивает на себя электронную плотность из ароматической системы, и орто - и пара- положения по отношению к атому азота обеднены электронами. Так, пиридин может реагировать с амидом натрия, образуя смесь орто- и пара аминопиридинов (реакция Чичибабина):
3. При гидрировании пиридина образуется пиперидин, который представляет собой циклический вторичный амин и является гораздо более сильным основанием, чем пиридин:
4. Гомологи пиридина по свойствам похожи на гомологи бензола. Так, при окислении боковых цепей образуются соответствующие карбоновые кислоты:
Никотиновая кислота и ее амид – важные лекарственные препараты (витамин РР). Пиримидин C4H4N2– шестичленный гетероцикл с двумя атомами азота. Его можно рассматривать как аналог бензола, в котором две группы СН заменены на атомы N:
Благодаря наличию в кольце двух электроотрицательных атомов азота, пиримидин еще менее активен в реакциях электрофильного замещения, чем пиридин. Его основные свойства также выражены слабее, чем у пиридина. Основное значение пиримидина состоит в том, что он является родоначальником класса пиримидиновых оснований. Пиримидиновые основания – производные пиримидина, остатки которых входят в состав нуклеиновых кислот: урацил, тимин, цитозин.
Каждое из этих оснований может существовать в двух формах (это явление называют лактим-лактамной таутомерией). В свободном состоянии основания существуют в ароматической форме, а в состав нуклеиновых кислот они входят в NH-форме. Пятичленные гетероциклы Пиррол C4H4NH – пятичленный гетероцикл с одним атомом азота.
Атомы углерода и атом азота находятся в состоянии sp2-гибридизации. 4 электрона, находящиеся на не гибридных орбиталях атомов углерода, и 2 электрона на негибридной орбитали атома азота образуют π-электронную ароматическую систему. В отличие от пиридина, электронная пара атома азота в пирроле входит в состав ароматической системы, поэтому пиррол практически лишен основных свойств. Пиррол – бесцветная жидкость с запахом, напоминающим запах хлороформа. Пиррол слабо растворим в воде (< 6%), но растворим в органических растворителях. На воздухе быстро окисляется и темнеет. Пиррол получают конденсацией ацетилена с аммиаком
или аммонолизом пятичленных циклов с другими гетероатомами – фурана и тиофена (реакция Юрьева):
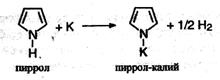
Химические свойства пиррола: 1. Сильные минеральные кислоты могут вытягивать электронную пару атома азота из ароматической системы, при этом ароматичность нарушается, и пиррол превращается в неустойчивое соединение, которое сразу полимеризуется. Неустойчивость пиррола в кислой среде называют «ацидофобностью». 2. Пиррол проявляет свойства очень слабой кислоты. Он реагирует с калием, образуя пиррол-калий:
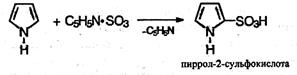
3. Пиррол как ароматическое соединение склонен к реакциям электрофильного замещения, которые протекают преимущественно у α-атома углерода (соседнего с атомом азота). Поскольку пиррол под действием кислот полимеризуется, то для проведения замещения используют реагенты, не содержащие протонов. Так, для нитрования пиррола используют ацетилнитрат:
а для сульфирования – комплекс пиридина с оксидом серы (VI):
4. При гидрировании пиррола образуется пирролидин – циклический вторичный амин, проявляющий значительные основные свойства.
Интересными свойствами обладают пятичленные ароматические гетероциклы, содержащие два атома азота, – имидазол и пиразол C3H4N2:
Эти соединения амфотерны. Один атом азота (пиридинового типа) в них проявляет слабые основные свойства и способен принимать протон, а другой атом азота (пиррольного типа) входит в состав группы NH, которая проявляет слабые кислотные свойства и способна отдавать протон. Благодаря этому появляется возможность переноса протона между двумя атомами азота и некоторые производные имидазола ипиразола могут существовать в виде быстро переходящих друг в друга таутомерных форм:
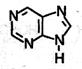
Пурин – гетероцикл, включающий два сочлененных цикла: пиримидиновый иимидазольный.
Ароматическая система пурина включает 10 π-электронов (8 электронов двойных связей и два неподеленных электрона пиррольного атома азота). Пурин – амфотерное соединение. Слабые основные свойства пурина связаны с атомами азота шестичленного цикла, а слабые кислотные свойства – с группой NHпятичленного цикла. Основное значение пурина состоит в том, что он является родоначальником класса пуриновых оснований. Пуриновые основания – производные пурина, остатки которых входят в состав нуклеиновых кислот: аденин, гуанин.
Нуклеиновые кислоты Строение нуклеиновых кислот Нуклеиновые кислоты – это природные высокомолекулярные соединения (полинуклеотиды), которые играют огромную роль в хранении и передаче наследственной информации в живых организмах. Молекулярная масса нуклеиновых кислот может меняться от 100 тыс. до 60 млрд. Они были открыты и выделены из клеточных ядер еще в XIX веке, однако их биологическая роль была выяснена только во второй половине XX века. Строение нуклеиновых кислот можно установить, анализируя продукты их гидролиза. При полном гидролизе нуклеиновых кислот образуется смесь пиримидиновых и пуриновых оснований, моносахарид (β-рибоза или β-дезоксирибоза) и фосфорная кислота. Это означает, что нуклеиновые кислоты построены из фрагментов этих веществ.
При частичном гидролизе нуклеиновых кислот образуется смесь нуклеотидов. Нуклеотид – основная структурная единица нуклеиновых кислот, их мономерное звено, молекулы которых построены из остатков фосфорной кислоты, моносахарида (рибозы или дезоксирибозы) и азотистого основания (пуринового или пиримидинового). Остаток фосфорной кислоты связан с 3-м или 5-м атомом углерода моносахарида, а остаток основания – с первым атомом углерода моносахарида. Общие формулы нуклеотидов:
где X = ОН для рибонуклеотидов, построенных на основе рибозы, и X = Н для дезоксирибонуклеотидов, построенных на основе дезокскрибозы. В зависимости от типа азотистого основания, различают пуриновые и пиримидиновые нуклеотиды. Нуклеиновые кислоты, состоящие из рибонуклеотидов, называют рибонуклеиновыми кислотами (РНК). Нуклеиновые кислоты, состоящие из дезоксирибонуклеотидов, называют дезоксирибонуклеиновыми кислотами (ДНК). В состав молекул ДНК входят нуклеотиды, содержащие аденин, гуанин, цитозин и тимин. В состав молекул РНК входят нуклеотиды, содержащие основания аденин, гуанин, цитозин и урацил (вместо тимина). Для обозначения оснований используют однобуквенные сокращения: аденин – А, гуанин – G, тимин – Т, цитозин – С, урацил – U. Свойства ДНК и РНК определяются последовательностью оснований в полинуклеотидной цепи и пространственным строением цепи. Последовательность оснований содержит генетическую информацию, а остатки моносахаридов и фосфорной кислоты играют структурную роль (носители оснований). При частичном гидролизе нуклеотидов отщепляется остаток фосфорной кислоты, и образуются нуклеозиды, молекулы которых состоят из остатка пуринового или пиримидинового основания, связанного с остатком моносахарида – рибозы или дезоксирибозы Ниже приведены структурные формулы основных пуриновых и пиримидиновых нуклеозидов:
В молекулах ДНК и РНК отдельные нуклеотиды связаны в единую полимерную цепь за счет образования сложноэфирных связей между остатками фосфорной кислоты и гидроксильными группами при 3-м и 5-м атомах углерода моносахарида.
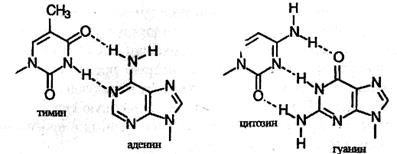
1. Молекула ДНК представляет собой двойную спираль и состоит из двух полинуклеотидных цепей, закрученных в противоположные стороны вокруг общей оси. 2. Пуриновые и пиримидиновые основания расположены внутри спирали, а остатки фосфата и дезоксирибозы – снаружи. 3. Диаметр спирали 20 Л (2 нм), расстояние между соседними основаниями вдоль оси спирали 3,4 А, они повернуты относительно друг друга на 36°. Таким образом, на полный виток спирали (360°) приходится 10 нуклеотидов, что соответствует длине спирали по оси 34 А. Две спирали удерживаются вместе водородными связями между парами оснований. Важнейшее свойство ДНК – избирательность в образовании связей (комплементарность). Размеры оснований и двойной спирали подобраны в природе таким образом, что тимин (Т) образует водородные связи только с аденином (А), а цитозин (С) – только с гуанином (G). Обратите внимание на то, что в первой паре оснований две водородные связи, а во второй паре – три.
Схема образования водородных связей в молекуле ДНК Таким образом, две спирали в молекуле ДНК комплементарны друг другу. Последовательность нуклеотидов в одной из спиралей однозначно определяет последовательность нуклеотидов в другой. В каждой паре оснований, связанных водородными связями, одно из оснований – пуриновое, а другое – пиримидиновое. Отсюда следует, что общее число остатков пуриновых оснований в молекуле ДНК равно числу остатков пиримидиновых оснований. Двухспиральная структура ДНК с комплементарными полинуклеотидными цепями обеспечивает возможность самоудвоения (репликации) этой молекулы. Этот сложный процесс можно упрощенно представить следующим образом. Перед удвоением водородные связи разрываются, и две цепи раскручиваются и расходятся. Каждая цепь затем служит матрицей для образования на ней комплементарной цепи. Таким образом, после репликации образуются две дочерние молекулы ДНК, в каждой из которых одна спираль взята из родительской ДНК, а другая (комплементарная) синтезирована заново. Синтез новых цепей происходит с участием фермета ДНК-полимеразы. Длина полинуклеотидных цепей ДНК практически неограничена. Число пар оснований в двойной спирали может меняться от нескольких тысяч у простейших вирусов до сотен миллионов у человека. Каждой тысяче пар оснований соответствует длина оси спирали (называемая контурной длиной) 3400 А и молекулярная масса примерно 660 тыс. В отличие от ДНК, молекулы РНК состоят из одной полинуклеотидной цепи. Число нуклеотидов в цепи колеблется от 75 до нескольких тысяч, а молекулярная масса РНК может изменяться в пределах от 25 тыс. до нескольких млн. Полинуклеотидная цепь РНК не имеет строго определенной структуры. Она может складываться сама на себя и образовывать отдельные двухцепочечные участки с водородными связями между пуриновыми и пиримидиновыми основаниями. Водородные связи в РНК не подчиняются таким строгим правилам, как в ДНК. Так, гуанин (G) может образовывать водородные связи как с урацилом (U), так и с цзатозином (С). Поэтому двухцепочечные участки РНК некомплементарны, и нуклеотидный состав РНК может меняться в широких пределах.
|
||||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 1436; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.116.15.124 (0.009 с.) |















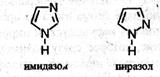







 Пространственная структура полинуклеотидных цепей ДНК и РНК была определена методом рентгеноструктурного анализа. Одним из самых крупных открытий биохимии XX века оказалась модель трехмерной структуры ДНК, которую предложили в 1953 г Дж. Уотсон и Ф. Крик. Эта модель состоит в следующем.
Пространственная структура полинуклеотидных цепей ДНК и РНК была определена методом рентгеноструктурного анализа. Одним из самых крупных открытий биохимии XX века оказалась модель трехмерной структуры ДНК, которую предложили в 1953 г Дж. Уотсон и Ф. Крик. Эта модель состоит в следующем.