Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Сравнение органических и неорганических веществСодержание книги Похожие статьи вашей тематики
Поиск на нашем сайте ШАБЛОНЫ ЛЕКЦИЙ ПО ХИМИИ 10 класс
Ф.И.О._________________________________ Группа_________________________________
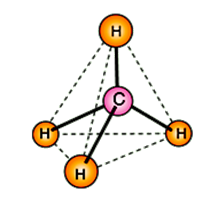
Лекция №1 «Теория химического строения органических соединений А.М.Бутлерова» 1.Предпосылки возникновения теории химического строения. 2. Изомерия, изомеры. 3. Валентность. 4. Химическое строение. 5. Теория химического строения органических соединений. 6. Гомологический ряд и гомологическая разность. 7. Формулы молекулярные и структурные. 8. Классификация реакций по типу реагирующих веществ и принципу изменения состава молекулы. 1. Предпосылки возникновения теории химического строения. Подобно тому, как в неорганической химии, основополагающей теоретической базой являются Периодический закон и Периодическая система химических элементов Д.И.Менделеева, так в органической химии ведущей научной основой служит __________________________ ____________________________________________________________.
Теория строения органических соединений явилась результатом обобщения огромного материала, который был накоплен к началу 19 века. Открывались всё новые и новые соединения углерода.
Соединения углерода обладали и обладают в настоящее время рядом характерных особенностей, отличающих их от большинства неорганических соединений.
Сравнение органических и неорганических веществ
Объяснить многообразие органических соединений учёные 19 века не могли. Ещё больше вопросов вызывало явление изомерии.
2. Изомерия. Изомеры.
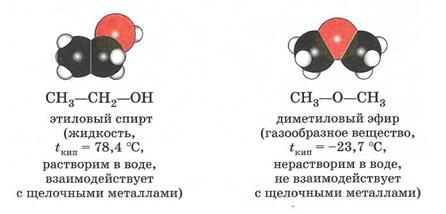
Например: этиловый спирт и диметиловый эфир – С2Н6О
Типы изомерии Структурная изомерия А) изомерия цепи (углеродного скелета) ________________________________________________________________________________________________________________________________________________________________________________________________ Б ) изомерия кратной связи ________________________________________________________________________________________________________________________________________________________________________________________________ В) изомерия положения функциональной группы (заместителей в углеродной цепи) _______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Пространственная изомерия А) геометрическая изомерия(цис -, транс – изомерия) ________________________________________________________________________________________________________________________________________________________________________________________________ Б) оптическая изомерия ________________________________________________________________________________________________________________________________________________________________________________________________ 3). Межклассовая изомерия (изомерия веществ, принадлежащих к разным классам).
Ф.Вёлер, в одном из писем к Й.Я.Берцелиусу так описывал органическую химию: «Органическая химия сейчас может кого угодно свести с ума. Она кажется мне дремучим лесом, полным удивительных вещей, безграничной чащей, из которой нельзя выбраться, куда не осмеливаешься проникнуть…» Валентность Большое влияние на развитие химии оказали работы английского учёного Э.Франкланда, который, опираясь на идеи атомистики, в 1853 году ввёл понятие ______________________________.
В молекуле Н2 образуется одна ковалентная химическая связь, Н – Н т.е. водород одновалентен. Валентность химического элемента можно выразить числом атомов водорода, которые присоединяет к себе другой химический элемент, например: В органической химии понятие «валентность» является -_______________ ________________________________________. Однако это не одно и то же. Например:
Для ионных соединений используют термин «степень окисления», а для молекулярных (органических веществ) используют термин «валентность». Химическое строение.
Теория химического строения (Т.Х.С.) – результат обобщения идей выдающихся учёных-органиков из 3х европейских стран: немца Ф.Кекуле, англичанина А.Купера и русского А.Бутлерова.
В 1857 году Ф.Кекуле отнёс углерод к четырёхвалентным элементам, а в 1858 году он одновременно с А.Купером отметил, что атомы углерода способны соединяться друг с другом в различные цепи: ЛИНЕЙНЫЕ
РАЗВЕТВЛЁННЫЕ
ЗАМКНУТЫЕ
Теория химического строения органических соединений.
Основные положения Т.Х.С. 1.______________________________________________________________________________________________________________________________________________________________________________________________ ________________________________________________________________________________________________________________________________ _____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ 2. _____________________________________________________________ ________________________________________________________________
3. ____________________________________________________________________________________________________________________________________________________________________________________ 4. ____________________________________________________________________________________________________________________________________________________________________________________ Гомологический ряд и гомологическая разность. Органические соединения можно расположить в ряды сходных по составу, строению и свойствам – гомологические ряды.
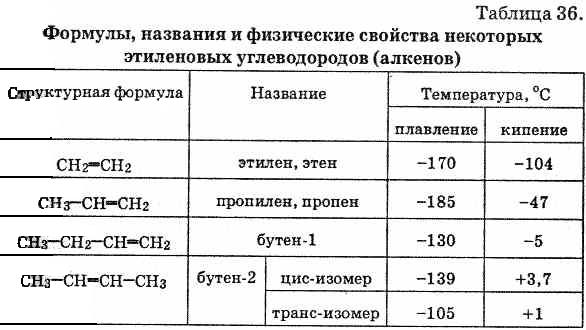
Например: ____________________________________________________________________________________________________________________________________ Для гомологических рядов можно вывести общую формулу, для «Алканов» она СnH2n+2 Лекция №2 «ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ В ОРГАНИЧЕСКОЙ ХИМИИ. АЛКАНЫ. ЦИКЛОАЛКАНЫ» 1. Общая характеристика предельных углеводородов. Номенклатура и гомологический ряд алканов. 2. Физические свойства алканов. Основные способы получения. 3. Строение и химические свойства предельных углеводородов. Радикально-цепной механизм реакции в алканах. 4. Циклоалканы. Особые свойства циклопропана и циклобутана. 1.Общая характеристика предельных углеводородов. Номенклатура и гомологический ряд алканов. Углеводороды - ______________________________________________ ____________________________________________________________________________________________. Предельными углеводородами, или алканами (международное название), называются ______________________________ __________________ где n - число атомов углерода. В молекулах предельных углеводородов атомы углерода связаны между собой ___________________ связью, а все остальные валентности насыщены атомами водорода. Алканы называют также насыщенными углеводородами или парафинами. Номенклатура Первым членом гомологического ряда алканов является ____________. Окончание -ан является характерным для названий предельных углеводородов. Далее следует __________, ______________, _____________. Начиная с пятого углеводорода, название образуется из греческого числительного, указывающего число углеродных атомов в молекуле, и окончания -ан. Это _______________________________________ _______________________________________. Алканы, начиная с четвертого члена ряда (бутана), имеют изомеры. Чтобы подчеркнуть, что алкан имеет неразветвленную углеродную цепь, часто к названию добавляют слово нормальный (н-), например: __________________________________________________________________ н-бутан н-гептан (нормальный бутан) (нормальный гептан) При отрыве атома водорода от молекулы алкана образуются одновалетные частицы, называемые__________________________________ (сокращенно обозначаются буквой R). Названия одновалентных радикалов производятся от названий соответствующих углеводородов с заменой окончания –ан на ___. Вот соответствующие примеры:
При отнятии от молекулы углеводорода двух атомов водорода получаются _____________________. Их названия также производятся от названий соответствующих предельных углеводородов с заменой окончания -ан на: –илиден: _________________________________________________________________________________________________________________________________ - илен: ________________________________________________________ ______________________________________________________________ Радикал СН2= имеет название ____________. Для названия изомеров широко применяют три номенклатуры: 1._________________________________________________________________2._____________________________________________________________________________________________________________________________________________________________________________________________________ 3. _________________________________________________________________________________________________________________________________
По рациональной номенклатуре углеводороды рассматриваются как ______________________________________________________________________________________________________________________________________________________________________________________________________Если в формуле одинаковые радикалы повторяются несколько раз, то их указывают греческими числительными: ди - два, три - три, тетра - четыре, пента - пять, гекса - шесть и т. д. Например: _______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Рациональная номенклатура удобна для не очень сложных соединений. По заместительной номенклатуре основой для названия служит 1. _________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ 2. _____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ 3. _________________________________________________________________________________________________________________________________________________________________________________ 4. _______________________________________________________________________________________________________________________ Если в формуле содержится несколько одинаковых радикалов, то перед их названием указывают число прописью (ди-, три-, тетра- и т. д.), а номера радикалов разделяют запятыми. Вот как по этой номенклатуре следует назвать изомеры гексана:
А вот более сложный пример:
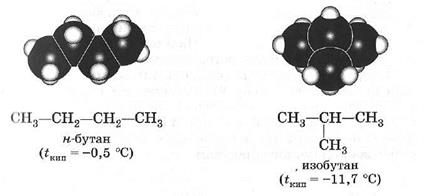
При написании формул изомеров легко заметить, что атомы углерода занимают в них неодинаковое положение. Атом углерода, ________________ ___________________________________, называется первичным, с двумя - вторичным, с тремя - третичным, с четырьмя - четвертичным. Например _______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Правило Марковникова №1 _________________________________ ________________________________________________________________________________________________________________________________ 2. Физические свойства алканов. Основные способы получения. В обычных условиях первые четыре члена гомологического ряда алканов (С1 — С4) — __________. Нормальные алканы от пентана до гептадекана (C5 — C17) — __________________, начиная с С18 и выше — т-______________________. По мере увеличения числа атомов углерода в цепи, т.е. с ростом относительной молекулярной массы, возрастают __________ __________________________________________________________________. При одинаковом числе атомов углерода в молекуле алканы с разветвленным строением имеют более низкие температуры кипения, чем нормальные алканы. Алканы практически нерастворимы в ___________, так как их молекулы малополярны и не взаимодействуют с ____________________, они хорошо растворяются в___________________________________________, таких как бензол. СПОСОБЫ ПОЛУЧЕНИЯ АЛКАНОВ Основные природные источники алканов — _____________________ ___________. Различные фракции нефти содержат алканы от C5H12 до С30Н62. Природный газ состоит_____________________________________ __________________.
Из синтетических методов получения алканов можно выделить следующие: 1. Получение из ненасыщенных углеводородов. ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________2. Получение из галогенпроизводных (реакция Вюрца): ____________________________________________________________________________________________________________________________________ 3. Получение из солей карбоновых кислот. ______________________________________________________________________________________________________________________________________________________________________________________________________4. Получение метана. В электрической дуге, горящей в атмосфере водорода, образуется значительное количество метана: __________________________________________________________________Такая же реакция идет при нагревании углерода в атмосфере водорода до 400-500 °С при повышенном давлении в присутствии катализатора. 5. В лабораторных условиях метан часто получают из карбида алюминия: __________________________________________________________________ 3. Строение и химические свойства предельных углеводородов. Радикально-цепной механизм реакции в алканах. В предельных углеводородах ______________________________________
Все алканы насыщены водородом до предела (максимально). Их атомы углерода находятся в состоянии ___________________, а значит, имеют ______________________ связи. В обычных условиях алканы химически _____________. Они устойчивы к действию многих реагентов: не взаимодействуют с концентрированными серной и азотной кислотами, с концентрированными и расплавленными щелочами, не окисляются сильными окислителями - перманганатом калия KMnО4 и т.п. Химическая устойчивость алканов объясняется высокой прочностью ________________ __________________________. Неполярные связи С-С и С-Н в алканах не склонны к ионному разрыву, но способны расщепляться гомолитически под действием активных свободных радикалов. Поэтому для алканов характерны ____________________________, в результате которых получаются соединения, где атомы водорода замещены на другие атомы или группы атомов. Следовательно, алканы______________________________________ _________________________________________________________________. По этому механизму легче всего замещаются атомы водорода ____________ ____________________________________________________________________________________________________________________________________ 1. Галогенирование. При взаимодействии алканов с галогенами (хлором и бромом) под действием УФ-излучения или высокой температуры. Общая схема этой реакции показана на примере метана: Сl2 Сl2 Сl2 Сl2 СН4 → СН3Сl → СН2Сl2 → СНСl3 → ССl4 -HCl -HCl -НСl -HCl Реакция образования хлорметана протекает по цепному механизму, который характеризуется следующими стадиями: а) инициирование цепи: hv __________________________________________________________________ б) рост цепи. __________________________________________________________________ __________________________________________________________________Эти реакции повторяются до тех пор, пока не произойдет обрыв цепи по одной из реакций: в) обрыв цепи: ___________________________________________________________________________________________________________________________________ Суммарное уравнение реакции: ____________________________________________________________________________________________________________________________________ Развитие теории цепных свободнорадикальных реакций тесно связано с именем выдающегося русского ученого ___________________(1896-1986). 2. Нитрование (реакция Коновалова). При действии разбавленной азотной кислоты на алканы при 140°С и небольшом давлении протекает радикальная реакция: ____________________________________________________________________________________________________________________________________ 3. Изомеризация. Нормальные алканы при определенных условиях могут превращаться в алканы с разветвленной цепью: ______________________________________________________________________________________________________________________________________________________________________________________________________ 4. Крекинг —_________________________________________________ ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________Эти реакции имеют большое промышленное значение. Таким путем высококипящие фракции нефти (мазут) превращают в бензин, керосин и другие ценные продукты. 5. Окисление. При мягком окислении метана кислородом воздуха в присутствии различных катализаторов могут быть получены метиловый спирт, формальдегид, муравьиная кислота: ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Мягкое каталитическое окисление бутана кислородом воздуха - один из промышленных способов получения уксусной кислоты: ____________________________________________________________________________________________________________________________________ 6. На воздухе алканы сгорают до СО2 и Н2О: СН4 + 2О2→СО2 +2Н2О
4. Циклоалканы. Особые свойства циклопропана и циклобутана.
Циклоалканы-_______________________________________________. Простейшие представители этого ряда:
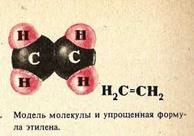
__________________________________________________________________ Общая формула гомологического ряда циклоалканов _________. Точно такой же формулой описывается гомологический ряд _________. Из чего следует, что каждому циклоалкану изомерен соответствующий алкен. Это пример так называемой ____________________________________ изомерии. Строение циклоалканов. Каждый атом углерода в циклоалканах находится в состоянии __________________ и образует__________________________________. Углы между связями зависят от размера цикла. В простейших циклах С3 и С4 углы между связями С-С сильно отличаются от тетраэдрического угла 109,5°, что создает в молекулах напряжение и обеспечивает их высокую реакционную способность. Свободное вращение вокруг связей С-С, образующих цикл, _____________________. Изомерия и номенклатура. 1) Для циклоалканов как и для всех классов органических соединений, характерна ________________________________________________________. 2) Отсутствие свободного вращения вокруг связей С-С в цикле создает предпосылки для существования ______________________________________ __________________________________________________________________. Например, в молекуле 1,2-диметилциклопропана две группы СН3 могут находиться по одну сторону от плоскости цикла (цис-изомер) или по разные стороны (транс-изомер): ______________________________________________________________________________________________________________________________________________________________________________________________________ цис-изомер транс-изомер По размеру цикла циклоалканы делятся на ряд групп - __________ (С3, С4) и ___________________ (С5-С7) циклы. Названия циклоалканов строятся путем добавления приставки цикло- к названию алкана с соответствующим числом атомов углерода. Структурные формулы циклоалканов обычно записывают в сокращенном виде, используя геометрическую форму цикла и опуская символы атомов углерода и водорода. ______________________________________________________________________________________________________________________________________________________________________________________________________ Физические свойства. При обычных условиях первые два члена ряда (С3 - С4) — _______, (С5 - С16) — ________________, начиная с C17 — _____________________. Температуры кипения и плавления циклоалканов выше, чем у соответствующих алканов. Получение. 1. Основной способ получения циклоалканов - отщепление двух атомов галогена от дигалогеналканов: ______________________________________________________________________________________________________________________________________________________________________________________________________ 2. Каталитическое гидрирование ароматических углеводородов: ______________________________________________________________________________________________________________________________________________________________________________________________________ Химические свойства. По химическим свойствам малые и обычные циклы существенно различаются между собою. Циклопропан и циклобутан склонны к реакциям ________________________, т.е. сходны в этом отношении с алкенами. Циклопентан и циклогексан по своему химическому поведению близки к алканам, так как вступают в реакции _____________________. 1. Так, например, циклопропан и циклобутан способны присоединять бром: ______________________________________________________________________________________________________________________________________________________________________________________________________ 2. Циклопропан, циклобутан и даже циклопентан могут присоединять водород: ______________________________________________________________________________________________________________________________________________________________________________________________________ 3. В реакцию присоединения с галогеноводородами опять же вступают только малые циклы. Присоединение к гомологам циклопропана происходит по правилу Марковникова: ______________________________________________________________________________________________________________________________________________________________________________________________________ 4. Реакции замещения: ____________________________________________________________________________________________________________________________________5. Дегидрирование циклоалканов: ____________________________________________________________________________________________________________________________________ ЛЕКЦИЯ №3 «Алкены, алкадиены. Алкины» 1. Общая характеристика алкенов. Номенклатура и изомерия. Строение. Получение и свойства. 2. Общая характеристика диеновых угдеводородов. Номенклатура и изомерия. Строение. Получение и свойства. 3. Общая характеристика алкинов. Номенклатура и изомерия. Строение. Получение и свойства. 1. Общая характеристика алкенов. Номенклатура и изомерия. Строение. Получение и свойства. Простейшими непредельными (ненасыщенными) соединениями являются углеводороды, содержащие _________________________________. Алкены, содержащие две двойные связи, называются ___________, содержащие три двойные связи — ______________ и т.д. Соединения с несколькими двойными связями имеют общее название ________________. Алкенами называются___________________________________________ ______________________________________________________________. Первый представитель этого класса — _______________________________ Ближайшие гомологи этилена: ____________________________________________________________________________________________________________________________________Простейший алкен с разветвленным углеродным скелетом: ____________________________________________________________________________________________________________________________________ Общая формула гомологического ряда алкенов __________.
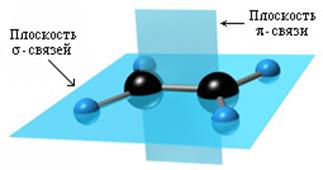
СТРОЕНИЕ Атомы углерода при двойной связи находятся в состоянии __________________. Три s-связи, образованные гибридными орбиталями, располагаются в одной плоскости ____________________________________; p-связь образована _________________________________________________
Структурная изомерия алкенов обусловлена ________ ______________________________________________________________. Если каждый из атомов углерода при связи С=С связан с двумя разными заместителями, то эти заместители могут располагаться __________________ Эти два изомера нельзя перевести друг в друга без вращения вокруг двойной связи С=С, а это вращение требует разрыва p-связи и затраты большого количества энергии. Поэтому цис- и транс-изомеры представляют собой _____________________________________________________________________________________________________________________________________________. Алкены, у которых хотя бы один из атомов углерода при связи С=С имеет два одинаковых заместителя, _______________________________. В алкенах с неразветвленной углеродной цепью нумерацию начинают __________________________________________________________________. В названии соответствующего алкана окончание _______________________. В разветвленных алкенах выбирают ________________________________ __________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Физические свойства алкенов ________ на свойства алканов, хотя все они имеют несколько __________________ температуры плавления и кипения, чем соответствующие ___________. Например, пентан имеет температуру кипения 36 °С, а пентен-1 — 30 °С. При обычных условиях алкены С2 - С4 — ___________. С5 – С15 — ____________, начиная с C16 — _____________________. Алкены _________________в воде, хорошо растворимы в органических растворителях.
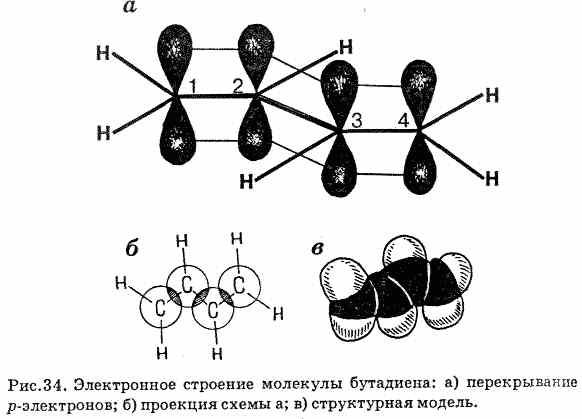
Типы связей в алкадиенах Изолированные связи - ____________________________________________ ________________________________________________________________________________________________________________________________ Например: ____________________________________________________________________________________________________________________________________ Сопряженные связи - ____________________________________________ ______________________________________________________________ Важнейшие представители сопряженных диенов: ____________________________________________________________________________________________________________________________________ Кумулированные связи- _________________________________. Например: _________________________________________________________________________________________________________________________________ Рассмотрим только сопряженные диены, имеющие большое практическое значение. В сопряженных диенах p-электронные облака двойных связей перекрываются ___________________________________________________ __________________________________________________________________ Пунктирные линии показывают область __________________ электронов и обозначают промежуточный порядок связи между С-С и С = С. Цепь сопряжения может включать большое число двойных связей. Чем она длиннее, тем больше ___________________ p-электронов и тем ____________ молекула.
Для алкадиенов характерны те же виды изомерии, что и для алкенов: 1) ________________________________________________________________ 2) ________________________________________________________________ 3) ________________________________________________________________ Номенклатура. Главную цепь в диенах выбирают так, чтобы она содержала ______________, и нумеруют с того конца, при котором__________________
Физические свойства. Бутадиен-1,3 — ______________________________ Получение. 1. дегидрирование алканов. ____________________________________________________________________________________________________________________________________ ____________________________________________________________________________________________________________________________________2. Бутадиен-1,3 можно также получать по реакции Лебедева путем одновременного дегидрирования и дегидратации этанола: ____________________________________________________________________________________________________________________________________ Химические свойства. Для алкадиенов характерны обычные реакции_____________________________________, свойственные алкенам. Особенность сопряженных диенов состоит в том, что__________________ ____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Важнейшее свойство диенов — их способность к полимеризации, которая используется для получения _______________________. При полимеризации бутадиена-1,3, которая протекает как 1,4-присоединение, получают бутадиеновый каучук: __________________________________________________________________ Применение. Основная область применения алкадиенов - ________________.
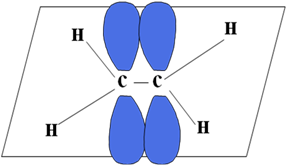
3. Общая характеристика алкинов. Номенклатура и изомерия. Строение. Получение и свойства. Алкинами называются _____________________________________ Первый представитель этого класса — ________________. Ближайшие гомологи ацетилена: __________________________________________________________________________________________________________________________________________________________________________________________________Общая формула гомологического ряда алкинов ___________. Она совпадает с общей формулой алкадиенов, поэтому алкины и алкадиены являются ______________________________________________________________. Строение. Атомы углерода при тройной связи находятся в состоянии ______________________. Две s-связи, образованные гибридными орбиталями, располагаются________________________________________ Структурная изомерия алкинов обусловлена изомерией ________________________ (например, 3-метилбутин-1 и пентин-1) и изомерией _______________________(бутин-1 и бутин-2). Пространственная изомерия для алкинов ______________________. Номенклатура. В алкинах с неразветвленной углеродной цепью нумерацию начинают с того конца, ближе к которому находится __________________. В названии соответствующего алкана окончание __________________________.В разветвленных алкинах выбирают главную цепь так, чтобы она содержала _______________, даже если она при этом и не будет самой длинной. Перед названием главной цепи указывают _____________________, при котором находится заместитель, и название этого заместителя. Номер после названия главной цепи указывает положение тройной связи, например:
4-метилбутин-2 Физические свойства алкинов_________ на свойства алканов и алкенов. При обычных условиях (С2 – С4) — _________, (C5 – C16) — ______________, начиная с C17 — __________________. Температуры кипения алкинов _________, чем у соответствующих алкенов. Растворимость низших алкинов в воде несколько _________, чем алкенов и алканов, однако она все же очень мала. Алкины хорошо растворимы в неполярных органических растворителях. Получение. 1. отщепление двух молекул галогеноводорода от дигалогеналканов: ____________________________________________________________________________________________________________________________________ 2. Гомологи ацетилена можно также получать, действуя галогеналканами на соли ацетиленовых углеводородов: __________________________________________________________________ 3. Высокотемпературного крекинг метана: __________________________________________________________________ В лабораторных условиях ацетилен получают гидролизом карбида кальция: ______________________________________________________________ Химические свойства алкинов Обусловлены наличием в их молекулах _______________. Типичными реакциями для ацетилена и его гомологов являются реакции ___________________________. Отличие алкинов от алкенов заключается в том, что реакции присоединения могут протекать в ______________. На первой стадии идет присоединение к тройной связи с образованием двойной связи, а на второй стадии — присоединение к двойной связи. Реакции присоединения для алкинов протекают ______________, чем для алкенов. 1. Галогенирование. Вr2 Вr2 СН ≡ СН → СНВr = СНВr → СНВr 2- СНВr2 Алкины, так же, как и алкены, __________________ бромную виду. 2. Гидрогалогенирование. Галогеноводороды присоединяются к тройной связи ______________, чем к двойной. Для активации галогеноводорода используют АlСl3 — сильную кислоту Льюиса. ____________________________________________________________________________________________________________________________________В случае избытка галогеноводорода происходит полное гидрогалогенирование: ____________________________________________________________________________________________________________________________________3. Гидратация. Присоединение воды к алкинам катализируется солями ртути (II) - ____________________ ________________________________________________________________________________________________________________________________ 4. Кислотные свойства. Особенностью алкинов, имеющих концевую тройную связь, является их способность отщеплять протон под действием сильных оснований, т.е. проявлять слабые кислотные свойства. Поэтому алкины, в отличие от алкенов и алканов, способны образовывать соли, называемые ацетиленидами: __________________________________________________________________ 5. Полимеризация. При пропускании ацетилена над активированным углем при 600 °С происходит тримеризация ацетилена с образованием бензола: __________________________________________________________________ В аналогичные реакции тримеризации могут вступать также и ближайшие гомологи ацетилена, например:
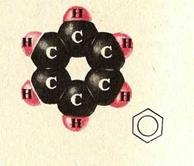
Лекция №4 «Бензол и его гомологи. Галогенпроизводные углеводородов» 1. Общая характеристика ароматических углеводородов. Применение. 2. Физические и химические свойства ароматических углеводородов. Способы получения. 3.Взаимное влияние атомов в бензольном кольце. 4. Галогенпроизводные углеводородов. 1. Общая характеристика ароматических углеводородов. Применение. Ароматические углеводороды - важнейшее сырье для синтеза ценных веществ. Из простейшего представителя ароматических УВ бензола получают _____________________________________ Бензол применяется как компонент ______________________________ ______________________________________________________________________________________________________________________________________________________________________________________________________ Ароматическими называются соединения, _________________________ ____________________________________________________________________________________________________________________________________ Международное название ароматических углеводородов - ____________ Простейшим представителем аренов является ____________. Формула, отражающая строение молекулы бензола, была впервые предложена немецким химиком ____________ (1865):
Атомы углерода в молекуле бензола образуют __________________________ ________________________________________________________________ |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-06-29; просмотров: 1126; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.014 с.) |