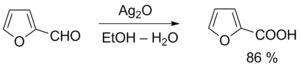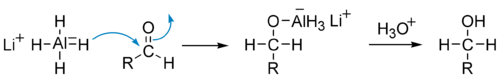Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Реакции сопряжённого присоединенияСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Присоединение к α,β-ненасыщенным альдегидам может протекать с образованием 1,2- и 1,4-продуктов Присоединение нуклеофильных реагентов к α,β-ненасыщенным альдегидам может протекать как по карбонильной группе, так и по «четвёртому» положению сопряжённой системы. Причина этого заключается в том, что двойная углерод-углеродная связь поляризуется под действием полярной карбонильной группы (мезомерный эффект), и дальний от карбонильной группы атом углерода двойной связи приобретает частичный положительный заряд. Реакция нуклеофила с данным атомом углерода называется сопряжённым присоединением, или 1,4-присоединением. Присоединение к карбонильной группе по аналогии называют 1,2-присоединением. Формальным результатом 1,4-присоединения является присоединение нуклеофила по углерод-углеродной двойной связи. Во многих случаях 1,2- и 1,4-присоединение являются конкурирующими реакциями, однако иногда удаётся проводить селективные реакции с получением продуктов 1,2- либо 1,4-присоединения. Присоединение первичных и вторичных аминов к α,β-ненасыщенным альдегидам протекает в мягких условиях и приводит к образованию 1,4-продукта. Напротив, в случае циановодорода наблюдается конкурентное образование обоих продуктов с преобладанием продукта 1,2-присоединения. Чтобы в данной реакции исключить возможность 1,2-присоединения, используют специальный реагент —диэтилалюминийцианид (C2H5)2AlCN. Литийорганические соединения присоединяются исключительно по карбонильной группе, давая аллиловые спирты. Сопряжённое присоединение проводят под действием медьорганических реагентов — диалкилкупратов, которые позволяют ввести в карбонильное соединение не только первичную, но также вторичную или третичную алкильную, алкенильную или арильную группу. Магнийорганические реагенты (реактивы Гриньяра), полученные из магния сверхвысокой чистоты, также присоединяются с образованием 1,2-продуктов, в то время как обыкновенные реактивы Гриньяра, предположительно из-за примесей других металлов (например, меди и железа) вступают и в 1,2-, и в 1,4-присоединение, что регулируется пространственными факторами. В настоящее время магнийорганические реагенты утратили своё значение в данной области.
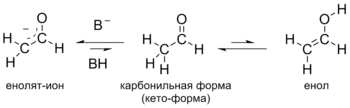
Борорганические соединения (триалкилбораны) реагируют с непредельными альдегидами, давая продукты 1,4-присоединения Реакции α-метиленового звена Альдегиды вступают в реакцию с галогенами (хлором, бромом или иодом), образуя галогенпроизводные, при этом галогенирование осуществляется исключительно в α-положение (в положение, соседнее с карбонильной группой)[37]. Альдегиды проявляют свойства слабых кислот: под действием оснований они способны отщеплять протон от α-метиленовой группы, превращаясь в енолят-ион. Обычно для достаточно полного депротонирования используют сильные основания (гидрид натрия, гидрид калия, диизопропиламид лития и др.) в апротонных растворителях (тетрагидрофуран, ДМСО). Превращение карбонильной формы альдегидов в енольную форму протекает и в отсутствие сильных оснований. Образующиеся при этом енолы, как правило, намного менее стабильны, чем карбонильная форма, например, для ацетальдегида константа равновесия — только 6·10−5 при комнатной температуре[38]). Данное равновесие, существующее между карбонильной и енольной формами называется кето-енольной таутомерией.
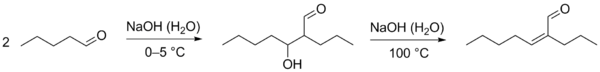
Благодаря способности образовывать енолят-ионы альдегиды вступают в ряд химических реакций, где эти частицы выступают как нуклеофилы. В частности, для них характерны реакции конденсации. В слабоосновной среде (в присутствии ацетата,карбоната или сульфита калия) подвергаются альдольной конденсации, в ходе которой часть молекул альдегида выступает как карбонильная компонента (реагирует карбонильной группой), а часть молекул альдегида под действием основания превращается в енолят-ионы и выступает как метиленовая компонента (вступает в реакцию α-метиленовым звеном). Образующийся альдоль при нагревании отщепляет воду с образованием α,β-непредельного альдегида (переход от предельного альдегида к непредельному через альдоль называется кротоновой конденсацией или альдольно-кротоновой конденсацией).
При реакции между двумя разными альдегидами образуется смесь четырёх различных альдолей. Исключение составляют случаи, когда разделение реагентов на карбонильную и метиленовую компоненту очевидно (например, один из альдегидов не содержит α-метиленового звена и может выполнять роль только карбонильной компоненты). Разработаны также методы повышения селективности подобных реакций. Перекрёстная конденсация ароматических альдегидов с кетонами, получила название реакции Кляйзена — Шмидта. Известны также схожие реакции альдегидов: реакция Кнёвенагеля, реакция Тищенко, реакция Перкина, бензоиновая конденсация и другие.
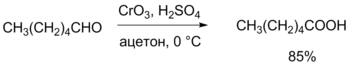
Реакции окисления Окисление альдегидов до соответствующих карбоновых кислот кислородом протекает по радикально-цепному механизму (автоокисление) с образованием промежуточных продуктов — пероксокислот. Альдегиды легко окисляются до соответствующих карбоновых кислот под действием разнообразных окислителей. Наиболее часто используются перманганат калия, а также реагент Джонса (CrO3 + H2SO4), который даёт наилучшие результаты (в течение короткого времени при низкой температуре достигается более чем 80%-ый выход карбоновой кислоты). Реагент Джонса также не лишён недостатков, в частности, он недостаточно селективен и окисляет другие функциональные группы, а кислая среда способствует нежелательной изомеризации или разложению субстрата[41].
Избежать этих проблем можно при использовании более мягкого окислителя — реактива Толленса (аммиачного раствора оксида серебра), который не затрагивает кратные связи и гидроксильные группы спиртов. Эта реакция широко применяется для обнаружения альдегидов (реакция «серебряного зеркала»)[41].
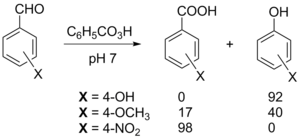
Окисление метиленовых групп в α-положении альдегидов диоксидом селена приводит к образованию 1,2-дикарбонильных соединений. Альдегиды медленно окисляются на воздухе при комнатной температуре. Этот радикальный процесс ускоряется при облучении или в присутствии ионов Fe2+. Ароматические альдегиды подвергаются окислению легче, чем алифатические. Данная реакция не имеет синтетического значения, однако её протекание необходимо учитывать при хранении альдегидов: желательно хранить их в темноте и инертной атмосфере. Ароматические альдегиды также окисляются до карбоновых кислот или сложных эфиров фенолов (реакция Байера — Виллигера) под действием надкислот, причём соотношение продуктов зависит как от заместителей в ароматическом ядре, так и от кислотности среды[42].
Реакции восстановления Альдегиды можно восстанавливать до первичных спиртов. Наиболее распространённые методы восстановления включают реакции с комплексными гидридами: боргидридом натрия NaBH4, боргидридом лития LiBH4 и алюмогидридом лития LiAlH4. Боргидрид натрия является более избирательным реагентом и позволяет восстанавливать карбонильную группу альдегидов и кетонов, не затрагивая сложноэфирные, нитрильные, амидные, лактонные и оксирановые группы. Он также не восстанавливает изолированную двойную углерод-углеродную связь. Алюмогидрид лития менее селективен и восстанавливает перечисленные выше функциональные группы, поэтому восстановление альдегидов с его применением возможно только в отсутствие этих групп.
Историческую роль играет реакция Меервейна — Пондорфа — Верлея, в которой в качестве восстановителя используется изопропилат алюминия. В настоящее время этот метод вытеснен более эффективной реакцией восстановления альдегидов и кетонов изопропиловым спиртом в присутствии окиси алюминия. Алифатические альдегиды обычно не гидрируют на палладиевых катализаторах, но для этих целей можно использовать рутений на угле, никель Ренея или платину.
|
|||||||
|
Последнее изменение этой страницы: 2016-09-18; просмотров: 537; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.252.243 (0.011 с.) |