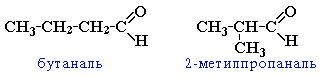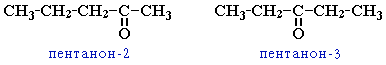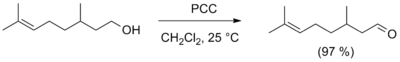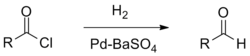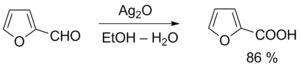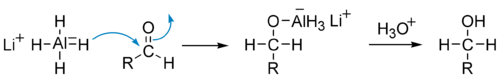Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Систематическая номенклатураСодержание книги Поиск на нашем сайте
Этимология Слово альдегид было придумано Юстусом фон Либихом как сокращение латинского alcohol dehydrogenatus — дегидрированный спирт (в некоторых источниках — alcohol dehydrogenatum). Название радикала формил, а также другие однокоренные слова (формальдегиды, формиаты), произошли от лат. formica — муравей. Тривиальные названия В популярной и научной литературе можно нередко встретить исторические, или тривиальные, названия альдегидов, которые вследствие сложившейся традиции используются вместо систематических названий. Тривиальные названия обычно происходят от названия соответствующих карбоновых кислот, а также от названия источника, из которого был выделен тот или иной альдегид. Так, например, формальдегид называют муравьиным альдегидом, этаналь— уксусным, пентаналь— валериановым альдегидом, цитронеллаль получил своё название, поскольку был выделен из масла цитрусовых. Исторически сложилось, что парфюмеры называют многие пахучие вещества альдегидами, даже те, которые не имеют ничего общего с ними. Среди таковых, например, персиковый, земляничный и кокосовый альдегид, которые являются не альдегидами, а сложными эфирами или лактонами. Также некоторые альдегиды традиционно называются по числу атомов углерода, например, персиковый альдегид, обозначаемый как «альдегид C14», на самом деле имеет лишь 11 атомов углерода. Систематическая номенклатура По номенклатуре ИЮПАК названия простых альдегидов образуются от названий соответствующих алканов с добавлением суффикса -аль, а диальдегидов — суффикса -диаль (в данном случае атом углерода альдегидной группы уже входит в состав родоначального алкана). При этом в названии номер при альдегидной группе, как правило, не ставят, поскольку она всегда занимает крайнее положение. Если карбонильная группа не входит в родоначальную структуру (например, если родоначальной структурой является циклический углеводород или геьероцикл), то к названию добавляется суффикс - карбальдегид. Если в данном соединении альдегидная группа не является старшей, то в таких случаях её обозначают используя приставку формил -, указывая её положение. В устаревших Женевской (1892) и Льежской (1930) номенклатурах, впоследствии заменённых систематической номенклатурой ИЮПАК, альдегиды обозначались при помощи суффикса – ал.
Классификация альдегидов Альдегиды классифицируются следующим образом (в скобках приведены примеры): · В зависимости от насыщенности углеводородного заместителя: · предельные (насыщенные) альдегиды (ацетальдегид); · непредельные (ненасыщенные) альдегиды (акролеин); · ароматические альдегиды (бензальдегид). · По числу карбонильных групп: · альдегиды с одной карбонильной группой (формальдегид); · диальдегиды (глиоксаль); · многоатомные альдегиды.
Изомерия альдегидов и кетонов Для альдегидов и кетонов характерна структурная изомерия. Изомерия альдегидов:
изомерия углеродного скелета, начиная с С4 · межклассовая изомерия с кетонами, начиная с С3 · циклическими оксидами (с С2) · непредельными спиртами и простыми эфирами (с С3) ·
Изомерия кетонов: углеродного скелета (c C5)
положения карбонильной группы (c C5)
Межклассовая изомерия (аналогично альдегидам). Методы синтеза альдегидов Лабораторные методы получения альдегидов Окислительные методы · Для получения альдегидов в лабораторных условиях часто используется реакция окисления первичных спиртов реагентами, представляющими собой комплексные соединения оксида хрома(VI) с третичными аминами, в частности, лучшими реагентами являются комплекс с пиридином (CrO3 · 2C5H5N, реагент Саррета — Коллинза) и хлорхмат пиринидия · (C5H5N+CrO3Cl-, реагент Кори, PCC). Данные реагенты позволяют получать альдегиды с высоким выходом, а хлорхромат пиридиния также не затрагивает двойную связь. Для этих же целей применяют и другие селективные окислители, например Оксид марганца (4) MnO2, карбонат серебра на цеолите, а также диметилсульфоксид в присутствии основания (окисление по Сверну).
· Как метод получения альдегидов может использоваться восстановительный озонолиз симметричных дизамещённых алкенов либо циклических алкенов (в данном случае реакция приводит в образованию диальдегида). Аналогичное превращение может быть проведено под действием смеси OsO4 и NaIO4.
· Также к данному типу реакций относится окисление вицинальных диолов йодной кислотой или тетраацетатом свинца.
· Важным методом также является гидробронирование — окисление алкинов, в ходе которого к алкину против правила Марковникова присоединяется диалкилборан (например,дисиамилборан), а полученный продукт окисляется щелочным раствором пероксида водорода, что приводит к образованию альдегида.
Восстановительные методы Ряд производных карбоновых кислот (хлорангидриды, сложные эфиры, нитрилы, амиды) могут быть восстановлены до альдегидов под действием специфических восстановителей. · Так, например, в реакции Розенмунда хлорангидриды восстанавливают под действием водорода на палладиевом катализаторе. Аналогичное превращение можно провести под действием три(трет -бутокси)алюмогидрида лития.
· Сложные эфиры селективно восстанавливаются до альдегидов под действием диизобутилалюминийгидрида. Другие методы Альдегиды также можно получать реакциями гидратации алкинов (реакция Кучерова), пиролизом карбоновых кислот и их смесей в виде паров над оксидами некоторых металлов (ThO2, MnO2, CaO, ZnO) при 400—500 °C, гидролизом геминальных дигалогенопроизводных (если атомы галогена находятся у одного из крайних атомов углерода) и другими реакциями. Строение Атом углерода в карбонильной группе находится в состоянии sp2 -гибридизации. Углы R-C-H, R-C-O и H-C-O составляют приблизительно 120° (где R — алкил). Двойная связь карбонильной группы сходна по физической природе с двойной связью между углеродными атомами, однако в то же время энергия связи С=О (749,4 кДж/моль) больше, чем энергия двух простых связей (2×358 кДж/моль) C-O. С другой стороны, кислород является более электроотрицательным элементом, чем углерод, и потому электронная плотность вблизи атома кислорода больше, чем вблизи атома углерода. Дипольный момент карбонильной группы составляет ~9·10−30 Кл·м. Длина связи С=О составляет 0,122 нм. Поляризация двойной связи «углерод-кислород» по принципу мезомерного сопряжения позволяет записать следующие резонансные структуры:
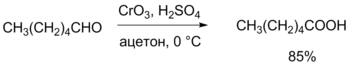
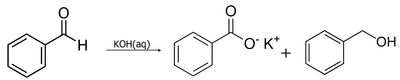
Подобное разделение зарядов подтверждается физическими методами исследования и во многом определяет реакционную способность альдегидов как выраженных электрофилов и позволяет им вступать в многочисленные реакции нуклеофильного присоединения. Химические свойства Высокая реакционная способность связана с наличием полярной связи С=О. Альдегиды являются жёсткими основаниями Льюиса и, в соответствии с этим, атом кислорода в них может координироваться с жёсткими кислотами: H+, ZnCl2, BF3, AlCl3и т. д. В общем случае химические свойства альдегидов аналогичны кетонам, однако альдегиды проявляют бо́льшую активность, что связано с большей поляризацией связи. Кроме того, для альдегидов характерны реакции, не характерные для кетонов, например гидратация в водном растворе. Реакции окисления Окисление альдегидов до соответствующих карбоновых кислот кислородом протекает по радикально-цепному механизму (автоокисление) с образованием промежуточных продуктов — пероксокислот. Альдегиды легко окисляются до соответствующих карбоновых кислот под действием разнообразных окислителей. Наиболее часто используются перманганат калия, а также реагент Джонса (CrO3 + H2SO4), который даёт наилучшие результаты (в течение короткого времени при низкой температуре достигается более чем 80%-ый выход карбоновой кислоты). Реагент Джонса также не лишён недостатков, в частности, он недостаточно селективен и окисляет другие функциональные группы, а кислая среда способствует нежелательной изомеризации или разложению субстрата[41].
Избежать этих проблем можно при использовании более мягкого окислителя — реактива Толленса (аммиачного раствора оксида серебра), который не затрагивает кратные связи и гидроксильные группы спиртов. Эта реакция широко применяется для обнаружения альдегидов (реакция «серебряного зеркала»)[41].
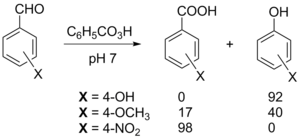
Окисление метиленовых групп в α-положении альдегидов диоксидом селена приводит к образованию 1,2-дикарбонильных соединений. Альдегиды медленно окисляются на воздухе при комнатной температуре. Этот радикальный процесс ускоряется при облучении или в присутствии ионов Fe2+. Ароматические альдегиды подвергаются окислению легче, чем алифатические. Данная реакция не имеет синтетического значения, однако её протекание необходимо учитывать при хранении альдегидов: желательно хранить их в темноте и инертной атмосфере. Ароматические альдегиды также окисляются до карбоновых кислот или сложных эфиров фенолов (реакция Байера — Виллигера) под действием надкислот, причём соотношение продуктов зависит как от заместителей в ароматическом ядре, так и от кислотности среды[42].
Реакции восстановления Альдегиды можно восстанавливать до первичных спиртов. Наиболее распространённые методы восстановления включают реакции с комплексными гидридами: боргидридом натрия NaBH4, боргидридом лития LiBH4 и алюмогидридом лития LiAlH4. Боргидрид натрия является более избирательным реагентом и позволяет восстанавливать карбонильную группу альдегидов и кетонов, не затрагивая сложноэфирные, нитрильные, амидные, лактонные и оксирановые группы. Он также не восстанавливает изолированную двойную углерод-углеродную связь. Алюмогидрид лития менее селективен и восстанавливает перечисленные выше функциональные группы, поэтому восстановление альдегидов с его применением возможно только в отсутствие этих групп.
Историческую роль играет реакция Меервейна — Пондорфа — Верлея, в которой в качестве восстановителя используется изопропилат алюминия. В настоящее время этот метод вытеснен более эффективной реакцией восстановления альдегидов и кетонов изопропиловым спиртом в присутствии окиси алюминия. Алифатические альдегиды обычно не гидрируют на палладиевых катализаторах, но для этих целей можно использовать рутений на угле, никель Ренея или платину.
Другие реакции Альдегиды, не имеющие атомов водорода при α-углеродном атоме (то есть имеющие общую формулу R3CCHO) под действием водно-спиртового раствора щёлочи вступают в реакцию Канниццаро, в которой одновременно выступают в ролиокислителя и восстановителя. Сфера применения данного процесса расширяется за счёт перекрёстной реакции Канниццаро, протекающей между ароматическим альдегидом и формальдегидом в присутствии щёлочи. При этом восстановителем является формальдегид, а другой альдегид восстанавливается до соответствующего спирта.
Альдегиды могут вступать в реакции с илидами фосфора по реакции Виттига, образовывая алкены с заданной конфигурацией двойной связи (как правило, образуются Z -алкены, но разработаны и модификации, позволяющие получать E -алкены). В данное время это один из лучших методов региоспецифического синтеза алкенов.
Также альдегиды взаимодействуют с илидами серы, давая оксираны (реакция Кори — Чайковского). Альдегиды подвергаются реакции декарбонилирования в присутствии некоторых комплексов переходных металлов, например, катализатора Уилкинсона[48]. Биологическое действие Токсичны. Способны накапливаться в организме. Кроме общетоксического, обладают раздражающим и нейротоксическим действием. Эффект зависит от молекулярной массы: чем она больше, тем слабее раздражающее, но сильнее наркотическое действие, причём ненасыщенные альдегиды токсичнее насыщенных. Некоторые обладают канцерогенными свойствами. Альдегиды раздражают слизистые оболочки глаз и верхних дыхательных путей, вредно влияют на нервную систему. С увеличением числа атомов углерода в молекуле раздражающее действие ослабевает. Ненасыщенные альдегиды обладают более сильным раздражающим действием, чем насыщенные. Ацетальдегид СН3СНО вызывает возбуждение, сменяющееся наркозом. Он является промежуточным продуктом метаболизма этилового спирта в организме. Действие тримера этого альдегида — паральдегида (С2Н40)3 — сильнее и продолжительнее, в то время как тетрамер — метальдегид (С2Н40)4 — является более токсичным. Удлинение алкильного радикала в молекуле альдегида приводит к усилению физиологической активности, но вместе с этим возрастает и токсичность. Введение галогена в молекулу альдегида повышает его наркотическое (снотворное) действие. Так, наркотические свойства хлораля более выражены, чем у ацетальдегида. Альдегидная группа усиливает токсичность вещества, но она может быть значительно снижена путём образования гидратной формы альдегида. Гидратные формы мало токсичны, в такой форме хлораль применяется в медицине под названием хлоралгидрата, проявляющего снотнорное действие. Введение гидроксильных групп в молекулу альдегида или конденсация их с образованием альдолей существенно снижает реакционную способность, а также физиологическую активность соединений. Так, сахара представляют собой фармакологически инертные вещества. Большинство ароматических альдегидов имеет низкую токсичность, так как они легко окисляются до соответствующих кислот, которые обычно довольно инертны.
Применение
Важнейшие альдегиды и родственные соединения. Альдегидная (формильная группа) обозначена красным. Слева направо: (1) формальдегид, (2) его тример, (3) ацетальдегид и (4) его енол виниловый спирт, (5) глюкоза, (6) ароматизатор коричный альдегид, (7) пигмент ретиналь и (8) витамин пиридоксаль Из всех альдегидов больше всего производится формальдегида (около 6 млн тонн/год). Он, в основном, используется в производстве смол — бакелита, галалита (в сочетании с мочевиной, меламином и фенолом), для дубления кож, протравливания зерна. Также из него синтезируют лекарственные средства (уротропин) используют как консервант биологических препаратов (благодаря способности свертывать белок). Он является предшественником метилендифенилдиизоцианата, использующегося в производстве полиуретанов и гексогена (довольно сильной взрывчатки). Второй по масштабам производства альдегид — масляный альдегид (получают около 2,5 млн тонн/год методом гидроформилирования). Некоторые альдегиды синтезируют только в небольших масштабах (менее 1000 тонн / год) и используют в качестве ингредиентов в парфюмерии и ароматов (в основном альдегиды с числом атомов углерода от 8 до 12). Например, это коричный альдегид и его производные — цитраль и лилиаль. Ацетальдегид используется для синтеза уксусной кислоты, этилового спирта, бутадиена для получения производных пиридина, пентаэритрита и кротонового альдегида, а также при синтезе поливинилацетата и пластмасс. Альдегиды применяют для синтеза спиртов (бутиловых, 2-этилгексанола, пентаэритрита), карбоновых кислот, полимеров, антиоксидантов, пиридиновых оснований.
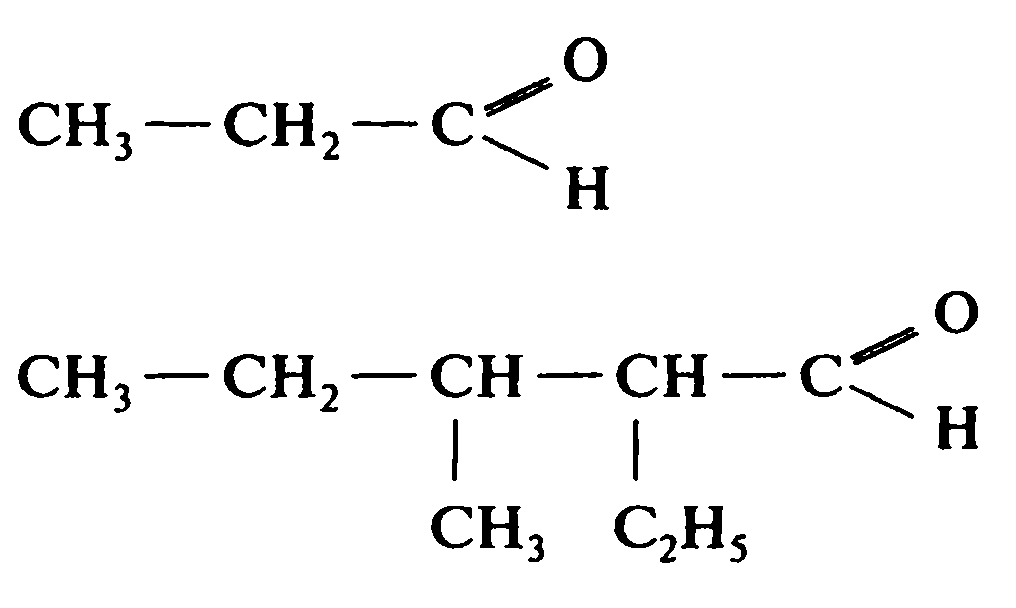
Задачи. 1. Назовите вещества, формулы которых:
Вывод: -Укрепили знания - по физическим свойствам альдегидов (агрегатное состояние, растворимость в воде, запах). - Определили, что альдегиды играют важную роль в промышленности при создании сырья.
Этимология Слово альдегид было придумано Юстусом фон Либихом как сокращение латинского alcohol dehydrogenatus — дегидрированный спирт (в некоторых источниках — alcohol dehydrogenatum). Название радикала формил, а также другие однокоренные слова (формальдегиды, формиаты), произошли от лат. formica — муравей. Тривиальные названия В популярной и научной литературе можно нередко встретить исторические, или тривиальные, названия альдегидов, которые вследствие сложившейся традиции используются вместо систематических названий. Тривиальные названия обычно происходят от названия соответствующих карбоновых кислот, а также от названия источника, из которого был выделен тот или иной альдегид. Так, например, формальдегид называют муравьиным альдегидом, этаналь— уксусным, пентаналь— валериановым альдегидом, цитронеллаль получил своё название, поскольку был выделен из масла цитрусовых. Исторически сложилось, что парфюмеры называют многие пахучие вещества альдегидами, даже те, которые не имеют ничего общего с ними. Среди таковых, например, персиковый, земляничный и кокосовый альдегид, которые являются не альдегидами, а сложными эфирами или лактонами. Также некоторые альдегиды традиционно называются по числу атомов углерода, например, персиковый альдегид, обозначаемый как «альдегид C14», на самом деле имеет лишь 11 атомов углерода. Систематическая номенклатура По номенклатуре ИЮПАК названия простых альдегидов образуются от названий соответствующих алканов с добавлением суффикса -аль, а диальдегидов — суффикса -диаль (в данном случае атом углерода альдегидной группы уже входит в состав родоначального алкана). При этом в названии номер при альдегидной группе, как правило, не ставят, поскольку она всегда занимает крайнее положение. Если карбонильная группа не входит в родоначальную структуру (например, если родоначальной структурой является циклический углеводород или геьероцикл), то к названию добавляется суффикс - карбальдегид. Если в данном соединении альдегидная группа не является старшей, то в таких случаях её обозначают используя приставку формил -, указывая её положение. В устаревших Женевской (1892) и Льежской (1930) номенклатурах, впоследствии заменённых систематической номенклатурой ИЮПАК, альдегиды обозначались при помощи суффикса – ал.
Классификация альдегидов Альдегиды классифицируются следующим образом (в скобках приведены примеры): · В зависимости от насыщенности углеводородного заместителя: · предельные (насыщенные) альдегиды (ацетальдегид); · непредельные (ненасыщенные) альдегиды (акролеин); · ароматические альдегиды (бензальдегид). · По числу карбонильных групп: · альдегиды с одной карбонильной группой (формальдегид); · диальдегиды (глиоксаль); · многоатомные альдегиды.
|
|||||||||||
|
Последнее изменение этой страницы: 2016-09-18; просмотров: 478; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.223.106.195 (0.012 с.) |