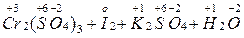Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опыт 3. Полный гидролиз солиСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
В две пробирки внести по 1-2 капли хлорида алюминия. В первую пробирку прилить раствор карбоната натрия, во вторую пробирку – раствор сульфида натрия до выпадения осадка. - Отметить внешние проявления реакций: образование осадка, выделение газа, запахи; - ответить, образуется ли карбонат алюминия в водном растворе; - составить уравнение реакции между водными растворами карбоната натрия и хлорида алюминия в молекулярной и ионной форме: AlCl3 + Na2CO3 + H2O → …; Al3+ + CO32- + H2O → …; - ответить, образуется ли сульфид алюминия в водном растворе; - составить уравнения реакции между водными растворами сульфида натрия и хлорида алюминия в молекулярной и ионной форме: AlCl3 + Na2S + H2O → …; Al3+ + S2- + H2O → …; - отличаются или нет по составу образующиеся осадки в первой и во второй пробирках; - совместный гидролиз по катиону и по аниону взаимно усиливаются или нет; - ответить, какие соли подвергаются полному гидролизу, как это отражается в таблице растворимости (табл.4 приложения)
Контрольные тестовые задания по теме: «Гидролиз солей» Задание 4.1.1 Гидролизу не подвергается: Ответы: 1) FeSO4; 2) Na2SO3; 3) Fe(NO3)2; 4) Fe2(SO4)3; 5) Na2SO4. Задание 4.1.2 Гидролизу не подвергается: Ответы: 1) BaI2; 2) Na2CrO4; 3) CuCl2; 4) MgI2; 5) K2СO3. Задание 4.1.3 Гидролизу не подвергается: Ответы: 1) K2CO3; 2) KCl; 3) ZnCl2; 4) ZnCO3; 5) BeCl2.. Задание 4.1.4 Гидролизу не подвергается: Ответы: 1) Cu(NO3)2; 2) CuCl2; 3) FeCl3; 4) Ca(NO3)2; 5) BiCl3. Задание 4.1.5 Гидролизу не подвергается: Ответы: 1) Cs2CO3; 2) K2CO3; 3) Cs2SO4; 4) FeSO4; 5) FeCl2. Задание 4.1.6 Гидролизу по аниону подвергается: Ответы: 1) FeSO4; 2) Na2SO3; 3) Fe(NO3) 2; 4) Fe2(SO4) 3; 5) Na2SO4.
Задание 4.1.7 Гидролизу по аниону подвергается: Ответы: 1) BaI2; 2) Na2CrO4; 3) CuCl2; 4) MgI2; 5) KNO3.
Задание 4.1.8 Гидролизу по аниону подвергается: Ответы: 1) K2CO3; 2) KCl; 3) ZnCl2; 4) Zn(NO3) 2; 5) BeSO4. . Задание 4.1.9 Гидролизу по аниону подвергается: Ответы: 1) RbI; 2) NaNO3; 3) K2SO4; 4) CuCl2; 5) CH3COONa. Задание 4.1.10 Гидролизу по катиону подвергается: Ответы: 1) K2SO4; 2) NaCl; 3) NH4Cl; 4) Na2S; 5) CaCl2. Задание 4.1.11 Гидролизу по аниону подвергается: Ответы: 1) K2SO4; 2) NaCl; 3) NH4Cl; 4) Na2S; 5) CaCl2. Задание 4.1.12 Гидролизу по катиону подвергается: Ответы: 1) Cs2CO3; 2) K2CO3; 3) Cs2SO4; 4) CaSO4; 5) FeCl2. Задание 4.1.13 Гидролизу по катиону подвергается: Ответы: 1) BaI2; 2) Na2CrO4; 3) CuCl2; 4) SrI2; 5) K2СO3. Задание 4.1.14 Гидролизу по катиону подвергается: Ответы: 1) Na3PO4; 2) NaHS; 3) CoSO4; 4) K2SO4; 5) KI. Задание 4.1.15 Гидролизу по катиону подвергается: Ответы: 1) NaBr; 2) NiBr2; 3) K2CO3; 4) KHCO3; 5) BaCl2. Задание 4.2.1 Кислaя среда в растворе соли: Ответы: 1) FeSO4; 2) Na2SO3; 3) Fe(OH)2; 4) Fe2O3; 5) Na2SO4. Задание 4.2.2 Кислaя среда в растворе соли: Ответы: 1) Na2CO3; 2) CuCl2; 3) NaCl; 4) Na2S; 5) NaI. Задание 4.2.3 Кислaя среда в растворе соли: Ответы: 1) NaNO3; 2) Na2CO3; 3) KNO3; 4) BiCl3; 5) NaHCO3. Задание 4.2.4 Кислaя среда в растворе соли: Ответы: 1) CoSO4; 2) Na2SO4; 3) K2SO4; 4) CsI; 5) CaCl2. Задание 4.2.5 Кислaя среда в растворе соли: Ответы: 1) Ca(NO3) 2; 2) SrCl2; 3) Sr(HCO3) 2; 4) Fe(NO3) 3; 5) Ba(NO3) 2.
Задание 4.2.6 Нейтральная среда в растворе соли: Ответы: 1) FeSO4; 2) NaHSO3; 3) Fe(OH)2; 4) Fe2O3; 5) Na2SO4. Задание 4.2.7 Нейтральная среда в растворе соли: Ответы: 1) Ni(NO3) 2; 2) Na2CO3; 3) KNO3; 4) BiCl3; 5) NaHCO3. Задание 4.2.8 Нейтральная среда в растворе соли: Ответы: 1) Ca(NO3) 2; 2) SnCl2; 3) Sr(HCO3) 2; 4) Fe(NO3) 3; 5) Bi(NO3) 3. Задание 4.2.9 Нейтральная среда в растворе соли: Ответы: 1) Na2CO3; 2) CuCl2; 3) NaCl; 4) Na2S; 5) FeSO4. Задание 4.2.10 Нейтральная среда в растворе соли: Ответы: 1) BaCl2; 2) CuSO4; 3) K2CO3; 4) Na3PO4; 5) NaHCO3. Задание 4.2.11 Основная среда в растворе соли: Ответы: 1) Na2SO4; 2) CuCl2; 3) NaCl; 4) Na2S; 5) FeSO4. Задание 4.2.12 Основная среда в растворе соли: Ответы: 1) Ni(NO3) 2; 2) Na2CO3; 3) KNO3; 4) BiCl3; 5) NaHSO3. Задание 4.2.13 Основная среда в растворе соли: Ответы: 1) FeCl3; 2) Na2SO4; 3) K2SO3; 4) CsI; 5) CaCl2. Задание 4.2.14 Основная среда в растворе соли: Ответы: 1) BaCl2; 2) CuSO4; 3) KNO3; 4) Na3PO4; 5) NaHSO4. Задание 4.2.15 Основная среда в растворе соли: Ответы: 1) NaNO2; 2) FeSO4; 3) KI; 4) Ba(NO3) 2; 5) NaNO3 Окислительно-восстановительные процессы Основные понятия Реакции, протекающие с изменением степеней окисления участвующих в них элементов, называют окислительно-восстановительными реакциями (ОВР). Степень окисления элемента – формальный заряд, который был бы на атоме, если бы все связи были ионными. Окислительно-восстановительная реакция протекает между окислителем и восстановителем. Окислитель – реагент, степень окисления элемента в котором в результате присоединения электронов понижается. Окислитель является акцептором электронов, то есть «принимает электроны» и восстанавливается. Восстановитель – реагент, степень окисления элемента в котором повышается в результате отдачи электронов. Восстановитель является донором электронов, то есть «отдает электроны» и окисляется. В окислительно-восстановительных реакциях восстановитель переходит в соответствующую окисленную форму, и наоборот, окислитель – в соответствующую восстановленную форму. Каждый из реагентов со своим продуктом образует сопряженную окислительно-восстановительную пару. Окисление – процесс в котором степень окисления элемента повышается вследствие отдачи электронов; Восстановление – процесс в котором степень окисления элемента понижается вследствие присоединения электронов. Процессы окисления и восстановления протекают одновременно. Степень окисления понижается Присоединение электронов
Степень окисления повышается
Сопряженные окислительно-восстановительные пары 1. Zn восстан. окисл. форма (1) форма (1) 2. 2H+ + 2e – окисл. восстан. форма (2) форма (2) Вещества в окислительно-восстановительных реакциях могут проявлять – только окислительные свойства, если содержат атом элемента в максимальной степени окисления ( – только восстановительные свойства, если содержат атом элемента в минимальной степени окисления (металлы, Nao, Mno, Feo, Zno…NaI–1, Na2S–2, NH3); – двойственные окислительно-восстановительные свойства, если содержат атом элемента в промежуточной степени окисления (неметаллы Br2, I2, S,…, – инертные свойства по отношению к окислителям и восстановителям, если все элементы находятся в постоянной и устойчивой степени окисления (Na2SiO3, K2CO3, Na3PO4…). Окислительно-восстановительные реакции подразделяют на следующие типы – межмолекулярные: окислитель и восстановитель являются разными веществами:
восстановитель окислитель – внутримолекулярные: атомы окислителя и восстановителя входят в состав одного соединения
окислитель восстановитель – диспропорционирования или самоокисления-самовосстановления: окислителем и восстановителем является одно и то же вещество 0 -2+4 3S + 6KOH → 2K2S + K2SO3 + 3H2O; и окислитель и восстановитель – конпропорционирования: окислителем и восстановителем являются атомы одного элемента в разных степенях окисления
восстановитель окислитель В уравнениях окислительно-восстановительных реакций должен быть отражен «электронный» и «материальный» баланс. Электронный баланс: число электронов, «отданных» восстановителем, должно быть равно числу электронов, «принятых» окислителем. Материальный баланс: число атомов одного элемента в левой и правой части уравнения должно быть одинаковым. Подбор коэффициентов в уравнении ОВР проводят либо методом электронного баланса, либо методом ионно-электронного баланса. Метод электронного баланса применяют для составления уравнений реакцией ОВР любого типа. Он включает следующие этапы. 1. Определение степеней окисления элементов:
окислитель восстановитель 2. Составление уравнений процессов окисления и восстановления: Cr+6 + 3e → Cr+3 (процесс восстановления) I– – e → Io (процесс окисления) 3. Определение наименьшего общего кратного числа «отданных» восстановителем и «принятых» окислителем электронов, определение коэффициентов электронного баланса: Наименьшее Коэффициенты
 Сr+6 + 3e → Cr+3 1 Сr+6 + 3e → Cr+3 1
I– – 1e → Io 3 4. Расстановка коэффициентов электронного баланса (с учетом состава соединений) перед окислителем и восстановителем и продуктами их превращений: K2Cr2O7 + 6KI + H2SO4 → Cr2(SO4)3 + 3I2 + K2SO4 + H2O 5. Определение коэффициентов материального баланса для всех остальных элементов: K2Cr2O7 + 6KI + 7H2SO4 → Cr2(SO4)3 + 3I2 + 4K2SO4 + 7H2O 6. Проверка по суммарному числу атомов кислорода в левой и в правой части уравнения: число атомов 0 число атомов 0 в левой части уравнения в правой части уравнения [7 + 7∙4] = 35 [(3∙4 + 4∙4 + 7)] = 35 Метод ионно-электронного баланса применяют для составления уравнений ОВР, протекающих в водных растворах. Он включает следующие этапы: 1. Составление схемы реакции с учетом диссоциации сильных электролитов на ионы: KMnO4 + Na2SO3 + H2SO4 → MnSO4 + Na2SO4 + K2SO4 + H2O (молекуляр- наяформа) K++MnO4– +2Na++SO32–+2H++SO42-→Mn2++SO42-+2Na++SO42–+H2O (ионная форма) 2. Определение частиц, изменивших в результате реакции состав или заряд: MnO4– → Mn2+ SO32– → SO42– 3. Составление полуреакций окисления и восстановления. Причем материальный баланс подбирается с использованием частиц H2O и H+ - для реакций в кислой среде и частиц H2O и OH– - для реакций в щелочной среде MnO4– + 8H+ → Mn2+ + 4H2O SO32– + H2O → SO42– + 2H+ 4. Определение заряда каждой из систем до и после превращения; определение числа «отданных» восстановителем и «принятых» окислителем электронов: MnO4– + 8H+ + 5e– → Mn2+ + 4H2O (процесс восстановления) суммарный заряд суммарный заряд число переданных до превращения после превращения электронов [–1+8(+1)]=+7 [+2+4∙0]=+2 n1= +7–2= +5 SO32– + H2O – 2e → SO42– + 2H+ (процесс окисления) суммарный заряд суммарный заряд число переданных до превращения после превращения электронов [–2+0]=–2 [–2+2∙(+1)]=0 n2= –2–0= –2 5. Определение коэффициентов электронного баланса: Наименьшее общее коэффициенты элек- кратное тронного баланса
  MnO4– + 8H+ + 5e → Mn2+ + 4H2O 10: 5=2 MnO4– + 8H+ + 5e → Mn2+ + 4H2O 10: 5=2
SO32– + H2O – 2e → SO42– + 2H+ 10: 2=5
6. Сложение полуреакций окисления и восстановления, умноженных на со ответствующие коэффициенты электронного баланса, «приведение по добных членов» и составление краткого ионного уравнения: 2MnO4– + 16H+ + 2MnO4– + 6H+ + 5SO32– → 2Mn2+ + 5SO42– + 3H2O (краткое ионное уравнение) 7. Составление молекулярного уравнения. Коэффициенты, полученные в кратком ионном уравнении, переносятся в молекулярное (с учетом состава соединений): 2KMnO4 + 3H2SO4 + 5Na2SO3 → 2MnSO4 + 5Na2SO4 + 3H2O + K2SO4 8. Определение коэффициентов перед элементами, не участвовавшими в ОВР (например, К). 9. Проверка по суммарному числу атомов кислорода в левой и правой части уравнения: суммарное число атомов 0 суммарное число атомов 0 в левой части уравнения в правой части уравнения [2∙4+3∙4+5∙3]=35 [2∙4+5∙4+3+4]=35
|
|||||||||||
|
Последнее изменение этой страницы: 2016-07-11; просмотров: 436; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.189.182.211 (0.011 с.) |


 +
+ 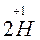 =
= 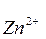 +
+ 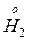
 Восстановитель Окислитель
Восстановитель Окислитель
 Zn2+ + 2e –
Zn2+ + 2e –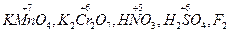 );
);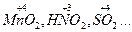 );
); +
+  +
+ 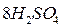 →
→ 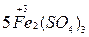 +
+  +
+  +
+  ;
;

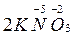 →
→ 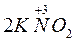 +
+ 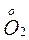 ;
; +
+  →
→ 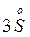 +
+ 
 →
→