
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Поменять местами электроды (опыт 5), вследствие чего анод окажется омеднённым. Снова пропустить электрический ток.Содержание книги
Поиск на нашем сайте
- Отметить, какие изменения происходят на электродах; - составить уравнения электролитической диссоциации CuSO4 и H2O: CuSO4 H2O - составить уравнение гидролиза и ответить, какая среда в растворе CuSO4; - выбрать окислитель, характеризующийся наибольшим значением окислительно-восстановительного потенциала (табл.3 приложения):
- составить уравнение катодной реакции: Cu2+ + … → (процесс …); - выбрать восстановитель, характеризующийся наименьшим значением окислительно-восстановительного потенциала:
- составить уравнение анодной реакции: Cuo - … (процесс …); - составить суммарное уравнение электролиза раствора сульфата меди (II) с активным медным анодом, объединив уравнения катодной и анодной реакций: Cu2+(кат.) + Cuo(ан.) → …; - ответить, каковы области практического использования электролиза водных растворов солей с активным анодом.
Контрольные тестовые задания по теме «Электрохимические процессы» Задание 6.1.1 Для гальванического элемента Zn|ZnSO4||Pb(NO3)2|Pb составить уравнения анодной и катодной реакций, суммарное уравнение. ЭДС в стандартных условиях равна: Ответы: 1) 1,268; 2) –1,268; 3) +0,634; 4) –0,634; 5) 6,34. Задание 6.1.2 Для гальванического элемента Fe|FeCl2||NiSO4|Ni составить уравнения анодной и катодной реакций, суммарное уравнение. ЭДС в стандартных условиях равна: Ответы: 1) –0,19; 2) 0,19; 3) –0,38; 4) 0,38; 5) 3,8. Задание 6.1.3 Для гальванического элемента Co|CoSO4||CuSO4|Cu составить уравнения анодной и катодной реакций, суммарное уравнение. ЭДС в стандартных условиях равна: Ответы: 1) 6,17; 2) –0,617; 3) 0,617; 4) 1,34; 5) –1,34. Задание 6.1.4 Для гальванического элемента Mg|MgCl2||FeSO4|Fe составить уравнения анодной и катодной реакций, суммарное уравнение. ЭДС в стандартных условиях равна: Ответы: 1) 1,923; 2) –1,923; 3); 4); 5). Задание 6.1.5 Для гальванического элемента Al|AlCl3||CoCl2|Co составить уравне ния анодной и катодной реакций, суммарное уравнение. ЭДС в стандартных условиях равна: Ответы: 1) 1,383; 2) –1,383; 3) 1,937; 4) –1,937; 5) 0,97. Задание 6.1.6 Для гальванического элемента Ni|NiSO4||BiCl3|Bi составить уравнения анодной и катодной реакций, суммарное уравнение. ЭДС в стандартных условиях равна: Ответы: 1) –0,05; 2) 0,05; 3) –0,45; 4) 0,45; 5) 0,90. Задание 6.1.7 Для гальванического элемента Mn|MnCl2||ZnSO4|Zn составить уравнения анодной и катодной реакций, суммарное уравнение. ЭДС в стандартных условиях равна: Ответы: 1) 1,94; 2) –1,94; 3) 0,97; 4) 0,42; 5) –0,42. Задание 6.1.8 Для гальванического элемента Cd|CdCl2||SnCl2|Sn составить уравнения анодной и катодной реакций, суммарное уравнение. ЭДС в стандартных условиях равна: Ответы: 1) 0,539; 2) –0,267; 3) 0,267; 4) –0,539; 5) 1,78.
Задание 6.1.9 Для гальванического элемента Pb|Pb(NO3)2||CuSO4|Cu составить уравнения анодной и катодной реакций, суммарное уравнение. ЭДС в стандартных условиях равна: Ответы: 1) 0,463; 2) –0,463; 3) 0,211; 4) –0,211; 5) 0,422. Задание 6.1.10 Для гальванического элемента Cu|CuCl2||AgNO3|Ag составить уравнения анодной и катодной реакций, суммарное уравнение. ЭДС в стандартных условиях равна: Ответы: 1) 1,136; 2) –1,136; 3) 0,674; 4) –0,462; 5) 0,462. Задание 6.1.11 Для гальванического элемента Ag|AgNO3||AuCl3|Au составить уравнения анодной и катодной реакций, суммарное уравнение. ЭДС в стандартных условиях равна: Ответы: 1) 0,699; 2) –0,699; 3) 0,799; 4) –0,462; 5) 0,462. Задание 6.1.12 Для гальванического элемента (Pt)H2|HCl||AgNO3|Ag составить урав нения анодной и катодной реакций, суммарное уравнение. ЭДС в стандартных условиях равна: Ответы: 1) 0,799; 2) –0,799; 3) 0; 4) 1,598; 5) –1,598. Задание 6.1.13 Для гальванического элемента Mg|MgCl2||CuSO4|Cu составить уравнения анодной и катодной реакций, суммарное уравнение. ЭДС в стандартных условиях равна: Ответы: 1) 2,026; 2) –2,026; 3) 2,7; 4) –2,7; 5) –2,363. Задание 6.1.14 Для гальванического элемента Al|AlCl3||BiCl3|Bi составить уравнения анодной и катодной реакций, суммарное уравнение. ЭДС в стандартных условиях равна: Ответы: 1) 1,862; 2) –1,8623; 3) 1,462; 4) –1,462; 5) 1,662. Задание 6.1.15 Для гальванического элемента Zn|ZnSO4||H2SO4|H2(Pt) составить уравнения анодной и катодной реакций, суммарное уравнение. ЭДС в стандартных условиях равна: Ответы: 1) 0; 2) 0,763; 3) –0,763; 4) 1,526; 5) –1,526. Задание 6.2.1 Металлы находятся в тесном соприкосновении и погружены в раствор поваренной соли. Пара, где будет корродировать хром: Ответы: 1) Cr/Mg; 2) Cr/Fe; 3) Cr/Al; 4) Cr/Ca; 5) Cr/Mn. Задание 6.2.2 Следующие пары металлов, находящиеся в тесном контакте, погружены в раствор серной кислоты. Пара, где цинк не будет разрушаться: Ответы: 1) Zn/Ag; 2) Zn/Cu; 3) Zn/Al; 4) Zn/Fe; 5) Zn/Sn. Задание 6.2.3 Следующие пары металлов находятся в тесном контакте и погружены в раствор серной кислоты. Пара, где не будет разрушаться железо: Ответы: 1) Fe/Cu; 2) Fe/Ag; 3) Fe/Zn; 4) Fe/Au; 5) Fe/Pt. Задание 6.2.4 Следующие пары металлов, находящиеся в контакте, погружены в водный раствор поваренной соли. Железо не будет корродировать в паре: Ответы: 1) Fe/Cu; 2) Fe/Sn; 3) Fe/Al; 4) Fe/Co; 5) Fe/Ag. Задание 6.2.5 Следующие пары металлов, находящиеся в контакте, погружены в водный раствор. Алюминий не будет корродировать в паре: Ответы: 1) Al/Pb; 2) Al/Sn; 3) Al/Cu; 4) Al/Fe; 5) Al/Mg. Задание 6.2.6 Следующие пары металлов, находящиеся в контакте, погружены в водный раствор. Олово не будет корродировать в паре: Ответы: 1) Sn/Al; 2) Sn/Bi; 3) Sn/Cu; 4) Sn/Ag; 5) Sn/Au. Задание 6.2.7 Следующие пары металлов, находящиеся в контакте, погружены в водный раствор. Никель не будет корродировать в паре: Ответы: 1) Ni/Sn; 2) Ni/Cu; 3) Ni/Bi; 4) Ni/Zn; 5) Ni/Ag. Задание 6.2.8 Следующие пары металлов, находящиеся в контакте, погружены в водный раствор. Бериллий не будет корродировать в паре: Ответы: 1) Be/Zn; 2) Be/Mn; 3) Mg/Be; 4) Co/Be; 5) Be/Sn. Задание 6.2.9 Следующие пары металлов, находящиеся в контакте, погружены в водный раствор. Кобальт не будет корродировать в паре: Ответы: 1) Co/Sn; 2) Co/Pb; 3) Co/Al; 4) Co/Bi; 5) Co/Ag. Задание 6.2.10 Следующие пары металлов, находящиеся в контакте, погружены в водный раствор. Марганец не будет корродировать в паре: Ответы: 1) Mn/Mg; 2) Mn/Fe; 3) Mn/Cu; 4) Mn/Ag; 5) Mn/Sn.. Задание 6.2.11 Следующие пары металлов, находящиеся в контакте, погружены в водный раствор. Свинец не будет корродировать в паре: Ответы: 1) Pb/Cu; 2) Pb/Fe; 3) Pb/Hg; 4) Pb/Bi; 5) Pb/Ag. Задание 6.2.12 Следующие пары металлов, находящиеся в контакте, погружены в водный раствор. Кадмий не будет корродировать в паре: Ответы: 1) Cd/Mn; 2) Cd/Cu; 3) Cd/Sn; 4) Cd/Ni; 5) Cd/Pb. Задание 6.2.13 Следующие пары металлов, находящиеся в контакте, погружены в водный раствор. Медь не будет корродировать в паре: Ответы: 1) Cu/Ag; 2) Cu/Au; 3) Cu/Pt; 4) Cu/Ni; 5) Cu/Hg. Задание 6.2.14 Следующие пары металлов, находящиеся в контакте, погружены в водный раствор. Висмут не будет корродировать в паре: Ответы: 1) Bi/Cu; 2) Bi/Hg; 3) Bi/Ag; 4) Bi/Au; 5) Bi/Sn. Задание 6.2.15 Следующие пары металлов, находящиеся в контакте, погружены в водный раствор. Хром не будет корродировать в паре: Ответы: 1) Cr/Mn; 2) Cr/Fe; 3) Cr/Sn; 4) Cr/Cu; 5) Cr/Pb`. Задание 6.3.1 Напишите уравнения электродных процессов и суммарное уравнение электролиза водного раствора Na2CO3. На электродах разряжаются ионы: Ответы: 1) Na+ и CO32-; 2) H+ и OH-; 3) H+ и CO32-; 4) Na+ и OH-; 5) Na+, H+ и OH- Задание 6.3.2 Напишите схему электролиза расплава хлорида натрия. Если подвергнуть электролизу 1 моль расплава хлорида натрия, на аноде образуется продукт в количестве, моль: Ответы: 1) 0,5; 2) 1; 3) 2; 4) 3; 5) 4. Задание 6.3.3 Составьте схему электролиза раствора нитрата серебра. На катоде восстанавливается ион: Ответы: 1) Ag+; 2) NO3-; 3) H+; 4) OH-; 5) N5+. Задание 6.3.4 Напишите схему электролиза расплава гидроксида калия. Масса (г) металла, выделяющегося при электролизе 56 г расплава гидроксида калия, равна: Ответы: 1) 19; 2) 27; 3) 39; 4) 78; 5) 156. Задание 6.3.5 Напишите уравнения процессов, протекающих на катоде и на аноде при электролизе водного раствора бромида натрия; суммарное уравнение электролиза. На катоде и на аноде выделяются продукты: Ответы: 1) H2 и O2; 2) H2 и Br2; 3) Na и O2; 4) Na и Br2; 5) O2 и Br2. Задание 6.3.6 При электролизе водного раствора Na2SO4 на электродах выделяются: Ответы: 1) Na и SO3; 2) H2 и SO3; 3) Na и O2; 4) H2 и O2; 5) Na и H2. Задание 6.3.7 При электролизе раствора сульфата меди (II) с медным анодом масса катода увеличилась на 3,2 г. С анода в раствор перешло ионов Сu2+, моль: Ответы: 1) 0,1; 2) 0,01; 3) 0,5; 4) 0,05; 5) 20. Задание 6.3.8 При электролизе не происходит выделения металла из раствора соли: Ответы: 1) Ba(NO3)2; 2) AgNO3; 3) Bi(NO3)3; 4) Pb(NO3)2; 5) Hg(NO3)2.
Задание 6.3.9 При электролизе водного раствора нитрата алюминия на электродах выделяются: Ответы: 1) Al и NO2; 2) Al и O2; 3) H2 и O2; 4) H2 и NO2; 5) Al и H2. Задание 6.3.10 По окончании электролиза водного раствора AgNO3 в растворе у анода содержится: Ответы: 1) O2; 2) HNO3; 3) Ag2O; 4) Ag; 5) H2. Задание 6.3.11 В какой последовательности будут восстанавливаться катионы при электролизе раствора, содержащего соли одинаковой концентрации а) Cd2+; б) Hg2+; в) Ni2+; г) Cu2+; д) Sn2+. В ответе укажите последовательность буквенных обозначений катионов: Ответы: 1) абвгд; 2) бгдва; 3) двгба; 4) абгдв; 5) бавгд. Задание 6.3.12 Составьте схему электролиза раствора хлорида магния. Суммарный объем (л) газов, выделившихся (при н.у.) при электролизе соли массой 19 г, равен: Ответы: 1) 13,44; 2) 8,96; 3) 4,48; 4) 2,24; 5) 11,2.
Задание 6.3.13 Напишите уравнения электродных процессов и суммарное уравнение электролиза водного раствора, содержащего 166 г йодида калия. Масса (г) выделившегося йода равна: Ответы: 1) 127; 2) 128; 3) 254; 4) 256; 5) 384. Задание 6.3.14 При электролизе водного раствора NaOH на аноде выделилось 2,8 л кислорода (условия нормальные). Объем водорода, выделившегося на катоде, равен: Ответы: 1) 2,8; 2) 5,6; 3) 8,96; 4) 11,2; 5) 22,4. Задание 6.3.15 Напишите уравнения электродных процессов и суммарное уравнение электролиза водного раствора хлорида калия. На электродах выделятся: Ответы: 1) K и O2; 2) K и Cl2; 3) H2 и Cl2; 4) H2 и O2; 5) K, H2 и Cl2. Задание 6.3.16 Объем (л) газа (при н.у.), выделяющегося при электролизе 222 г расплава хлорида кальция равен: Ответы: 1) 22,4; 2) 44,8; 3) 67,2; 4) 89,6; 5) 100,8. Задание 6.3.17 Напишите уравнения электродных процессов и суммарное уравнение электролиза водного раствора Cu(NO3)2. Молярная масса вещества, выделяющегося на катоде при электролизе водного раствора сульфата меди (II), равна: Ответы: 1) 2; 2) 32; 3) 56; 4) 64; 5) 98.
Задание 6.3.18 При электролизе раствора, содержащего 298 г хлорида калия, выделяется хлор объемом (л) при н.у.: Ответы: 1) 5,6; 2) 11,2; 3) 22,4; 4) 44,8; 5) 89,6. Задание 6.3.19 Напишите схему электролиза водного раствора, содержащего 269 г хлорида меди (II). Масса (г) продукта, выделившегося на катоде, равна: Ответы: 1) 31,8; 2) 63,5; 3) 124,3; 4) 127; 5) 195. Задание 6.3.20 Объем (л) водорода (н.у.), выделившегося при электролизе 72 г воды, равен: Ответы: 1) 11,2; 2) 22,4; 3) 44,8; 4) 67,2; 5) 89,6. Задание 6.3.21 При электролизе раствора сульфата меди (II) на катоде образовалось 16 г меди. Объем газа, выделившегося на аноде, равен: Ответы: 1) 2,8 л O2; 2) 5,6 л O2; 3) 2,8 л H2; 4) 5,6 л SO3; 5) 5,6 л SO2.
ПРИЛОЖЕНИЕ Таблица 1 Константы диссоциации некоторых кислот и оснований при 25оС
Таблица 2
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-07-11; просмотров: 421; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.136.95 (0.006 с.) |

 …;
…; …;
…;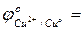 …;
…; 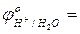 …;
…;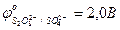 ;
; 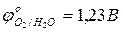 ;
; 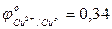 В;
В;


