Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основные правила безопасной работы в химической лабораторииСодержание книги
Поиск на нашем сайте
ВВЕДЕНИЕ Общие рекомендации для подготовки к лабораторным занятиям
Выполнение лабораторных работ призвано способствовать более глубокому усвоению студентами теоретического курса, приобретению навыков в проведении химических экспериментов, умению обобщать полученные данные и кратко излагать их в виде отчета. Необходимым условием успешного качественного усвоения пройденного материала является самостоятельное и сознательное выполнение лабораторных работ. При этом важной и существенной частью работы является домашняя подготовка по учебникам, методическим пособиям и руководствам. С первых дней работы в лаборатории студент должен приучать себя к аккуратности и вниманию, отсутствие которых бывает причиной искажения результатов эксперимента, а также может привести к несчастным случаям. При выполнении практических работ все наблюдения следует записывать в специальную тетрадь – лабораторный журнал – непосредственно после каждого опыта. Не следует делать записи в черновиках и на отдельных листочках бумаги, так как они могут легко затеряться. По окончании опытов необходимо составить отчет о выполненной работе. Отчет должен содержать: - титульный лист (образец оформления титульного листа отчета смотри в приложении); - цель работы; - краткое изложение теории; - приборы и реактивы; - номер и название опыта; - условия и особенности протекания реакции; - схемы, иллюстрирующие проводимый эксперимент; - полученные результаты, наблюдаемые эффекты; - уравнения протекающих реакций в молекулярной и ионной формах; - объяснения и выводы. Отчет может быть оформлен либо в описательной форме, либо в форме таблицы на двух развернутых страницах:
Лабораторная работа №_____ Тема:________________________________________________ Опыт:________________________________________________
Основные правила безопасной работы в химической лаборатории - соблюдение порядка, чистоты, тишины, дисциплины; - выполнение только порученных преподавателем работ; - перед выполнением работы необходимо ознакомиться с заданием, оборудованием, реактивами; - работа выполняется на отведенном рабочем месте в спецодежде – халате; - в лаборатории запрещается работать одному, принимать пищу, курить, загромождать рабочее место, оставлять работающие приборы без присмотра, включать приборы, не относящиеся к данной работе; - реактивы, предназначенные для общего пользования, нельзя уносить на свое рабочее место; пипетки после отбора необходимого количества реактива следует немедленно возвращать в реактивную склянку; - остатки реактивов и продуктов реакции сливать только в специальный слив; категорически запрещается сливать их в раковину и общую канализацию; - следует экономно расходовать реактивы, электричество, воду; аккуратно и осторожно обращаться с химической посудой и приборами; - при нагревании растворов в пробирке необходимо пользоваться держателем, отверстие пробирки должно быть обращено внутрь вытяжного шкафа; - все опыты, связанные с применением или образованием ядовитых веществ, вредных паров и газов, а также концентрированных кислот и щелочей, разрешается проводить только в вытяжном шкафу; - по окончании работы необходимо вымыть посуду, убрать рабочее место, выключить электронагревательные приборы, воду и вымыть руки с мылом; ВНИМАНИЕ! О любых происшествиях немедленно сообщить преподавателю или лаборанту, которые ликвидируют опасность и окажут первую помощь; - при воспламенении горючей жидкости на одежде работающего необходимо немедленно погасить пламя, завернув пострадавшего в одеяло; - при ожогах концентрированными растворами кислот пораженное место промывают сильной струей воды в течение 2-3 минут, затем 2-3%-ным раствором чайной соды, после чего накладывают марлевую повязку, смоченную 1-2%-ным раствором перманганата калия; при сильных ожогах после оказания первой помощи следует обратиться к врачу; - при ожогах концентрированными растворами щелочей обожженное место промывают обильным количеством воды, затем 1-2%-ным раствором борной или уксусной кислоты, после чего накладывают марлевую повязку, смоченную 1-2%-ным раствором перманганата калия; - при попадании кислоты, щелочи или какого-либо другого реактива в глаза следует промыть их обильным количеством воды и немедленно обратиться к врачу.
Классификация неорганических веществ по составу 1.1. Простые вещества состоят из атомов одного элемента, их делят на металлы и неметаллы. Металлы находятся в начале периодов (исключение – 1 период), неметаллы в конце периодов, правее диагонали от В до At (рис. 1). Металл Одноэлементное вещество, характерными свойствами которого являются высокая теплопроводность, высокая электропроводимость и металлический блеск и которое, как правило, поддается обработке путем прокатки, прессования, ковки и волочения.
Сплавы – это многоэлементные твердые растворы различных металлов.
Неметалл Одноэлементное вещество, которое не проявляет свойства, являющиеся характерными для металлов. Неметаллы, как правило, имеют плохие теплопроводность и электропроводимость. Амфиген (металлоид) Одноэлементное вещество, которое по своим свойствам занимает промежуточное положение между металлами и неметаллами; иногда образует металлические и неметаллические модификации. Амфигены обозначены на рис. 1 темным фоном.
1.2. Сложные вещества состоят из атомов двух и более элементов, их подразделяют на стехиометричные и нестехиометричные. Состав стехиометричных соединений определяется валентностями элементов, например, NH3, Na2S, CuO…; нестехиометричных – не соответствует валентностям элементов.
Н е м е т а л л ы
М е т а л л ы
Рис. 1. Периодическая таблица с длинными периодами (под каждой подгруппой приведено её общепринятое название) аК щелочноземельным элементам относится Ca, Sr, Ba бВ число халькогенов не включается кислород Выделены темным фоном элементы-амфигены (металлоиды) 1.2.1. Бинарные – двухэлементные стехиометричные соединения – классифицируют по анионной составляющей (табл. 1). Таблица 1 Классификация оксидов по составу
Продолжение табл. 2
Трехэлементные соединения с кислородом и водородом (гидроксисоединения) Таблица 3 Основание Определение по Аррениусу: химическое соединение, которое в водном растворе частично или полностью диссоциирует на положительные ионы (простые, сложные) и отрицательные гидроксид-ионы.
NaOH гидроксид гидрат аммиака натрия (гидроксид аммония) Определение по Бренстеду: химическая частица (молекула, ион), которая при взаимодействии с кислотой (в водном растворе – с молекулой воды) принимает от неё катион водорода, или протон (акцептор протона).
Щелочь – водный раствор сильных оснований – гидроксидов щелочных металлов и щелочноземельных металлов. Кислота Определение по Аррениусу: химическое соединение, которое в водном растворе полностью или частично диссоциирует на положительные ионы водорода и отрицательные ионы кислотного остатка.
HNO3 азотная кислота азотистая кислота Определение по Бренстеду: химическая частица (молекула, ион), которая при взаимодействии с основанием (в водном растворе – с молекулой воды) отдает катионы водорода, или протоны (донор протона).
Амфотерное соединение Соединение, которое может реагировать как кислота с более сильным основанием и как основание с более сильной кислотой. Al(OH)3 + OH– = [Al(OH)4]–, Al(OH)3 + 3H3O+ = [Al(H2O)6]3+ Кислота Основание Основание Кислота
Кислотно-основные свойства веществ проявляются по отношению к воде, а также к кислотам и основаниям. Реакция нейтрализации Реакция нейтрализации может быть выражена следующей схемой:
+ → +
(основание или (кислота или кислот- основный оксид) ный оксид)
5.3.1. Свойства основных соединений проявляют оксиды и гидроксиды s- металлов (исключение Be), d-металлов в степени окисления (+1, +2) (исключение Zn), некоторых р-металлов [Tl(+1), Bi(+3)] (см. рис. 3).
Рис. 3. Кислотно-основные свойства оксидов и соответствующих им гидроксисоединений
Характерным свойством основных соединений является их способность взаимодействовать с кислотами, кислотными или амфотерными оксидами с образованием солей, например: KOH + HCl Ba(OH)2 + CO2 2NaO + Al2O3 В зависимости от числа протонов, которые могут присоединяться к основанию, различают основания однокислотные (например, LiOH, KOH, NH4OH), двукислотные [Ca(OH)2, Fe(OH)2] и т.д. Для многокислотных оснований реакция нейтрализации может протекать постадийно с образованием сначала основных, а затем средних солей. HCl HCl Me(OH)2 гидроксид NaOH основная NaOH средняя металла соль соль Например: 1 стадия: Co(OH)2 + HCl хлорид гидроксокобальта (II) (основная соль) 2 стадия: Co(OH)Cl + HCl хлорид кобальта (II) (средняя соль) 5.3.2. Свойства кислотных соединений проявляют оксиды и кислоты неметаллов, а также d-металлов в степени окисления (+5, +6, +7) (см. рис. 3). Характерным свойством является их способность взаимодействовать с основаниями, основными и амфотерными оксидами с образованием солей, например: 2HNO3 + Cu(OH)2 → Cu(NO3)2 + 2H2O 2HCl + CaO → CaCl2 + H2O H2SO4 + ZnO → ZnSO4 + H2O CrO3 + 2NaOH → Na2CrO4 + H2O По наличию кислорода в своем составе кислоты делятся на кислородсодержащие (например, H2SO4, HNO3) и бескислородные (HBr, H2S). По числу содержащихся в молекуле кислоты атомов водорода, способных замещаться атомами металла, различают кислоты одноосновные (например, хлороводород HCl, азотистая кислота HNO2), двухосновные (сернистая H2SO3, угольная H2CO3), трехосновные (ортофосфорная H3PO4) и т.д. Многоосновные кислоты нейтрализуются ступенчато с образованием первоначально кислых, а затем средних солей: NaOH NaOH H2X HCl HCl многоосновная кислая средняя кислота соль соль Например, ортофосфорная кислота может образовать три вида солей в зависимости от количественного соотношения взятых кислоты и щелочи: а) NaOH + H3PO4 → NaH2PO4 + H2O; 1: 1 дигидрофосфат натрия б) 2NaOH + H3PO4 → Na2HPO4 + 2H2O; 2: 1 гидрофосфат натрия в) 3NaOH + H3PO4 → Na3PO4 + 3H2O. 3: 1 ортофосфат натрия
5.3.3. Амфотерные оксиды и гидроксиды образуют Ве, р-металлы, находящиеся вблизи «диагонали амфотерности» (Al, Ga, Sn, Pb), а также d-металлы в степенях окисления (+3, +4) и Zn (+2) (см. рис. 3). Незначительно растворяясь, амфотерные гидроксиды диссоциируют как по основному, так и по кислотному типу:
2H2O 2H+ + [Zn(OH)4]2– Поэтому амфотерные оксиды и гидроксиды могут взаимодействовать как с кислотами, так и с основаниями. При взаимодействии с более сильными кислотами амфотерные соединения проявляют свойства оснований. ZnO + SO3 → ZnSO4 + H2O кислотный оксид Zn(OH)2 + H2SO4 → ZnSO4 + H2O основные кислота соединения При взаимодействии с сильными основаниями амфотерные соединения проявляют свойства кислот, образуя соответствующие соли. Состав соли зависит от условий проведения реакции. При сплавлении образуются простые «обезвоженные» соли. to 2NaOH + Zn(OH)2 → Na2ZnO2 + H2O↑ (тв) (тв) основание кислотное цинкат натрия соединение (H2ZnO2) 2NaOH + ZnO → Na2ZnO2 + H2O↑ (тв) (тв) В водных растворах щелочей образуются комплексные соли: 2NaOH + Zn(OH)2 → Na2[Zn(OH)4] (водный тетрагидроксоцинкат раствор) натрия
И гидроксисоединений Кислотно-основные свойства оксидов и гидроксисоединений закономерно изменяются по периоду и подгруппе. В составе гидроксисоединений всегда присутствует фрагмент
Например:
Кислотно-основные свойства вещества определяются типом химических связей I и II. Ионный тип химической связи I определяет её относительно легкую диссоциацию в растворе с образованием ОН—ионов
―Э― О Н → ―Э+1 + ОН—
Вещества с преимущественно ионной связью I проявляют основные свойства. С увеличением электроотрицательности центрального атома (Э) ковалентность и прочность связи I возрастают. Одновременно связь II становится более полярной и менее прочной, это определяет её преимущественную диссоциацию в растворе с образованием ионов Н+:
―Э―О―Н
Такие соединения проявляют кислотные свойства. Соединения с прочными промежуточными по характеру – ионно-ковалентными связями I и II – проявляют амфотерные свойства. С увеличением электроотрицательности центрального атома (Э) фрагмента ––Э––О––Н усиливаются кислотные и ослабляются основные свойства со-ответствующего гидроксисоединения в периоде в направлении слева направо и в подгруппе снизу вверх. Сравним, например, свойства гидроксисоединений элементов III периода и IIA-подгруппы:
Be(OH)2 Амфотер- ный гидроксид NaOH Mg(OH)2 Al(OH)3 H2SiO3 H3PO4 H2SO4 HClO4 Очень Средней Амфотерный Очень Средней Сильная Очень сильное силы гидроксид слабая силы кислота сильная основание основание кислота кислота кислота
Ca(OH)2 - увеличение электроотрицательности центрального Сильное атома (Э) основание - усиление кислотных свойств оксидов и гидроксисое- Sr(OH)2 динений Сильное - ослабление основных свойств оксидов и гидрокси- основание соединений Ba(OH)2 - усиление гидролиза по катиону Сильное основание
С увеличением степени окисления элемента (Э+n) возрастает его электроотрицательность и, следовательно, усиливаются кислотные и ослабляются основные свойства соответствующих оксидов и гидроксисоединений.
+2 +3 +6 Например: CrO Cr2O3 CrO3 Cr(OH)2 Cr(OH)3 H2CrO4 основные амфотерные кислотные
Таблица 7 Гидролиз солей Гидролиз солей – ионно-обменное взаимодействие солей с водой, сопровождающееся разложением соли. Гидролиз – реакция, обратная нейтрализации.
+ Н2О
1. Соли, образованные сильной кислотой и сильным основанием (Na2SO4, KCl, CrNO3 и др.), гидролизу не подвергаются, их растворы нейтральны (рН=7). 2. Соли, образованные сильной кислотой и слабым основанием (NH4Cl, CuSO4, MgCl2 и др.), подвергаются гидролизу по катиону, среда в растворе кислая (рН<7). Составим уравнения гидролиза NH4Cl: NH4Cl + H2O (H++OH-) слабое. сильная. уравнение) основание кислота
NH4+ + Cl– + H2O NH4+ + H2O В растворе увеличивается концентрация ионов Н+, следовательно, среда в растворе кислая (рН<7). Процесс гидролиза равновесный, характеризуется константой гидролиза и степенью гидролиза:
Степень гидролиза – это отношение молярной концентрации гидролизовавшейся соли к общей молярной концентрации соли в растворе. h = Mгидр./Mo Многозарядные катионы слабых оснований подвергаются гидролизу ступенчато: Рассмотрим гидролиз CuSO4:
H2O 1 стадия Cu2+ + H2O 2CuSO4 + 2H2O 2 стадия CuOH+ + H2O [CuOH]2SO4 + 2H2O Вторая стадия гидролиза идет в гораздо меньшей степени, чем первая, т.е. «подавлена».
3. Соли, образованные сильным основанием и слабой кислотой (Na2CO3, K2S, Na3PO4 и др.), подвергаются гидролизу по аниону, среда в растворе щелочная (рН>7). Рассмотрим гидролиз соли CH3COONa. CH3COO–Na+ + H2O (H+―OH–) слабая сильное кислота основание
CH3COO– + Na+ + H2O СH3COO– + H2O В растворе увеличивается концентрация ОН– - ионов, следовательно, среда щелочная (рН>7).
4. Соли, образованные слабым основанием и слабой кислотой (NH4F, CH3COONH4 и др.), подвергаются гидролизу одновременно по катиону и аниону, среда в растворе близка к нейтральной (слабокислая или слабощелочная, рН≈7). Например: CH3COO–NH4+ + H2O (H+―OH–) слабая слабое кислота основание
CH3COO– + NH4+ + H2O Некоторые соли подвергаются полному гидролизу, если образующиеся продукты – газы или плохо растворимые соединения. Например:
Al2S3 + 6H2O
Способы получения оксидов
1. Взаимодействие простых веществ с кислородом (реакция горения). S + O2 → SO2 2Ca + O2 → 2CaO 2. Термическое разложение сложных веществ. – Гидроксиды металлов при нагревании теряют воду: to 2Al(OH)3 → Al2O3 + 3H2O; исключение составляют гидроксиды щелочных металлов, которые плавятся без разложения; – плохорастворимые кислоты при нагревании образуют соотвествующие им оксиды: to H2SiO3↓ → SiO2 + H2O; метакремниевая оксид кислота кремния (IV) (силикагель) – легко разлагаются соли, образующие летучие кислотные оксиды: карбонаты и гидрокарбонаты, сульфиты: to CaCO3 → CaO + CO2; карбонат оксид оксид кальция кальция углерода (IV)
– соли, содержащие анионы – окислители при нагревании подвергаются внутримолекулярному окислению-восстановлению: to (NH4)2Cr2O7 → Cr2O3 + N2 + 4H2O дихромат оксид аммония хрома (III) to 2Cu(NO3)2 → 2CuO↓ + 4NO2↑ + O2↑ нитрат оксид меди (II) меди (II) Лабораторная работа № 1. Ортофосфорной кислоты Обмыть стеклянную воронку и стенки стакана (опыт 3) дистиллированной водой. Добавить индикатор – метиловый оранжевый: - охарактеризовать растворимость оксидов фосфора; - составить уравнения реакции оксидов фосфора с водой: P2O5 + H2O →…; P2O3 + H2O →…; - объяснить изменение окраски раствора и какая среда – кислая, нейтральная или щелочная – в полученном растворе; - составить уравнения электролитической диссоциации ортофосфорной кислоты: 1 стадия: H3PO4 2 стадия: H2PO4- 3 стадия: HPO42- - составить выражения для констант диссоциации (К1; К2; К3), привести значения констант (табл.1 приложения); - в каком направлении смещены равновесия диссоциации первой, второй и третьей стадии; - какая стадия диссоциации осуществляется лучше; - назвать все полученные соединения и ионы, содержащие фосфор; - охарактеризовать кислотно-основные свойства оксидов фосфора и ортофосфорной кислоты.
Опыт 5. Получение оксида углерода (IV) разложением малахита [(CuOH)2CO3] и его взаимодействие с водой (показательный) На дно пробирки поместить небольшое количество измельченного малахита – карбоната гидроксомеди (II). Пробирку закрыть пробкой с газоотводной трубкой и закрепить в штативе в наклонном положении. Газоотводную трубку погрузить в пробирку с дистиллированной водой с 1 каплей индикатора метилоранжа. Пробирку с малахитом нагреть в пламени спиртовки до полного завершения реакции: - охарактеризовать внешний вид малахита до реакции и какие изменения происходят по мере его нагревания; - составить уравнение термического разложения карбоната гидроксомеди (II): to (CuOH)2CO3 → … + … + …; - отметить, как изменяется цвет индикатора – метилоранжа в пробирке с дистиллированной водой, дать объяснение; - составить уравнение реакции взаимодействия оксида углерода (IV) с водой: CO2 + H2O - составить уравнения диссоциации угольной кислоты: 1 стадия: H2CO3 2 стадия: HCO3- - составить выражения и привести значения (табл.1 приложения) констант диссоциации угольной кислоты по первой и второй стадии; - охарактеризовать кислотно-основные свойства оксида углерода (IV) и угольной кислоты; - назвать все полученные соединения и ионы, содержащие углерод; - привести все известные названия оксида углерода (IV).
Меди (II) Поместить в первую пробирку 1 микрошпатель оксида кальция, во вторую пробирку – 1 микрошпатель оксида меди (II). В каждую пробирку добавить по 10-12 капель раствора соляной кислоты или разбавленной азотной кислоты. Пробирку с оксидом меди (II) осторожно нагреть. - Отметить, как протекает реакция, активно или нет, что выделяется, в какой пробирке изменяется окраска раствора; - какой оксид растворяется полностью; - составить уравнения основных реакций, учитывая, что образуются соль и вода: CaO + HCl →…; CuO + HCl →…; - в какой пробирке наблюдается выделение газа, какой это газ; - обратить внимание, как хранятся оксид кальция и оксид меди (II), чем могут они загрязняться при хранении на воздухе; - составить уравнение реакции, протекающей при хранении оксида кальция (негашеной извести) на воздухе: CaO + CO2 →…; - составить уравнение реакции примеси карбоната кальция, содержащегося в образце технического оксида кальция, с кислотой: CaCO3 + HCl →… - объяснить, почему оксид кальция загрязняется примесью карбоната в большей степени, чем оксид меди (II); - охарактеризовать кислотно-основные свойства оксида кальция и оксида меди (II); - сравнить, какой оксид проявляет более основные свойства. Хрома (III) В три пробирки поместить по 1 микрошпателю образовавшегося (опыт 6) оксида хрома (III). В 1-ю пробирку прилить дистиллированной воды, во 2-ю - раствор соляной кислоты, в 3-ю – раствор гидроксида натрия. - Отметить изменение окраски растворов, растворимость оксида хрома (III); - составить уравнения реакций: Cr2O3 + HCl →…; Cr2O3 + NaOH + H2O →…; - сделать вывод о свойствах оксида хрома (III). Контрольные тестовые задания по теме «Получение и химические свойства оксидов» Задание 1.1.1 При горении алюминия образуется оксид: Ответы: 1) Al; 2)Al2O3; 3) AlO; 4) AlO2 ; 5) AlO3 Задание 1.1.2 При горении бериллия образуется оксид: Ответы: 1) BeO; 2) BeS; 3) BeO2 ;4) BeO3; 5) Be3N2 Задание 1.1.3 При горении железа образуются оксиды: Ответы: 1) FeN; 2)FeO, Fe2O3; 3)FeN, FeS; 4) FeO, FeCO3; 5) Fe2O3, FeCO3 Задание 1.1.4 При горении кремния образуется оксид: Ответы: 1) SiO; 2) SiO2; 3) Si2O3; 4)SiS2; 5) Si3N4 Задание 1.1.5 При горении цинка образуется оксид: Ответы: 1) ZnS; 2) ZnO; 3) ZnO2; 4) Zn3N2; 5) Zn2O3 Задание 1.1.6 При горении хрома образуется оксид: Ответы: 1) CrC; 2) CrO2; 3) Cr2O3; 4) CrN; 5) CrF3 Задание 1.1.7 При горении фосфора образуются оксиды: Ответы: 1) PN, PO; 2) P2O3, PO2; 3) P2S3, P2S5; 4) PO, PO2; 5) P2O3, P2O5 Задание 1.1.8 При горении никеля образуется оксид: Ответы: 1) NiO; 2) NiS; 3) NiO2; 4) NiO3; 5) NiN Задание 1.1.9 При горении бора образуется оксид: Ответы: 1) BO; 2) BO2; 3) B2O3; 4) BO3; 5) B2O5 Задание 1.1.10 При горении меди образуется оксид: Ответы: 1) CuS; 2) Cu(OH)2; 3)Cu2O3; 4) CuO; 5) CuO2 Задание 1.1.11 При горении стронция образуется оксид: Ответы: 1) SrO; 2) Sr(OH)2; 3)Sr2O; 4) Sr2O3; 5)SrO3
Задание 1.1.12 При горении олова образуется оксид: Ответы: 1) Sn2O; 2) Sn2O3; 3) SnO2; 4) Sn(OH)2; 5) Sn(OH)4 Задание 1.1.13 При горении мышьяка образуются оксиды: Ответы: 1) As2O3, As2O;2) AsO, As2O5; 3)As2O3, As2O5; 4) As2O, AsO2; 5) As2S3, As2S5 Задание 1.1.14 При горении серы обра
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-07-11; просмотров: 325; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.12.148.180 (0.013 с.) |



 Na+ + OH–, NH3∙H2O
Na+ + OH–, NH3∙H2O  NH4+ + OH–
NH4+ + OH– NH3 + H2O
NH3 + H2O  NH4+ + OH–
NH4+ + OH–

 HNO3 + H2O
HNO3 + H2O  Be
Be



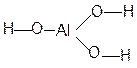 ;
;  ;
;  .
.


 , следовательно, равновесие сильно смещено влево, идет частичный гидролиз.
, следовательно, равновесие сильно смещено влево, идет частичный гидролиз. CuSO4
CuSO4