Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Закономерности изменения кислотно-основных свойств оксидовСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
И гидроксисоединений Кислотно-основные свойства оксидов и гидроксисоединений закономерно изменяются по периоду и подгруппе. В составе гидроксисоединений всегда присутствует фрагмент
Например:
Кислотно-основные свойства вещества определяются типом химических связей I и II. Ионный тип химической связи I определяет её относительно легкую диссоциацию в растворе с образованием ОН—ионов
―Э― О Н → ―Э+1 + ОН—
Вещества с преимущественно ионной связью I проявляют основные свойства. С увеличением электроотрицательности центрального атома (Э) ковалентность и прочность связи I возрастают. Одновременно связь II становится более полярной и менее прочной, это определяет её преимущественную диссоциацию в растворе с образованием ионов Н+:
―Э―О―Н
Такие соединения проявляют кислотные свойства. Соединения с прочными промежуточными по характеру – ионно-ковалентными связями I и II – проявляют амфотерные свойства. С увеличением электроотрицательности центрального атома (Э) фрагмента ––Э––О––Н усиливаются кислотные и ослабляются основные свойства со-ответствующего гидроксисоединения в периоде в направлении слева направо и в подгруппе снизу вверх. Сравним, например, свойства гидроксисоединений элементов III периода и IIA-подгруппы:
Be(OH)2 Амфотер- ный гидроксид NaOH Mg(OH)2 Al(OH)3 H2SiO3 H3PO4 H2SO4 HClO4 Очень Средней Амфотерный Очень Средней Сильная Очень сильное силы гидроксид слабая силы кислота сильная основание основание кислота кислота кислота
Ca(OH)2 - увеличение электроотрицательности центрального Сильное атома (Э) основание - усиление кислотных свойств оксидов и гидроксисое- Sr(OH)2 динений Сильное - ослабление основных свойств оксидов и гидрокси- основание соединений Ba(OH)2 - усиление гидролиза по катиону Сильное основание
С увеличением степени окисления элемента (Э+n) возрастает его электроотрицательность и, следовательно, усиливаются кислотные и ослабляются основные свойства соответствующих оксидов и гидроксисоединений.
+2 +3 +6 Например: CrO Cr2O3 CrO3 Cr(OH)2 Cr(OH)3 H2CrO4 основные амфотерные кислотные
Таблица 7 Сравнительная характеристика свойств оксидов металлов и неметаллов
Генетическая связь между классами неорганических соединений
оксид Гидролиз солей Гидролиз солей – ионно-обменное взаимодействие солей с водой, сопровождающееся разложением соли. Гидролиз – реакция, обратная нейтрализации.
+ Н2О
1. Соли, образованные сильной кислотой и сильным основанием (Na2SO4, KCl, CrNO3 и др.), гидролизу не подвергаются, их растворы нейтральны (рН=7). 2. Соли, образованные сильной кислотой и слабым основанием (NH4Cl, CuSO4, MgCl2 и др.), подвергаются гидролизу по катиону, среда в растворе кислая (рН<7). Составим уравнения гидролиза NH4Cl: NH4Cl + H2O (H++OH-) слабое. сильная. уравнение) основание кислота
NH4+ + Cl– + H2O NH4+ + H2O В растворе увеличивается концентрация ионов Н+, следовательно, среда в растворе кислая (рН<7). Процесс гидролиза равновесный, характеризуется константой гидролиза и степенью гидролиза:
Степень гидролиза – это отношение молярной концентрации гидролизовавшейся соли к общей молярной концентрации соли в растворе.
h = Mгидр./Mo Многозарядные катионы слабых оснований подвергаются гидролизу ступенчато: Рассмотрим гидролиз CuSO4:
H2O 1 стадия Cu2+ + H2O 2CuSO4 + 2H2O 2 стадия CuOH+ + H2O [CuOH]2SO4 + 2H2O Вторая стадия гидролиза идет в гораздо меньшей степени, чем первая, т.е. «подавлена».
3. Соли, образованные сильным основанием и слабой кислотой (Na2CO3, K2S, Na3PO4 и др.), подвергаются гидролизу по аниону, среда в растворе щелочная (рН>7). Рассмотрим гидролиз соли CH3COONa. CH3COO–Na+ + H2O (H+―OH–) слабая сильное кислота основание
CH3COO– + Na+ + H2O СH3COO– + H2O В растворе увеличивается концентрация ОН– - ионов, следовательно, среда щелочная (рН>7).
4. Соли, образованные слабым основанием и слабой кислотой (NH4F, CH3COONH4 и др.), подвергаются гидролизу одновременно по катиону и аниону, среда в растворе близка к нейтральной (слабокислая или слабощелочная, рН≈7). Например: CH3COO–NH4+ + H2O (H+―OH–) слабая слабое кислота основание
CH3COO– + NH4+ + H2O Некоторые соли подвергаются полному гидролизу, если образующиеся продукты – газы или плохо растворимые соединения. Например:
Al2S3 + 6H2O
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-07-11; просмотров: 801; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.255.247 (0.011 с.) |

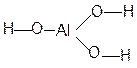 ;
;  ;
;  .
. ―Э―О— + Н+
―Э―О— + Н+

 Основной
Основной
 оксид
оксид





 , следовательно, равновесие сильно смещено влево, идет частичный гидролиз.
, следовательно, равновесие сильно смещено влево, идет частичный гидролиз. CuSO4
CuSO4