
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Электронная структура атомов. Зависимость свойств элементов строения их атомовСодержание книги
Поиск на нашем сайте
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «Казанский национальный исследовательский технический университет Им. А.Н. Туполева - КАИ» (КНИТУ-КАИ)
Лощакова Э.У., Сударев Ю.И.
Методические указания по дисциплине «Химия» для студентов заочного отделения по направлениям подготовки бакалавров: 150100.62 «Материалове-дение и технология материалов», профиль – материаловедение и технология новых материалов; 150700.62 «Машиностроение», профиль – оборудоваие и технология сварочного производства.
Казань 2014
ВВЕДЕНИЕ Химия является одной из важнейших естественных наук. Без знания химии немыслимо понимание процессов превращения веществ, совершенствование и создание новых, в том числе, экологически чистых процессов, машин, приборов, установок, создание веществ и материалов, которых нет в природе. Химизация народного хозяйства приносит большой экономический эффект. Знание законов химии и их использование, выбор оптимального пути процесса исключительно важны для повышения эффективности производства и качества продукции. Знание химии позволяет решать энергетические, сырьевые и экологические проблемы, являющиеся актуальными в любом производстве, бизнесе и жизни. В методических указаниях кратко изложены основные разделы курса общей химии, представлены решения типовых задач и контрольные задания для студентов заочного отделения. За основу в методических указаниях взят учебник для технических направлений и специальностей вузов «Общая химия» / Н.В.Коровин – 4-е изд., испр. и доп. – М.: Высш. шк., 2007. – 557 с. 1. Задачи 1. Сколько значений магнитного квантового числа возможно для электронов энергетического подуровня, орбитальное квантовое число которого 2. Какое максимальное число электронов может содержать атом в электронном слое с главным квантовым числом 3. Определить по правилу Клечковского последовательность заполнения электронных орбиталей, характеризующихся суммой n+l: а) 5; б) 6; в) 7. 4. Указать порядковый номер элемента, у которого: а) заканчивается заполнение электронами орбиталей 4d; б) начинается заполнение подуровня 4p. 5. Какой подуровень заполняется в атомах после подуровня 5s? 6. У какого элемента начинает заполняться подуровень 4f? У какого элемента завершается заполнение этого подуровня? 7. Какой подуровень заполняется в атомах после заполнения подуровня 5p?После заполнения подуровня 5d? 8. Записать электронные формулы атомов электронов с зарядами ядра: а) 8; б) 13; в) 18; г) 23; д) 53; е) 63; ж) 83. Составить графические схемы заполнения электронами валентных орбиталей этих атомов. 9. Среди приведенных ниже электронных конфигураций указать невозможные и объяснить причину невозможности их реализации: а) 10. Сколько вакантных 3d-орбиталей имеют возбужденные атомы: а) Cl; б) V; в) Mn? 11. Сколько неспаренных электронов содержат невозбужденные атомы: а) В; б) S; в) As; г) Cr; д) Hg; е) Eu? 12. Составить электронно–графические схемы ионов 13. Структура валентного электронного слоя атома элемента выражается формулой: а) 14. Электронная структура атома описывается формулой 15. Написать электронные формулы ионов: а) 16. У элементов каких периодов электроны внешнего слоя характеризуются значением n+l=5? 17. Перечислить электронные аналоги среди элементов VI группы периодической системы элементов. Написать в общем виде электронные формулы валентных электронных подуровней атомов этих элементов. 18. На каком основании хром и сера, фосфор и ванадий расположены в одной группе периодической системы? Почему их помещают в разных подгруппах? 19. Почему медь имеет меньший атомный объем, чем калий, расположенный в той же группе и в том же периоде? 20. Для атома углерода значение последовательных потенциалов ионизации составляют (в В): I1=11,3, I2=24,4, I3=47,9, I4=64, I5=392. Объяснить: а) ход изменения потенциалов ионизации; б) чем вызван резкий скачок при переходе от I4 к I5. 21. Энергии ионизации атомов благородных газов составляют (в эВ): He – 24,6; Ne – 21,6; Ar – 15,8; Kr – 14,0; Xe – 12,1; Rn – 10,8. объяснить ход измерения энергии ионизации в этой подгруппе. 22. Значения первых потенциалов ионизации элементов I группы периодической системы элементов соответственно равны (в В): Li – 5,4; Cs – 3,9; Cu – 7,7; Ag – 9,2. Указать: а) у элементов какой подгруппы I группы металлические свойства выражены более резко; б) чем объяснить различный ход изменения значений потенциалов ионизации в подгруппах. 23. Одинакова ли энергия ионизации атома цезия и атома лития, у какого валентный электрон предварительно возбужден на 6s-подуровень? Ответ обосновать. 24. Как изменяется с ростом порядкового номера значение первого потенциала ионизации у элементов второго периода? Чем объяснить, что первый потенциал ионизации атома Ве больше, чем атомов Li и B? 25. Объяснить ход изменения энергии ионизации (в эВ) в ряду Mg – Al – Si: Mg Al Si
Задачи 26. Символ одного из изотопов элемента 27. Ядро атома некоторого элемента содержит 16 нейтронов, а электронная оболочка этого атома – 15 электронов. Назвать элемент, изотопом которого является данный атом. Привести запись его символа с указанием заряда ядра и массового числа. 28. Массовое число атома некоторого элемента равно 181, в электронной оболочке атома содержится 73 электрона. Указать число протонов и нейтронов в ядре атома и название элемента. 29. В природных соединениях хлор находится в виде изотопов 30. Природный магний состоит из изотопов 31. Природный галлий состоит из изотопов 32. Найти массу изотопа 33. Вычислить процент атомов изотопа 34. Период полураспада β— -радиоактивного изотопа Νа24 равен 14,8ч. Написать уравнение реакции распада и вычислить сколько граммов дочернего продукта образуется из 24г Νа24 за 29,6 ч. Адачи 35. При соединении 2,1г железа с серой выделилось 3,77кДж. Рассчитать теплоту образования сульфида железа. 36. Найти количество теплоты, выделяющейся при взрыве 8,4л гремучего газа, взятого при нормальных условиях. 37. Определить стандартную энтальпию (ΔН°298) образования РН3, исходя из уравнения: 2РН3 (г.) + 4О2 (г.) = Р205 (к.) + ЗН2О (ж.); ΔН ° = -2360 кДж 38. Исходя из теплового эффекта реакции ЗСаО (к.) + Р2О5 (к.) = Са3(РО4)2 (к.); ΔН ° = — 739 кДж определить ΔНо 298 образования ортофосфата кальция. 39. Исходя из уравнения реакции СН3ОН (ж.) + 3/2 О2 (г.) = С02 (г.) + Н2О (ж.); ΔН ° = — 726,5 кДж вычислить ΔН°298 образования метилового спирта. 40. При восстановлении 12,7г оксида меди(II) углем (с образованием СО) поглощается 8,24кДж.Определить ΔН°298 образования СиО. 41. При полном сгорании этилена (с образованием жидкой воды) выделилось 6226кДж. Найти объем вступившего в реакцию кислорода (условия нормальные). 42. Водяной газ представляет собой смесь равных 43. Сожжены с образованием Н2О(г)равные объемы водорода и ацетилена, взятых при одинаковых условиях. В каком случае выделится больше теплоты? Во сколько раз? 44. Определить ΔН°298 реакции ЗС2Н2(г.)=С6Н6(ж.),если ΔН°298 реакции сгорания ацетилена с образованием С02(г.) и Н2О(ж.) равно —1300 кДж/моль,ΔН°298образования бензола (ж.) составляет 82,9 кДж/моль. 45. Определить ΔН°298 образования этилена, используя следующие данные: С2Н4 (г.) + 302 (г.) = 2С02 (г.) + 2Н20 ΔН °=-1323кДж С (графит) + О2 (г.) = СО2 (г.); ΔН °=-393,5кДж Н2(г)+1/2О2(г)=Н2О(г) ΔН °=-241,8кДж 46. Сравнить ΔН°298 реакции восстановления оксида железа (III) различными восстановителями при 298 К: а) Fe2O3 (к.) + Н2 (г.) = 2 Fe (к.) + ЗН2О (г.) б) Fe2O3 (к.) + ЗС (графит) =2Fe (к.) + ЗСО (г.) в) Fe2O3 (к.) + ЗСО (г.) = 2Fe (к.) + ЗСО2 (г.) 47. Найти массу метана, при полном сгорании которого (с образованием жидкой воды) выделяется теплота, достаточная для нагревания 100г водыот 20 до 30 °С. Мольную теплоемкость воды принять равной 75,3 Дж/(моль*К). 48. Вычислить ΔН°298 образования MgCO3(к.) при 298 К, пользуясь следующими данными: С (графит) + О2 (г.) = СО2 (г.); ΔН°298 = — 393,5 кДж 2Mg (к.) + О2 = 2MgO (к.); ΔН°298 = - 1203,6 кДж MgO (к.) + С02 (г.) = MgC03 (к.); ΔН°298 = - 1 17,7 кДж
49. Вычислить ΔН°298 реакций: д) 2 Li (к.) + 2Н2О (ж.) = 2Li+ (водн.) + 2ОН" (водн.) + Н2 (г.) б) 2Na (к.),+ 2Н2О (ж.) = 2Na+ (водн.) + 2ОН' (водн.) + Н2 (г.) Стандартные энтальпии образования Li+ (водн.), Na+ (водн) и ОН- (водн.) принять соответственно равными —278,5, —239,7 и —228,9 кДж/моль. 50. Вычислить значение ΔН°298 для протекающих в организме реакций превращения глюкозы: a) C6H12O6 (к.) = 2С2Н5ОН (ж.) + 2СО2 (г.) б) С6Н12О6 (к.) + 602 (г.) = 6СО2 (г.) + 6Н2О (ж.) Какая из этих реакций поставляет организму больше энергии? 51. Зависит ли значение ΔН° реакции от присутствия в системе катализаторов? Ответ обосновать. 52. Объяснить, почему процессы растворения веществ в воде могут самопроизвольно протекать не только с экзотермическим (ΔН°<0), но и с эндотермическим (ΔН° >0) эффектом. 53. Не производя вычислений, установить знак ∆S0 следующих процессов: а) 2NH3 (г.) = N2 (г.) + ЗН2 (г.) б) С02 (к.) = С02 (г.) в) 2NO (г.) + О2 (г.) = 2NO2 (г.) г) 2H2S (г.) + ЗО2 (г.) = 2Н20 (ж.) + 2SO2 (г.) д)2СН30Н (г) + 302(г.) = 4Н2О (г.)+ 2CO2 (г.) 54. Определить знак изменения энтропии для реакции: 2А2(г.) +В2(г.) =2А2В(ж.). Возможно ли протекание этой реакции в стандартных условиях? Ответ обосновать. 55. Указать знаки ΔН, ΔS и ∆G для следующих процессов а) расширение идеального газа в вакуум; б) испарение воды при 100°С и парциальном давлении паров воды 101,325 кПа (760мм рт. ст.); в) кристаллизация переохлажденной воды. 56. Определить знаки ΔН°, ∆S° и ∆G° для реакции 57. Почему при низких температурах критерием, 58. Рассчитать значения ∆Gо298 следующих реакций и установить, в каком направлении они могут протекать самопроизвольно в стандартных условиях при 25 °С': а) NiO (к.) + РЬ (к). = Ni (к.) + РЬО (к.) б) РЬ (к.) + СиО (к.) = РЬО (к.) + Си (к.) в) 8А1 (к). + 3Fe3O4 (к.) = 9Fe (к.) + 4А12О3 (к.) 59. Пользуясь справочными данными, показать, что в стандартных условиях при 25 °С реакция Си (к.) + ZnO (к.) = СиО (к.) + Zn (к.) невозможна. 60. Установить, протекание каких из нижеследующих реакций возможно в стандартных условиях при25°С: а) N2 (г.) + 1/202 (г.) = N20 (г.) б) 4НС1 (г.) + 02 (г.) = 2С12 (г.) + 2Н2О (ж.) в) Fe2O3 (к.) + ЗСО (г.) = 2Fe (к.) + ЗСО2 (г.) 61. Вычислить ∆G° для реакции: СаСОз (к.) = СаО (к.) + СО2 (г.) при 25, 500 и 1500°С: Зависимостью ΔН ° и ∆S" от температуры пренебречь. Построить график зависимости ∆G° от температуры и найти по графику температуру, выше которой указанная реакция в стандартных условиях может протекать самопроизвольно. 62. Вычислить значения ∆G298 следующих реакций восстановления оксида железа (II): а) FeO (к.) + 1/2С (графит) = Fe (к.) + '/2СО2 (г.). б) FeO (к.) + С (графит) = Fe (к.) + СО (г.) в) FeO (к.) + СО (г.) = Fe (к.) + СО2 (г.) Протекание какой из этих реакций наиболее вероятно? 63. Какие из перечисленных оксидов могут быть восстановлены алюминием при 298 К: СаО, FeO, CuO,РЬО, Fe2O3, Cr2O3? 64. Какие из перечисленных оксидов могут быть восстановлены водородом до свободного металла при 298 К: СаО, ZnO, SnO2,NiO, A12O3? 65. Указать какие из реакций образования оксидов азота и при каких температурах (высоких или низких) могут в стандартных условиях протекать самопроизвольно: а) 2N2 (г.) + 02 (г.) = 2N20 (г.);ΔН ° 298> О б) N2 (г.) + 02 (г.) = 2NO (г.); ΔН ° 298> О в) 2NO (г.) + О2 (г.) = 2NO2 (к.); ΔН ° 298 < О г) N0 (г.) + N02(г.) = N203 (к.); ΔН ° 298 < О д) N2 (г.) + 202 (г.) = 2N02 (г.); ΔН ° 298 > О
Задачи 66. Найти значение константы скорости реакции А+В 67. Во сколько раз изменится скорость реакции 2А+В 68. В два сосуда одной и той же вместимости введены: в первый 1 моль газа А и 2 моль газа В, во второй – 2 моль газа А и 1 моль газа В. Температура в обоих сосудах одинакова. Будет ли различаться скорость реакции между газами А и В в этих сосудах, если скорость реакции выражается: а) уравнением 69. Через некоторое время после начала реакции ЗА+В 70. В системе СО+Сl2 = СОСl2 концентрацию увеличили от 0,003 до 0,12 моль/л, а концентрацию хлора от 0,02 до 0,06 моль/л. Во сколько раз возросла скорость прямой реакции? 71. Реакция между веществами А и В выражается уравнением: А+2В 72. Как изменится скорость реакции 2 NO(г.) + О 73. Две реакции протекают при 25 74. Чему равен температурный коэффициент скорости реакции, если при увеличении температуры на 30 градусов скорость реакции возрастает в 15,6 раза? 75. Температурный коэффициент скорости некоторой реакции равен 2,3. Во сколько раз увеличится скорость этой реакции, если повысить температуру на 25 градусов? 76. При 150 77. Изменится ли значение константы скорости реакции: а) при замене одного катализатора другим; б) при изменении концентраций реагирующих веществ? 78. Зависит ли тепловой эффект реакции от ее энергии активации? Ответ обосновать. 79. Для какой реакции - прямой или обратной – энергия активации больше, если прямая реакция идет с выделением теплоты? 80. Во сколько раз увеличиться скорость реакции, протекающей при 298 К, если энергию активации ее уменьшить на 4 Дж/моль? 81. Чему равна энергии активации реакции, если при повышении температуры от 290 до 300К скорость ее увеличится в 2 раза? 82. Каково значение энергии активации реакции, скорость которой при 300 К в 10 раз больше, чем при 280 К? 83. Энергия активации реакции 84. Зависит ли температурный коэффициент скорости реакции от значения энергии активации? Ответ обосновать. 85. Зависит ли значение энергии активации реакции в случае гетерогенного катализа от площади поверхности катализатора и от ее структуры? 86. Реакция 87. Схематически изобразить энергетическую диаграмму экзотермической реакции 88. Схематически изобразить энергетическую диаграмму реакции 89. Почему в цепной реакции
Задачи. 90. Нужно приготовить раствор, содержащий в 1л 0,5моля NaCl, 0,16 моля KCl, 0,24 моля K2SО4. Как это сделать имея в своем распоряжении только NaCl, KCl и Nа2SО4? 91. Константа диссоциации масляной кислоты С3Н7СООН 1,5*10 92. Найти степень диссоциации хлорноватистой кислоты НОCl в 0,2 н. растворе. 93. Степень диссоциации муравьиной кислоты HCOOH в 0,2 н. растворе равна 0,03. Определить константу диссоциации кислоты и значение рК. 94. Степень диссоциации угольной кислоты H2СО3 по первой ступени в 0,1 н. растворе равна 2,11*10 95. При какой концентрации раствора степень диссоциации азотистой кислоты HNO 96. В 0,1 н. растворе степень диссоциации уксусной кислоты равна 1,32*10 97. Сколько воды нужно прибавить к 300 мл 0,2 М раствора уксусной кислоты, чтобы степень диссоциации кислоты удвоилась? 98. Чему равна концентрация ионов водорода Н 99. Вычислить 100. Вычислить 101. Во сколько раз уменьшится концентрация ионов водорода, если к 1 л о,005 М раствора уксусной кислоты добавить 0,05 моля ацетата натрия? 102. Рассчитать концентрацию ионов СН3СОО- в растворе, 1 л которого содержит 1 моль СН 103. Исходя из значений последовательных констант диссоциации ортофосфорной кислоты, определить знак изменения энергии Гиббса для каждой из трех ступеней диссоциации. Для какой из них 104. Раствор, содержащий 2,1 г. КОН в 250 г воды, замерзает при -0,519 105. При нуле градусов осмотическое давление 0,1 н. раствора карбоната калия равно 272,6 кПа. Определить кажущуюся степень диссоциации соли. 106. Раствор, содержащий 0,53 г карбоната натрия в 200г воды, кристаллизуется при -0,13 107. В равных количествах воды растворено в одном случае 0,5 моля сахара, а в другом -0,2 моля CaСl 108. При100 109. В 1 л 0,01 М раствора уксусной кислоты содержится 6,26* 10 110. Кажущаяся степень диссоциации хлорида калия в 0,1 н. растворе равна 0,80. Чему равно осмотическое давление этого раствора при 17 ОСНОВЫ ЭЛЕКТРОХИМИИ Степень окисленности Степень окисленности элемента в соединении определяется как число электронов, смещенных от атома данного элемента к другим атомам (при положительной окисленности) или от других атомов к атому данного элемента (при отрицательной окисленности). Для вычисления степени окисленности элемента в соединении следует исходить из следующих положений: 1) степени окисленности элементов в простых веществах принимаются равными нулю; 2) алгебраическая сумма степеней окисленности всех атомов, входящих в состав молекулы, равна нулю; 3) постоянную степень окисленности в соединениях проявляют щелочные металлы (+1), металлы главной подгруппы II группы, цинк и кадмий (+2); 4) водород проявляет степень окисленности +1 во всех соединениях, кроме гидридов металлов (NaH, CaH2 и т. п.), где его степень окисленности равна —1; 5) степень окисленности кислорода в соединениях равна —2, за исключением пероксидов (— 1) и фторида кислорода OF2 (+2). Исходя из сказанного, легко, например, установить, что в соединениях NH3, N2H4, NH2OH, N2O, NO, HNO3, N02 и HNO3 степень окисленности азота соответственно равна -3, —2, —1, +1, +2, +3, +4, +5. Окислительно-восстановительными называются такие реакции, в результате которых изменяется степень окисленности одного или нескольких элементов, входящих в состав реагирующих веществ. Отдача атомом электронов, сопровождающаяся повышением его степени окисленности, называется окислением; присоединение атомом электронов, приводящее к понижению его степени окисленности, называется восстановлением. Вещество, в состав которого входит окисляющийся элемент, называется восстановителем; вещество, содержащее восстанавливающийся элемент, называется окислителем. Так, в реакции: 4А1 + ЗО2 = 2А12О3 алюминий повышает степень окисленности от 0 до +3 и служит восстановителем; в результате реакции восстановленная форма алюминия (свободный алюминий) окисляется и превращается в сопряженную с ней окисленную форму (алюминий в степени окисленности +3). Кислород в этой реакции понижает степень окисленности от 0 до —2 и служит окислителем; в результате реакции окисленная форма кислорода (свободный кислород) восстанавливается и превращается в сопряженную с ней восстановленную форму (кислород в степени окисленности —2). Оба процесса — окисление и восстановление — протекают одновременно. При этом общее число электронов, отданных восстановителем, равно общему числу электронов, принятых окислителем, В рассмотренной реакции взаимодействуют два вещества, одно из которых служит окислителем (кислород), а другое — восстановителем (алюминий). Такие реакции относятся к реакциям межмолекулярного окисления-восстановления. Реакция 4HSPO3 = ЗН3РО4 + РН3 служит примером реакций самоокисления-самовосстановления (диспропорционирования), в которых одновременно образуются соединения, содержащие данный элемент в более окисленном и в более восстановленном состоянии по сравнению с исходным; при этом исходное вещество проявляет функции как окислителя, так и восстановителя. В последней реакции фосфористая кислота НзРО3 (степень окисленности фосфора +3) выступает одновременно в роли окислителя, причем фосфор восстанавливается до степени окисленности —3 (РН3), и в роли восстановителя, причем фосфор окисляется до степени окисленности +5 (НзРО4). Подобные реакции возможны, если соответствующий элемент находится в исходном соединении в промежуточной степени окисленности; так, в рассмотренном примере степень окисленности фосфора в исходном соединении (+З) имеет промежуточное значение между возможными максимальной (+5) и минимальной (—3) степенями окисленности этого элемента. В реакции (NH4)2Cr207 = N2 + Cr203 + 4Н20 восстанавливается хром, понижающий степень окисленности от +6 до +3, а окисляется азот, повышающий степень окисленности от —3 до 0. Оба эти элемента входят в состав одного и того же исходного вещества. Реакции такого типа называются реакциями внутримопекулярного окисления-восстановления. К ним относятся, в частности, многие реакции термического разложения сложных веществ. Задачи 111.Определить степень окисленности серы в следующих соединениях: SO2, H2S, Na2SO3, CS2, H2SO4, As2S3. 112.Определить степень окисленности хрома в следующих соединениях: К2СгО4, Сг2О3, Fe(CrO2)2, K2Cr2O7, Cr2(SO4)3 , Na3[Cr(OH)6]. 113.Указать, какие из приведенных процессов представляют собой окисление и какие — восстановление: S→SO42-; S→S2-; Sn→Sn4+; К→К+; Br2→2Br; 2Н+→Н2; Н2→2Н-; V2+→VO3-; Сℓ→СℓО3 -; IО3 -→I2; МпО4-→МпО42-. 114. Указать, в каких из приведенных процессов происходит окисление азота и в каких — восстановление, как изменяется в каждом случае степень окисленноста азота: NH4+→N2; NO3- →NO; NO2-→N03-; NO2→NO2-. 115. Какие из следующих реакций относятся к окислительно-восстановительным? а) Н2 + Вг2 = 2НВг б) NH4C1 = NH3 + НС1 в) NH4NO3 = N2O + 2Н2О г) 2K2CrO4 +H2SO4 =-K2Cr2O7 + K2SO4 + H2O д) НзВОз + 4HF = HBF4 + ЗН2О е) Fe + S=FeS 116. Для следующих реакций указать, какие вещества и за счет каких именно элементов играют роль окислителей и какие — восстановителей: а) S02 + Вг2 + 2Н2О = 2HBr + H2SO4 б) Mg + H2SO4 = MgSO4 + Н2 в) Си + 2H2SO4 = CuSO4 + SO2 +2H2O г) 3I2 + 6КОН = КIО3 + 5KI + ЗН2О 117. Какие из приведенных реакций относятся к реакциям межмолекулярного окисления-восстановления, к реакциям внутримолекулярного окисления-восстановления и к реакциям диспропорционирования? а) 4КМnО4 + 4КОН = 4К2МnО4 +О2 + 2Н2О б) H2SO3 + 2H2S = 3S + ЗН2О в) NH4NO2 = N2 + ЗН2О г) 4Р + ЗКОН + ЗН2О = РН3 + ЗКН2Р02 д) 2Н2О2 = 2Н2О + О2 е) 2KMnO4 + 3MnSO4 + 4Н2О = 5MnO2 + K2SO4 + 2H2SO4 118. Указать, какие из перечисленных реакций относятся к окислительно-восстановительным: а) Cr2(S04)3 + 6RbOH = 2Cr(OH)3 + 3Rb2SO4 б) 2Rb + 2Н2О = 2RbOH + Н2 в) 2CuI2 = 2CuI + I2 г) NH4C1 + NaOH == NaCl + NH3 + H2O д)2К4 [Fe(CN)6] + Br2 = 2Кз [Fe(CN)6] + 2КВг 119. Среди приведенных превращений указать реакции диспропорционирования: а) S + КОН →K2SO3 + K2S + Н2О б) Аи2О3 →Au + O2 в) НС1+ СгО3 →СгС13 + С12 + Н2О г) НСlО3 → С1О2 + НСlО4 д) N2H4 → N2 + NH3 е) AgNO3 → Ag+NO2 + O2 120.До каких продуктов может быть окислена вода: а) до О2 и Н+; б) до ОН- и Н2; в) до 2ОН-? 121.В каких из указанных превращений кислород выполняет функции восстановителя: а) Ag2O →Ag + О2 б) Ft + Н2О →HF + О2 в) ΝН3 + О2 →N2 + Н2О г) AgNO3 + КОН + Н2О2 →Ag + KNO3 + О2 Окислители и восстановители Элементы, находящиеся в высшей степени окисленности, могут только восстанавливаться, так как их атомы способны лишь принимать электроны: сера в степени окисленности +6 (H2SO4), азот +5 (HNO3 и нитраты), марганец +7 (перманганаты), хром+6 (хроматы и дихроматы), свинец +4 (РЬО2) и др. Напротив, элементы, находящиеся в низшей степени окисленности, могут только окисляться, поскольку их атомы способны лишь отдавать электроны: сера в степени окисленности —2 (H2S и сульфиды), азот —3 (NH3 и его производные), иод —1 (HI и иодиды) и др. Вещества, содержащие элементы в промежуточных степенях окисленности, обладают окислительно-восстановительной двойственностью. Такие вещества способны и принимать и отдавать электроны, в зависимости от партнера, с которым они взаимодействуют, и от условий проведения реакции. Ниже характеризуются некоторые наиболее важные окислители и восстановители. Окислители 1. Окислительные свойства характерны для типичных неметаллов (F2, С12, Вг2, I2, О2) в элементарном (свободном) состоянии. Галогены, выступая в качестве окислителей, приобретают степень окисленности —1, причем от фтора к иоду окислительные свойства ослабевают: 2F2 + 2Н2О = 4HF + О2 4С12 + H2S + 4Н2О = 8НС1 + H2S04 I2 + H2S=2HI + S Кислород, восстанавливаясь, переходит в состояние окисленности —2 (Н2О или ОН-); 4ΝН3 + 5О2 = 4NO + 6Н2О 4FeS04 + О2 + 2Н2О = 4 (FeOH) SO4 2.Среди кислородсодержащих кислот и их солей к наиболее важным окислителям относятся КМпО4, К2СгО4, К2Сг2О7, концентрированная серная кислота, азотная кислота и нитраты, кислородсодержащие кислоты галогенов и их соли. Перманганат калия, проявляя окислительные свойства за счет Mn(VII), восстанавливается до разных продуктов в зависимости от кислотности среды: в кислой среде — до Мп2+ (степень окисленности марганца +2), в нейтральной и слабощелочной — до МnО2 (степень окисленности +4), в сильнощелочной — до манганат-иона МnО42- (степень окисленности +6): 5K2SO3 + 2КМnО4 + 3H2SO4 = 6K2SO4 + 2MnSO4 + ЗН2О ЗК2 S O3 + 2КМnО4 + Н2О = ЗК2 S О4 + 2MnO2 + 2KOH K2SO3 + 2КМn04 + 2КОН = K2SO4 + 2К2МnО4 + Н20 Хромат и дихромат калия (К2СгО4 и К2Сг2О7) выступают в роли окислителей в кислой среде, восстанавливаясь до иона Сг3+, Поскольку в кислой среде равновесие:2СгО42- + 2Н+ ↔ Сг2О72- + Н2О смещено вправо, то окислителем служит ион Сг2О72- К2Сг207 + 3H2S + 4H2S04 = Cr2(S04)3 + 3S + K2SO4 + 7H2O Концентрированная серная кислота проявляет окислительные свойства за счет серы в степени окисленности +6, которая может восстанавливаться до степени окисленности +4 (SО2 ), 0 (свободная сера) или —2 (H2S). Состав продуктов восстановления определяется главным образом активностью восстановителя, а также соотношением количеств восстановителя и серной кислоты, концентрацией кислоты и температурой системы. Чем активнее восстановитель и выше концентрация кисл
|
|||||
|
Последнее изменение этой страницы: 2016-12-13; просмотров: 300; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.12.233 (0.014 с.) |


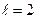 ?
? 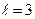 ?
? ?
?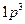 ; б)
; б) 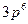 ; в)
; в)  ; г)
; г) 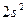 ; д)
; д) 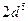 ; е)
; е) 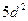 ; ж)
; ж) 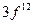 ; З.)
; З.) 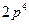 ; и)
; и)  .
. и
и  . Чем можно объяснить особую устойчивость электронной конфигурации иона
. Чем можно объяснить особую устойчивость электронной конфигурации иона 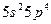 ; б)
; б) 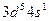 . Определить порядковый номер и название элемента.
. Определить порядковый номер и название элемента.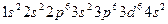 . Какой это элемент?
. Какой это элемент? ; б)
; б) 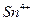 ; в)
; в)  ; г)
; г) 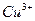 ; д)
; д) 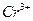 ;е)
;е)  .
. 7,6 6,0 8,2
7,6 6,0 8,2 15,0 18,8 16,3
15,0 18,8 16,3 80,1 28,4 33,5
80,1 28,4 33,5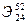 . Указать: а) название элемента; б) число протонов и нейтронов в ядре; в) число электронов в электронной оболочке атома.
. Указать: а) название элемента; б) число протонов и нейтронов в ядре; в) число электронов в электронной оболочке атома.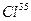 [75,5% (масс.)] и
[75,5% (масс.)] и 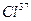 [24,5% (масс.)]. Вычислить среднюю атомную массу природного хлора.
[24,5% (масс.)]. Вычислить среднюю атомную массу природного хлора. ,
, 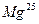 ,
,  . Вычислить среднюю атомную массу природного магния, если содержание отдельных изотопов в атомных процентах соответственно равно 78, 6, 10,1 и 11,3.
. Вычислить среднюю атомную массу природного магния, если содержание отдельных изотопов в атомных процентах соответственно равно 78, 6, 10,1 и 11,3.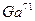 и
и  . В каком количественном соотношении находятся между собой числа атомов этих изотопов, если средняя атомная масса галлия равна 69,72?
. В каком количественном соотношении находятся между собой числа атомов этих изотопов, если средняя атомная масса галлия равна 69,72?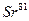
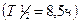 , оставшуюся через 25,5 ч хранение, если первоначальная масса его составляла 200 мг.
, оставшуюся через 25,5 ч хранение, если первоначальная масса его составляла 200 мг.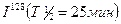 , оставшихся нераспавшимися после его хранения в течение 2,5 ч.
, оставшихся нераспавшимися после его хранения в течение 2,5 ч.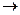 АВ, если при концентрациях веществ А и В, равных соответственно 0,05 и 0,01 моль/л, скорость реакции равна 5*10
АВ, если при концентрациях веществ А и В, равных соответственно 0,05 и 0,01 моль/л, скорость реакции равна 5*10  моль/л (л *мин).
моль/л (л *мин). В, если концентрацию вещества А увеличить в два раза, а концентрацию вещества В уменьшить в два раза?
В, если концентрацию вещества А увеличить в два раза, а концентрацию вещества В уменьшить в два раза?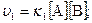 б) уравнением
б) уравнением 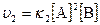 ?
?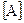 =0,03 моль/л;
=0,03 моль/л; 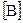 =0,01 моль/л;
=0,01 моль/л; 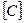 = 0,008 моль/л. Каковы исходные концентрации веществ А и В?
= 0,008 моль/л. Каковы исходные концентрации веществ А и В?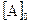 = 0,03 моль/л,
= 0,03 моль/л, 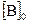 = 0,05 моль/л. Константа скорости реакции равна 0,4. Найти начальную скорость реакции скорость реакции по истечении некоторого времени, когда концентрация вещества А уменьшится на 0,01 моль/л.
= 0,05 моль/л. Константа скорости реакции равна 0,4. Найти начальную скорость реакции скорость реакции по истечении некоторого времени, когда концентрация вещества А уменьшится на 0,01 моль/л. С с одинаковой скоростью Температурный коэффициент скорости первой реакции равен 2,0, а второй – 2,5. Найти отношение скоростей этих реакций при 95
С с одинаковой скоростью Температурный коэффициент скорости первой реакции равен 2,0, а второй – 2,5. Найти отношение скоростей этих реакций при 95  равна 10 Дж/моль. Во сколько раз изменится скорость реакции при повышении температуры от 27 до 37
равна 10 Дж/моль. Во сколько раз изменится скорость реакции при повышении температуры от 27 до 37 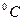 ?
? протекает с выделением теплоты. Однако для того, чтобы реакция началась, исходную смесь газов надо нагреть. Как это объяснить?
протекает с выделением теплоты. Однако для того, чтобы реакция началась, исходную смесь газов надо нагреть. Как это объяснить? . Какая реакция – прямая или обратная характеризуется большей константой скорости?
. Какая реакция – прямая или обратная характеризуется большей константой скорости?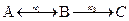 , если
, если  , а для реакции в целом
, а для реакции в целом 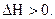
 зарождение цепи начинается с радикала С
зарождение цепи начинается с радикала С 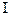 *, а не с радикала Н*?
*, а не с радикала Н*? . Вычислить К
. Вычислить К  .
.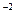 .При какой концентрации азотистой кислоты HNO
.При какой концентрации азотистой кислоты HNO  в водном растворе муравьиной кислоты, если
в водном растворе муравьиной кислоты, если  равна 0,03?
равна 0,03? в 0,02 М растворе сернистой кислоты. Диссоциацией кислоты во второй ступени пренебречь.
в 0,02 М растворе сернистой кислоты. Диссоциацией кислоты во второй ступени пренебречь. и
и  в 0,05 М растворе Н
в 0,05 М растворе Н  СООН и 0,1 моля НCl, считая диссоциацию последнего полной.
СООН и 0,1 моля НCl, считая диссоциацию последнего полной. имеет наибольшее абсолютное значение?
имеет наибольшее абсолютное значение? ее молекул и ионов. Определить степень диссоциации уксусной кислоты.
ее молекул и ионов. Определить степень диссоциации уксусной кислоты.



