
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Гидроксиды щелочных элементов. Получение, свойства, применение.Содержание книги
Поиск на нашем сайте
Гидроксиды элементов первой группы являются сильными основаниями. Они представляют собой бесцветные гигроскопичные вещества, легко расплывающиеся на воздухе и постепенно превращающиеся в карбонаты. Гидроксиды щелочных металлов прекрасно растворимы в воде, хорошо растворимы в этаноле (растворимость значительно возрастает от LiOH к CsOH). Спиртовые растворы являются сильными основаниями, так как в них присутствуют этилат-ионы: С2Н5ОН + ОН- = С2Н5O- + Н2O
Гидроксиды элементов первой группы образуют различные полиморфные модификации. Для КОН известна высокотемпературная модификация, построенная по типу NaCl, где позиции хлорид-иона занимает ион ОН-, за счет свободного вращения принимающий форму сферы. Гидроксиды натрия, калия, рубидия и цезия плавятся без разложения, в то время как LiOH при прокаливании выделяет воду: 2LiOH = Li2O + Н2O Среди гидроксидов металлов первой группы наибольшее промышленное применение имеет гидроксид натрия (едкий натр, каустическая сода). Его получают в больших количествах путем электролиза раствора хлорида натрия с инертным анодом и диафрагмой, разделяющей катодное и анодное пространство. Для получения чистой щелочи используют ртутный анод. При этом атомы натрия, образующиеся при восстановлении ионов Na+, связываются в амальгаму, которую затем разрушают водой, выделяя гидроксид натрия. Для обезвоживания (удаления гидратной воды) щелочь расплавляют, затем гранулируют, выливая тонкой струей на железные листы. Гидроксиды рубидия и цезия удобнее получать из солей при помощи обменных реакций, например: Rb2SO4 + Ва(ОН)2 = BaSO4 + 2RbOH Взаимодействие гидроксидов щелочных металлов с кислотами и кислотными оксидами приводит к образованию солей. Практически важным является образование формиата натрия при взаимодействии угарного газа с расплавом едкого натра: NaOH + СО = HCOONa Гидроксиды щелочных металлов являются довольно активными реагентами. Так, при нагревании с щелочами многие неметаллы диспропорционируют: Р4 — на РН3 и H2PO2-, S8 — на S2- и смесь серасодержащих оксоанионов, Сl2 — на Сl- и ОСl- (или С1O3-) в зависимости от температуры. Неметаллы (Si, As), не образующие устойчивых гидридов, и некоторые металлы (Zn, Be, А1) реагируют с растворами щелочей с выделением водорода: Zn + 2NaOH + 2Н2O = Na2[Zn(OH)4] + Н2 Гидроксид натрия используется для изготовления мыла, синтетических моющих средств, искусственного волокна, органических соединений, например фенола. Также его используют для очистки нефти, масел, в производстве бумаги, для получения соды. КОН используют как сырье в производстве К2СО3, для получения мыла, в качестве электролита в щелочных аккумуляторах (как и LiOH), в качестве поглотителя СО2 (как и LiOH) и осушителя (как и NaOH).
18. Нитраты, сульфаты, карбонаты щелочных элементов – свойства, получение, применение. Изменение термической устойчивости этих солей в ряду литий – цезий. Получение соды (аммиачный (Сольвэ) и сульфатный (Леблана) методы) и поташа. Каустификация соды. Калийные удобрения. Малорастворимые соли лития, калия и натрия. Большинство солей элементов первой группы хорошо растворимы в воде, но (за исключением солей лития) практически нерастворимы в неводных растворителях. Малой растворимостью в воде обладают соли лития с небольшими анионами (LiF, Li2CO3, Li2SiO3, Li3PO4), а также соли K+, Rb+ и Cs+ с крупными анионами: гидротартраты МНС4Н4О6, хлораты МСlO3, перхлораты МСlO4, гексахлороплатинаты M2[PtCl6], соли фосфорномолибденовой M3[PMo12O40] и кремневольфрамовой M4[SiW12O40] кислот. Из солей натрия низкой растворимостью обладают только гексагидроксоантимонат Na[Sb(OH)6], магний- и цинкуранилацетат NaM(UO2)3(CH3COO)9 • 6Н20 (М = Mg, Zn). Одной из причин низкой растворимости этих солей является высокая энергия кристаллической решетки, что достигается при структурном соответствии (близости размеров) катиона и аниона. Термическая устойчивость солей кислородных кислот (карбонатов, сульфатов, фосфатов) возрастает вниз по подгруппе, изменяясь симбатно росту радиуса и усилению степени ионности связи. Средний карбонат натрия (кальцинированная сода) используется в химическом, стекольном и бумажном производстве, гидрокарбонат NaHCO3 (пищевая сода) применяется при приготовлении пищи и в медицине. Хотя сода встречается в природе в виде минерала троны Nа2СO3.NaHCO3.2Н2O, уже в XVIII в. возникла необходимость ее дополнительного производства. Первый промышленный способ был разработан Лебланом в 1791 г. Он заключается в прокаливании при температуре 1000 °С обезвоженного мирабилита с углем и известняком: Na2SO4 + 4С + СаСO3 = 4CO + Na2CO3 + CaS При обработке плава горячей водой сульфид кальция гидролизуется, образуя сероводород и малорастворимый гидроксид кальция, а сода остается в растворе. В настоящее время соду производят по методу Сольве, основанному на низкой растворимости гидрокарбоната натрия в концентрированных солевых растворах. В водно-аммиачный насыщенный хлоридом натрия раствор пропускают углекислый газ, при этом образующийся NaHCO3, как менее растворимый в этих условиях (растворимость NaHCО3 при 15 °С: 8,09 г в 100 г воды и 1,51 г в 100 г насыщенного раствора NH4Cl), выпадает в осадок: NaCl + Н2О + СО2 + NH3 = NaHCО3 + NH4Cl Схема процесса показана на рис. 2.9. Для получения Na2CO3 выделенный гидрокарбонат прокаливают (кальцинируют): 2NaHCO3 = Na2CO3 + Н2O + СO2 Мировое производство соды составляет около 30 млн т в год. Из фильтрата, оставшегося после отделения гидрокарбоната, действием гашеной извести регенерируют аммиак. Единственным отходом производства является хлорид кальция, утилизация которого представляет серьезную экологическую проблему. Попытка использовать хлорид кальция для борьбы с гололедицей приводит к засаливанию почвы и угнетению растительного покрова. Сейчас для устранения обледенения предложено использовать экологически более чистый ацетат аммония. Метод Сольве нельзя использовать для получения КНСO3 из-за его значительно большей растворимости (22,7 г в 100 г воды при 0 °С), поэтому К2СO3 (поташ) получают другими способами, в основном как побочный продукт переработки нефелиновых руд на глинозем. Интересно, что еще в начале XX в. во Франции был запатентован метод производства поташа по схеме Сольве, но с заменой аммиака на триметиламин. Растворимость хлорида триметиламмония во много раз превосходит растворимость NH4Cl, поэтому при концентрировании раствора удается выделить значительное количество гидрокарбоната калия. Широкого применения метод не нашел из-за высокой стоимости триметиламина. Различная растворимость в воде гидрокарбонатов натрия и калия связана с особенностями их строения. Для обоих соединений характерно наличие водородных связей между анионами, однако в NaHCO3 они связывают гидрокарбонат-ионы в димеры, а в КНСO3 — в бесконечные цепи.
Ионы щелочных металлов бесцветны. Почти все соли, образуемые ими с обычными кислотами, хорошо растворимы в воде. В противоположность выделяющимся обычно без кристаллизационной воды солям К, Rb и Cs для солей лития весьма характерно образование кристаллогидратов. Натрий занимает промежуточное положение. Соли щелочных металлов и слабых кислот вследствие гидролиза показывают в растворе щелочную реакцию. Комплексные соединения с ионом щелочного металла в качестве комплексообразователя известны лишь для лития. Напротив, весьма обычны комплексные производные, у которых ионы щелочного металла располагаются во внешней сфере. Многие из подобных комплексов отличаются устойчивостью, возрастающей по ряду Li–Cs. Галоидные соли рассматриваемых элементов представляют собой довольно тугоплавкие кристаллические вещества, за исключением LiF (и отчасти NaF), хорошо растворимые в воде. Наибольшее практическое значение из них имеет NaCl. Помимо потребления с пищей (отсюда название – поваренная соль) громадные количества хлористого натрия используются промышленностью. Его ежегодное мировое потребление исчисляется десятками миллионов тонн. Источниками промышленного получения NaCl служат, с одной стороны, природные залежи каменной соли, с другой — моря и соленые озера (в СССР — Баскунчак и др.). Из залежей каменной соли последняя просто выламывается и затем измельчается. Такая соль часто бывает настолько чиста, что не требует дальнейшей очистки. Из морей и соленых озер NaCl добывают упарванием рассолов под действием солнца или вымораживанием воды. Получаемая таким путем соль часто бывает загрязнена примесями (главным образом ионов Са2+, Mg2+ и SO4 2–) и во влажном воздухе отсыревает. Напротив, вполне чистая поваренная соль негигроскопична. Из других галогенидов щелочных металлов громадное значение имеет КCl — основа калийных удобрений. Нитраты щелочных металлов сравнительно легкоплавки и хорошо растворимы в воде (рис. 189). Практическое значение из них имеют почти исключительно NaNO3 и KNO3. Обе соли используются главным образом в качестве минеральных удобрений. Первую из них получают обычно как побочный продукт азотнокислотного производства (за счет поглощения щелочами окислов азота из отходящих газов), а вторую — обменным разложением КСl и NaNО3.
Ввиду двухосновности угольной кислоты она со щелочными металлами образует соли двух типов — кислые (ЭНСО3) и средние (Э2СО3). Кислые карбонаты (бикарбонаты) известны для всех щелочных металлов кроме Li. Из растворов они выделяются без кристаллизационной воды. При нагревании бикарбонаты довольно легко переходят в средние соли угольной кислоты: 2ЭHСО3 = Э2 СО3 + СО2 + Н2О По ряду Na—Cs их термическая устойчивость возрастает. Рассматриваемые бикарбонаты хорошо растворимы. Вследствие гидролиза растворы их показывают очень слабощелочную реакцию. При нагревании этих растворов из них частично выделяется СО2 (в соответствии с приводившимися выше уравнением распада), и реакция становится сильнощелочной. В соприкосновении с воздухом такое выделение СО2 растворами бикарбонатов очень медленно происходит и при обычной температуре. Практическое применение находит главным образом NaHCO3 («питьевая сода»), используемый в медицине, кондитерской промышленности и т. д. Нормальные карбонаты щелочных металлов, за исключением Li2 CO3, хорошо растворимы в воде причем в результате гидролиза растворы их показывают сильнощелочную реакцию. Наибольшее значение имеет сода (Na2CO3). Подобно карбонатам, сульфаты щелочных металлов тоже известны кислые (ЭHSO4) и средние (Э2 SO4). В воде и те и другие хорошо растворимы (рис. 193). Практическое значение имеют главным образом Na2SO4 (в технике часто называемый просто сульфат) и K2SO4, особенно первый из них. Важнейшим их потребителем является стекольная промышленность. Кристаллогидрат Na2SO4 ·10H2 O («мирабилит», или «глауберова соль») применяется в медицине как слабительное. Промышленное получение Na2SO4 и K2SO4 основано либо на их выделении из природных минералов, либо на обработке соответствующих хлоридов серной кислотой. В последнем случае сульфаты являются побочными продуктами производства соляной кис–лоты. Громадные количества мирабилита содержат воды Кара–Богаз–Гола. Из сопоставления свойств щелочных металлов и их соединений видно, что по ряду Li–Cs они в общем изменяются весьма закономерно. Подобно тому как это наблюдалось у В и Be, первый элемент подгруппы–литий занимает несколько особое положение. Малая растворимость его солей с анионами CO3 2–, PO4 3–и F–, а также гидроокиси, сравнительная легкость отщепления от последней воды при нагревании и некоторые другие свойства приближают литий к магнию и кальцию. Однако в основном литий все же является типичным щелочным металлом. Химические методы получения гидроксида натрия. К химическим методам получения гидроксида натрия относятся известковый и ферритный. Химические методы получения гидроксида натрия имеют существенные недостатки: расходуется большое количество энергоносителей, получаемый едкий натр сильно загрязнен примесями. В настоящее время эти методы почти полностью вытеснены электрохимическими методами производства. Известковый метод получения гидроксида натрия заключается во взаимодействии раствора соды с известковым молоком при температуре около 80°С. Этот процесс называется каустификацией; он проходит по реакции: Na2CО3 + Са(ОН)2 = 2NaOH + CaCО3 В результате реакции получается раствор гидроксида натрия и осадок карбоната кальция. Карбонат кальция отделяется от раствора, который упаривается до получения расплавленного продукта, содержащего около 92 % масс. NaOH. Затем NaOH плавят разливают в железные барабаны, где он застывает. Ферритный метод получения гидроксида натрия состоит из двух этапов: 1. Na2CО3 + Fe2О3 = 2NaFeО2 + CО2 2. 2NaFeО2 + xH2О = 2NaOH + Fe2O3*xH2О Реакция 1 представляет собой процесс спекания кальцинированной соды с окисью железа при температуре 1100—1200°С. При этом образуется спек — феррит натрия и выделяется двуокись углерода. Далее спек обрабатывают (выщелачивают) водой по реакции 2; получается раствор гидроксида натрия и осадок Fe2O3*xH2О, который после отделения его от раствора возвращается в процесс. Получаемый раствор щелочи содержит около 400 г/л NaOH. Его упаривают до получения продукта, содержащего около 92 % масс. NaOH, а затем получают твердый продукт в виде гранул или хлопьев. Калийные удобрения. Хлористый калий - КCl Является концентрированным калийным удобрением. Представляет собой белое кристаллическое вещество и легко растворяется в воде. Содержание питательного вещества K2O находится на уровне 52-62%. Основным сырьем для производства хлористого калия являются природные калийные соли (сильвинит и карналлит – соли с содержанием чистого вещества на уровне 12-15% с примесями солей натрия и магния). Хлористый калий применяют на любых почвах как основное удобрение. Особенно эффективно при использовании под корнеплоды, картофель, подсолнечник, плодовые и др. культуры. Калийные удобрения, как правило, применяются в комплексе с азотными и фосфорными удобрениями. Калийная селитра — КNO3 Комплексное калийно-азотное удобрение. Содержит калия 45%, азота 14%. Калимагнезия - K2SO4*MgSO4 Комплексное калийно-магниевое удобрение, без содержания хлора. Применяется под хлорофобные культуры положительно отзывающиеся на магний. Содержание калия 26-32%, магния 11-18%. Помимо увеличения урожайности, калийные удобрения повышают качественные характеристики выращиваемой продукции: это проявляется в повышении сопротивляемости растений к заболеваниям, повышении стойкости плодов при хранении и транспортировке, а также улучшении их вкусовых и эстетических качеств.
|
||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 1972; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.136.95 (0.014 с.) |

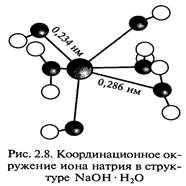 Растворение гидроксидов в воде сопровождается выделением большого количества теплоты из-за высокой энергии гидратации. Все едкие щелочи образуют устойчивые гидраты, некоторые из них выделены в твердом виде (рис. 2.8).
Растворение гидроксидов в воде сопровождается выделением большого количества теплоты из-за высокой энергии гидратации. Все едкие щелочи образуют устойчивые гидраты, некоторые из них выделены в твердом виде (рис. 2.8).



