Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Получение и строение безводных галогенидов алюминия. Гидрид алюминия и гидридоалюминаты щелочных элементов.Содержание книги
Поиск на нашем сайте Для алюминия, галлия, индия и таллия известны галогениды состава МХ3, МХ2 и MX. Наибольшее значение имеют тригалогениды. Трифториды существенно отличаются по своим свойствам от других тригалогенидов: они характеризуются высокими температурами плавления и энтальпиями образования. Трифторид таллия менее устойчив и при плавлении разлагается. Все остальные трифториды MF3 имеют низкое давление пара и в паровой фазе находятся в виде мономерных молекул MF3. Все они малорастворимы в воде за исключением T1F3, который полностью гидролизуется с образованием осадка гидроксидаталлия(Ш). Безводные трифториды состоят из октаэдров MF6, соединенных общими вершинами в бесконечные трехмерные каркасы. Эта структура родственна Re03. Подобно фториду бора они являются кислотами Льюиса, хотя их акцепторные свойства резко убывают вниз по группе. Свойства льюисовой кислоты A1F3 проявляет при образовании комплексных фторидов, например криолита Na3AlF6. Хлориды, бромиды и иодиды в отличие от фторидов имеют либо слоистую либо молекулярную структуру. Твердые АlСl3, 1nСl3, ТlСl3, ТlВг3, ТlI3 построены из октаэдров MX6, соединенных вершинами в трехмерную сетку. Остальные тригалогениды в твердом виде состоят из димерных молекул М2Х6, составленных из двух искаженных тетраэдров МХ4, объединенных общим ребром. Они испаряются также в виде димеров, которые при сильном повышении температуры диссоциируют на мономеры MX3.
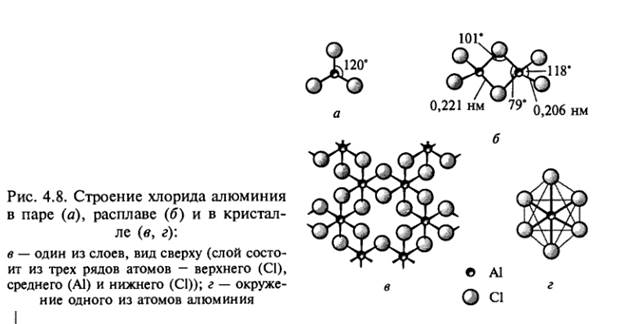
Безводный хлорид алюминия. Среди галогенидов металлов 13-й группы наиболее важен трихлорид алюминия. Безводный АlСl3 представляет собой бесцветные блестящие чешуйки, образующиеся при хлорировании или гидрохлорировании металла, а также при пропускании хлора над смесью корунда с углем: 800 oС Аl203 + ЗСl2 + ЗС = 2AlCl3 + 3CO При нагревании до 180 °С АlСl3 возгоняется. Хлорид алюминия хорошо растворим в этиловом спирте и воде. При охлаждении концентрированного водного раствора может быть выделен кристаллогидрат [Аl(ОН2)6]Сl3. Хлорид А1С13 используется для получения других безводных галогенидов: АlСl3 + 3LiX = А1Х3 + 3LiCl (X = Br, I) а также комплексных амидов и металлоорганических соединений: АlСl3 + 4LiY = LiAlY4 + 3LiCl (Y = NH2, R) Безводный AlCl3 находит применение как катализатор в реакциях Фриделя — Крафтса. Твердый трихлорид алюминия состоит из слоев, образованных октаэдрами АlСl6, соединенными общими ребрами (рис. 4.8, в, г). Координационное число алюминия равно шести. При нагревании и повышенном давлении вещество плавится, превращаясь в подвижную жидкость. Жидкость и пары над ней состоят из молекул Аl2Сl6 (рис. 4.8, б), напоминающих молекулы диборана. Координационное число атома алюминия при этом понижается до 4, удельный объем почти удваивается, электропроводность практически исчезает. Димеры Аl2Сl6 устойчивы в паре до 230 °С, выше этой температуры пар состоит из молекул АlСl3, имеющих форму плоского треугольника (рис. 4.8, а).
Гидрид алюминия. Прочность ковалентных связей М-Н гидридов элементов 13-й группы убывает из-за увеличения их атомных радиусов и уменьшения степени перекрывания атомных орбиталей М и водорода. Свойства гидридов металлов существенно отличаются от гидридов бора. В обычных условиях гидриды Al, Ga, In, Тl — твердые нелетучие вещества, нерастворимые в полярных растворителях. Структура кристаллического гидрида алюминия (АlН3)n построена из октаэдров АlН6, объединенных шестью трехцентровыми двухэлектронными связями Al—Н—Аl в бесконечный каркас. Соединение неустойчиво и выше 150 °С разлагается, активно реагирует с водой с выделением водорода. Гидрид алюминия образуется при взаимодействии избытка алюмогидрида лития LiAlH4 с А1С13 в безводном диэтиловом эфире (Et2O): 3nLi[AlH4] + nА1С13 = 4(А1Н3)n+ 3nLiCl с последующим добавлением бензола и отгонкой растворителя для разрушения промежуточных продуктов — эфиратов переменного состава А1Н3.(Et2O). Важное значение имеют комплексные гидриды М1МН4, где М1 — щелочной металл, М = Al, Ga, In, Тl. Из них наиболее важны борогидрид LiBH4 и алюмогидрид LiAlH4 лития. Тетрагидроалюминат лития (или литийалюмогидрид) LiAlH4 — белое нелетучее вещество, легко разлагающееся в присутствии следов влаги: LiAlH4 + 4Н2O = LiOH + Аl(ОН)3 + 4Н2 что используется для осушения органических растворителей. Его получают перемешиванием суспензии гидрида LiH в эфирном растворе АlСl3: 4LiH + АlСl3 = LiAlH4 + 3LiCl LiAlH4 — ковалентное соединение, построенное из тетраэдрических группировок АlН4, соединенных мостиковыми атомами Li. Это соединение — сильнейший восстановитель, его используют при синтезе гидридов Si, S, Р, С, Ge, Sn и др.: LiAlH4 + SiCl4 =SiH4 + А1С13 + LiCl С помощью алюмогидрида алкены восстанавливают в алканы, кетоны R2CO — в спирты R2CHOH, нитросоединения RNO2 — в амины RNH2 и т.д. Термическая устойчивость гидридов ослабевает в ряду В—Al — Ga— In — Tl, а склонность к гидролизу усиливается для простых ЭН3 и комплексных гидридов. Например, температура разложения в указанном ряду понижается: LiBH4 (380 °С) > LiAlH4(100 °С) > LiGaH4(5°C) > LiInH4(0°C) = LiTlH4(0°C)
|
||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 1337; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.01 с.) |