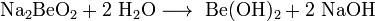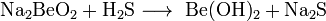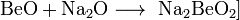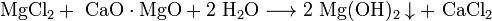Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Бериллий. Получение и свойства металлического бериллия, применение в технике бериллия и его сплавов. Гидроксид бериллия, его амфотерность. Соли бериллия и бериллаты, их гидролиз.Содержание книги
Поиск на нашем сайте
Бериллий — элемент главной подгруппы второй группы, второго периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 4. Бериллий — относительно твердый, но хрупкий металл серебристо-белого цвета. Имеет высокий модуль упругости — 300 ГПа (у сталей — 200—210 ГПа). На воздухе активно покрывается стойкой оксидной плёнкой BeO. В виде простого вещества в XIX веке бериллий получали действием калия на безводный хлорид бериллия:
В настоящее время бериллий получают, восстанавливая его фторид магнием:
Либо электролизом расплава смеси хлоридов бериллия и натрия. Исходные соли бериллия выделяют при переработке бериллиевой руды. Для бериллия характерна только одна степень окисления +2. Соответствующий гидроксид амфотерен, причем как основные (с образованием Be2+), так и кислотные (с образованием [Be(OH)4]2-] свойства выражены слабо. По многим химическим свойствам бериллий больше похож на алюминий, чем на находящийся непосредственно под ним магний (проявление "диагонального сходства"). Металлический бериллий относительно мало реакционноспособен при комнатной температуре. В компактном виде он не реагирует с водой и водяным паром даже при температуре красного каления и не окисляется воздухом до 600 °C. Порошок бериллия при поджигании горит ярким пламенем, при этом образуются оксид и нитрид. Галогены реагируют с бериллием при температуре выше 600 °C, а халькогены требуют еще более высокой температуры. Аммиак взаимодействует с бериллием при температуре выше 1200 °C с образованием нитрида Be3N2, а углерод дает карбид Ве2С при 1700 °C. С водородом бериллий непосредственно не реагирует. Бериллий легко растворяется в разбавленных водных растворах кислот (соляной, серной, азотной), однако холодная концентрированная азотная кислота пассивирует металл. Реакция бериллия с водными растворами щелочей сопровождается выделением водорода и образованием гидроксобериллатов: Be + 2NaOH(р) + 2H2O = Na2[Be(OH)4] + H2 При проведении реакции с расплавом щелочи при 400—500 °C образуются диоксобериллаты: Be + 2NaOH(ж) = Na2BeO2 + H2 Три «но» бериллия. Это прежде всего хрупкость металла. Она намного усложняет процесс его механической обработки, затрудняет получение больших листов бериллия и сложных профилей, необходимых в тех или иных конструкциях. Предпринимаются упорные попытки устранить этот недостаток. Но, несмотря на некоторые успехи (изготовление металла высокой чистоты, различные технологические усовершенствования), получение пластичного бериллия продолжает оставаться трудной проблемой. Второе — токсичность бериллия. Тщательный контроль за чистотой воздуха, особые системы вентиляции, возможно большая автоматизация производства — все это позволяет успешно бороться с токсичностью элемента № 4 и его соединений. И наконец, третье и очень важное «но» бериллия — его высокая стоимость. Цена 1 кг бериллия в США сейчас более 300 долларов, т. е. бериллий в несколько раз дороже титана. Однако рост потребления всегда приводит к технологическим усовершенствованиям, которые в свою очередь способствуют уменьшению издержек производства и цены. В будущем спрос на бериллий возрастет еще больше: ведь этот металл человечество начало применять всего несколько десятилетий. И, конечно, достоинства элемента № 4 возьмут верх над его недостатками. Основной минерал бериллия — берилл относится, как известно, к полудрагоценным камням. Но когда говорят о четырех его разновидностях — изумруде, аквамарине, воробьевите и гелиодоре, то приставку «полу» отбрасывают. Изумруды, особенно весом больше 5 каратов, ценятся не меньше бриллиантов. Получить изумруды искусственным путем гораздо труднее, чем большинство других драгоценных камней. Главная причина в том, что берилл — сложное комплексное соединение. Однако ученые смогли имитировать природные условия, в которых происходило образование минерала: изумруды «рождаются» при очень высоком давлении (150 тыс. атм) и высокой температуре (1550° С). Искусственные изумруды могут использоваться в электронике. Сферы применения бериллия не ограничиваются «высокой» техникой. С изделиями из никель-бериллиевых сплавов (содержание Be не превышает 1,5%) можно встретиться и в повседневной жизни. Из этих сплавов изготавливают хирургические инструменты, иглы для подкожных инъекций, литые металлические зубы. Из сплава «элинвар» (никель, бериллий, вольфрам) в Швейцарии делают пружины для часов. Медно-бериллиевый сплав в США используют для изготовления втулок пишущего механизма шариковых ручек. Сейчас известно более тысячи материалов, приобретающих при температуре, близкой к абсолютному нулю, свойство сверхпроводимости. В их числе — металлический бериллий. Будучи сконденсирован в виде тонкой пленки на холодную подложку, бериллий становится сверхпроводником при температуре около 8 К. Гидроксид бериллия Be(OH)2— полимерное соединение, нерастворимое в воде. Оно проявляет амфотерные свойства: Be(OH)2 + 2КOH =К2[Be(OH)4], Be(OH)2 + 2HСl = BeСl2 + 2H2O. Соединения бериллия. 1. Сульфат бериллия Формула:BeSO4-4H2O Получается как промежуточный продукт при обработке рудного концентрата H2SO4; нагреванием. ВеО с конц. H2SO4. Представляет собой бесцветные кристаллы. При 400° обезвоживается, при 550-600 разлагается, не доходя до плавления. Водный раствор имеет кислую реакцию. 2. Фторид бериллия Формула:BeF2 Применяется для получения металлического Be. Получается термическим разложением (NH4)2BeF4. Представляет собой бесцветные гигроскопические кристаллы. Хорошо растворим в воде. Взаимодействует с фторидами щелочных металлов. 3. Бериллаты. Бериллаты — химические соединения, представляющие собой соли амфотерного гидроксида бериллия Be(OH)2, который диссоциирует преимущественно с отщеплением протона:
Бериллаты представляет бесцветные или белые кристаллические вещества, устойчивые на воздухе только в отсутствие следов влаги. В присутствие влаги или при растворении воде бериллаты легко гидролизируют, с образованием гидроксида бериллия и соответствующей щелочи:
При растворении бериллатов в разбавленных щелочных растворах образуется более устойчивые комплексные соединения — гидроксобериллаты:
Бериллаты легко реагируют с кислотами различной силы и концентрации, с образованием гидроксида бериллия или соответствующей соли бериллия:
Так же в присутствие влаги бериллаты легко реагируют с диоксидами углерода и серы, различными оксидами азота и т.п.
Бериллаты образуются в различных условиях. Наиболее распространен способ высокотемпературного синтеза при взаимодействии оксида или гидроксида бериллия с оксидами, гидроксидами или карбонатами щелочных металлов:
При растворении бериллия, а также его оксида или гидроксида в концентрированных растворах щелочей образуются гидроксобериллаты:
На использовании бериллатов щелочных металлов основан один из методов разделения бериллия и алюминия.
Магний. Получение магния из минерального сырья. Физические и химические свойства металлического магния. Оксид и гидроксид магния. Карбонаты магния. Гидролиз растворимых солей магния. Применение магния в форме металла и в виде сложных соединений. Магний — элемент главной подгруппы второй группы, третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 12. Магний — серебристо-белый очень легкий металл, почти в 5 раз легче меди, в 4,5 раза легче железа; даже алюминий в 1,5 раза тяжелее магния. Плавится магнпй при 651° С, но в обычных условиях расплавить его довольно трудно: нагретый на воздухе до 550° С, он вспыхивает и мгновенно сгорает ослепительно ярким пламенем. Полоску магниевой фольги легко поджечь обыкновенной спичкой, а в атмосфере хлора магний самовозгорается даже при комнатной температуре. При горении магния (внимание, любители загара!) выделяется большое количество ультрафиолетовых лучей и тепла — чтобы нагреть стакан ледяной воды до кипения, нужно сжечь всего 4 г магния. На воздухе магний быстро тускнеет, так как покрывается окисной пленкой. Эта пленка служит надежным панцирем, предохраняющим металл от дальнейшего окисления. Химические свойства магния довольно своеобразны. Он легко отнимает кислород и хлор у большинства элементов, не боится едких щелочей, соды, керосина, бензина и минеральных масел. В то же время он совершенно не выносит действия морской и минеральной воды и довольно быстро растворяется в них. Почти не реагируя с холодной пресной водой, он энергично вытесняет водород из воды горячей. Mg (раск.) + Н2О = MgO + H2↑ Mg + 2HCl = MgCl2 + H2 2Mg + О2 = 2MgO; 3Mg + N2 = Mg3N2 Земная кора богата магнием — в ней содержится более 2,1% этого элемента. Лишь шесть элементов периодической системы встречаются на Земле чаще магния. Он входит в состав почти двухсот минералов. Но получают его в основном из трех — магнезита, доломита и карналлита. В нашей стране богатые месторожения магнезита расположены на Среднем Урале (Саткинское) и в Оренбургской области (Халиловское). А в районе города Соликамска разрабатывается крупнейшее в мире месторождение карналлита. Доломит — самый распространенный из магнийсодержащих минералов — встречается в Донбассе, Московской и Ленинградской областях и многих других местах. Получают металлический магний двумя способами — электротермическим (нли металлотермическим) и электролитическим. Как явствует из названий, в обоих процессах участвует электричество. Но в первом случае его роль сводится к обогреву реакционных аппаратов, а восстанавливают окись магния, полученную из минералов, каким-либо восстановителем, например углем, кремнием, алюминием. Этот способ довольно перспективен, в последнее время он находит все большее применение. Однако основной промышленный способ получения магния — второй, электролитический. Электролитом служит расплав безводных хлоридов магния, калия и натрия; металлический магний выделяется на железном катоде, а на графитовом аноде разряжаются ионы хлора. Процесс идет в специальных ваннах электро- лизерах. Расплавленный магний всплывает на поверхность ванны, откуда его время от времени выбирают вакуум-ковшом и затем разливают по формам. Но на этом процесс не заканчивается: в таком магнии еще слишком много примесей. Поэтому неизбежен второй этап — очистка магния. Рафинировать магний можно двумя путями — переплавкой и флюсами или возгонкой в вакууме. Смысл первого метода общеизвестен: специальные добавки — флюсы — взаимодействуют с примесями и превращают их в соединения, которые легко отделить от металла механическим путем. Второй метод — вакуумная возгонка — требует более сложной аппаратуры, но с его помощью получают более чистый магний. Возгонку ведут в специальных вакуум-аппаратах—стальных цилиндрических ретортах. «Черновой» металл помещают на дно реторты, закрывают ее и выкачивают воздух. Затем нижнюю часть реторты нагревают, а верхняя все время охлаждается наружным воздухом. Под действием высокой температуры магний возгоняется — переходит в газообразное состояние, минуя жидкое. Пары его поднимаются и конденсируются на холодных стенках верхней части реторты. Таким путем можно получать очень чистый металл, содержащий свыше 99,99% магния. Но не только земная кора богата магнием — практически неисчерпаемые и постоянно пополняющиеся запасы его хранят голубые кладовые океанов и морей. В каждом кубометре морской воды содержится около 4 кг магния. Всего же в водах мирового океана растворено более 6.1016 т этого элемента. Как добывают магний из моря? Морскую воду смешивают в огромных баках с известковым молоком, приготовленным из перемолотых морских раковин. При этом образуется так называемое магнезиальное молоко, которое высушивается и превращается в хлорид магния. Ну, а дальше в ход идут электролитические процессы. Услугами магния широко пользуется медицина: всем хорошо знакома «английская соль» MgSО4.7H2О. При приеме внутрь она служит надежным и быстродействующим слабительным, а при внутримышечных или внутривенных вливаниях снимает судорожное состояние, уменьшает спазмы сосудов. Чистая окись магния (жженая магнезия) применяется при повышенной кислотности желудочного сока, изжоге, отравлении кислотами. Перекись магния служит дезинфицирующим средством при желудочных расстройствах. Но медициной не ограничиваются области применения соединений магния. Так, окись магния используют в производстве цементов, огнеупорного кирпича, в резиновой, промышленности. Перекись магния («новозон») применяют для отбелки тканей. Сернокислый магний используют в текстильной и бумажной промышленности как протраву при крашении, водный раствор хлорида магния — для приготовления магнезиального цемента, ксилолита и других синтетических материалов. Карбонат магния MgCО3 находит применение в производстве теплоизоляционных материалов. И, наконец, еще одно обширное поле деятельности магния — органическая химия. Магниевый порошок используют для обезвоживания таких важных органических веществ, как спирт п анилин. Магнийорганические соединения широко применяют при синтезе многих органических веществ. И еще в одной грандиозной работе — аккумуляции солнечной энергии — участвует магний. Он входит в состав хлорофилла, который поглощает солнечную энергию и с ее помощью превращает углекислый газ и воду в сложные органические вещества (сахар, крахмал и др.), необходимые для питания человека и животных. Без хлорофилла не было бы жизни, а без магния не было бы хлорофилла — в нем содержится 2% этого элемента. Много ли это? Судите сами: общее количество магния в хлорофилле всех растений Земли составляет около 100 млрд. т! Элемент № 12 входит и в состав практически всех живых организмов. Итак, деятельность магния в природе и народном хозяйстве весьма многогранна. Окись магния (Жженая магнезия) Формула: MgO Применяется в составе магнезиальных цементов; для изготовления огнеупоров; в качестве наполнителя в резиновой промышленности. Получается тяжелая магнезия для цементов и строительных материалов обжигом магнезита при 700°, для огнеупоров - при 1500-1800°. Легкую магнезию получают прокаливанием карбоната или основного карбоната магния. Представляет собой белый порошок. Легкая магнезия растворяется в кислотах, с водой дает Mg(OH)2. Тяжелая магнезия кислотостойка, в воде практически нерастворима. Технический продукт содержит примеси СаО, Аl2O3, SiO2 и др. Гидроксид магния — неорганический гидроксид щелочноземельного металла магния. Относится к классу нерастворимых оснований. При стандартных условиях гидроксид магния представляет собой бесцветные кристаллы с гексагональной решёткой. При температуре выше 350 °C разлагается на оксид магния и воду. Поглощает углекислый газ и воду из воздуха с образованием основного карбоната магния. Гидроксид магния практически нерастворим в воде. Является сильным основанием. Встречается в природе в виде минерала брусита. Получение: Взаимодействие растворимых солей магния с щелочами:
Взаимодействие раствора хлорида магния с обожжённым доломитом:
Взаимодействие металлического магния с парами воды:
Химические свойства: Разложение при нагревании до 350 °C:
Взаимодействие с кислотами с образованием соли и воды (реакция нейтрализации):
Взаимодействие с кислотными оксидами с образованием соли и воды:
Гидроксид магния используется в качестве пищевой добавки, для связывания диоксида серы, как флокулянт для очистки сточных вод, в качестве огнезащитного средства в термопластических полимерах (полиолефины, ПВХ), как добавка в моющие средства, для получения оксида магния, рафинирования сахара, в качестве компонента зубных паст. В медицине его применяют в качестве лекарства для нейтрализации кислоты в желудке, а также как очень сильное слабительное. Карбонат магния, магний углекислый, MgCO3 — магниевая соль угольной кислоты. Бесцветные кристаллы, плотность 3,037 г/см³. При 500 °C заметно, а при 650 °C полностью разлагается на MgO и CO2. Растворимость карбоната магния в воде незначительна (22 мг/л при 25 °C) и уменьшается с повышением температуры. При насыщении CO2 водной суспензии MgCO3 последний растворяется вследствие образования гидрокарбоната Мg(HCO3)2. Из водных растворов в отсутствие избытка CO2 выделяются основные карбонаты магния. С карбонатами ряда металлов карбонат магния образует двойные соли, к которым относится и природный минерал доломит MgCO3·CaCO3. Карбонат магния широко распространён в природе в виде минерала магнезита. Основной карбонат магния 3MgCO3·Mg(OH)2·3H2O (так называемая белая магнезия) применяют как наполнитель в резиновых смесях, для изготовления теплоизоляционных материалов. В медицине и в качестве пищевой добавки E504 используется основной карбонат магния 4MgCO3·Mg(OH)2·nH2O Спортивная магнезия 4MgCO3·Mg(OH)2·4H2O используется для подсушивания рук и, как следствие, увеличения надежности хвата. Карбонат магния необходим в производстве стекла, цемента, кирпича.
|
||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 2288; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.10.104 (0.008 с.) |