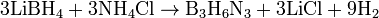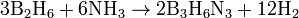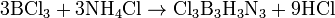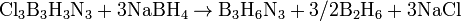Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Соединения щелочных элементов с неметаллами – получение, свойства гидридов, галогенидов, сульфидов, нитридов, карбидов, силицидов.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Общая характеристика щелочных элементов. Нахождение в природе. Получение щелочных элементов в металлическом состоянии из природного сырья. Изменение химической активности щелочных элементов в металлическом состоянии по ряду литий – цезий (отношение к воде, кислороду, азоту). Щелочные металлы — это элементы 1-й группы периодической таблицы химических элементов (по устаревшей классификации — элементы главной подгруппы I группы): литий Li, натрий Na, калий K, рубидий Rb, цезий Cs, франций Fr, и унуненний Uue. При растворении щелочных металлов в воде образуются растворимые гидроксиды, называемые щёлочами. В Периодической системе они следуют сразу за инертными газами, поэтому особенность строения атомов щелочных металлов заключается в том, что они содержат один электрон на внешнем энергетическом уровне: их электронная конфигурация ns1. Очевидно, что валентные электроны щелочных металлов могут быть легко удалены, потому что атому энергетически выгодно отдать электрон и приобрести конфигурацию инертного газа. Поэтому для всех щелочных металлов характерны восстановительные свойства. Это подтверждают низкие значения их потенциалов ионизации (потенциал ионизации атома цезия — один из самых низких) и электроотрицательности (ЭО).
Все металлы этой подгруппы имеют серебристо-белый цвет (кроме серебристо-жёлтого цезия), они очень мягкие, их можно резать скальпелем. Литий, натрий и калий легче воды и плавают на её поверхности, реагируя с ней. Щелочные металлы встречаются в природе в форме соединений, содержащих однозарядные катионы. Многие минералы содержат в своём составе металлы главной подгруппы I группы. Например, ортоклаз, или полевой шпат, состоит из алюмосиликата калия K2[Al2Si6O16], аналогичный минерал, содержащий натрий — альбит — имеет состав Na2[Al2Si6O16]. В морской воде содержится хлорид натрия NaCl, а в почве — соли калия — сильвин KCl, сильвинит NaCl • KCl, карналлит KCl • MgCl2 • 6H2O, полигалит K2SO4 • MgSO4 • CaSO4 • 2H2O. Натрий и калий относятся к наиболее распространенным в природе элементам: их содержание в земной коре составляет 2,0 и 1,1 % атомных процентов. Остальные щелочные металлы встречаются реже. Скопления минералов, содержащий литий, редки. Рубидий и цезий встречаются в виде примесей к калию, а следы франция находят в урановых рудах. Натрий и калий относятся к жизненно важным элементам. Натрий сосредоточен в основном в крови и лимфе (в крови 0,6 % NaCl), калий необходим для работы сердца, печени, селезёнки. Интересно, что соотношения этих элементов в зародышах теплокровных приближается к содержанию в морской воде. Калий необходим для жизни растений (90 % добываемого калия используется для производства химических удобрений). Рубидий накапливается у животных в мышцах, несущих большую нагрузку (сердце, грудина у животных). Соединения лития и цезия токсичны. Из-за высокой химической активности щелочных металлов по отношению к воде, кислороду, и иногда даже и азоту (Li, Cs) их хранят под слоем керосина. Чтобы провести реакцию со щелочным металлом, кусочек нужного размера аккуратно отрезают скальпелем под слоем керосина, в атмосфере аргона тщательно очищают поверхность металла от продуктов его взаимодействия с воздухом и только потом помещают образец в реакционный сосуд. 1. Взаимодействие с водой. Важное свойство щелочных металлов — их высокая активность по отношению к воде. Наиболее спокойно (без взрыва) реагирует с водой литий:
При проведении аналогичной реакции натрий горит жёлтым пламенем и происходит небольшой взрыв. Калий ещё более активен: в этом случае взрыв гораздо сильнее, а пламя окрашено в фиолетовый цвет. 2. Взаимодействие с кислородом. Продукты горения щелочных металлов на воздухе имеют разный состав в зависимости от активности металла. Только литий сгорает на воздухе с образованием оксида стехиометрического состава:
При горении натрия в основном образуется пероксид Na2O2 с небольшой примесью надпероксида NaO2:
В продуктах горения калия, рубидия и цезия содержатся в основном надпероксиды:
3. С азотом и углеродом непосредственно соединяется только литий. Образование его нитрида (Li3N) медленно идет в атмосфере азота уже при обычных температурах. Таким образом, литий и его аналоги являются исключительно реакционноспособными металлами (причем активность их по направлению от Li к Cs обычно возрастает). Во всех своих соединениях щелочные металлы одновалентны. Получение: 1. Для получения щелочных металлов используют в основном электролиз расплавов их галогенидов, чаще всего — хлоридов, образующих природные минералы:
катод: Li+ + e → Li анод: 2Cl− — 2e → Cl2 2. Иногда для получения щелочных металлов проводят электролиз расплавов их гидроксидов:
катод: Na+ + e → Na анод: 4OH− — 4e → 2H2O + O2 3. Щелочной металл может быть восстановлен из соответствующего хлорида или бромида кальцием, магнием, кремнием и др. восстановителями при нагревании под вакуумом до 600-900 °C:
Чтобы реакция пошла в нужную сторону, образующийся свободный щелочной металл (M) должен удаляться путём отгонки. Аналогично возможно восстановление цирконием из хромата. Известен способ получения натрия восстановлением из карбоната углём при 1000 °C в присутствии известняка. Поскольку щелочные металлы в электрохимическом ряду напряжений находятся левее водорода, то электролитическое получение их из растворов солей невозможно; в этом случае образуются соответствующие щёлочи и водород. Магний. Получение магния из минерального сырья. Физические и химические свойства металлического магния. Оксид и гидроксид магния. Карбонаты магния. Гидролиз растворимых солей магния. Применение магния в форме металла и в виде сложных соединений. Магний — элемент главной подгруппы второй группы, третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 12. Магний — серебристо-белый очень легкий металл, почти в 5 раз легче меди, в 4,5 раза легче железа; даже алюминий в 1,5 раза тяжелее магния. Плавится магнпй при 651° С, но в обычных условиях расплавить его довольно трудно: нагретый на воздухе до 550° С, он вспыхивает и мгновенно сгорает ослепительно ярким пламенем. Полоску магниевой фольги легко поджечь обыкновенной спичкой, а в атмосфере хлора магний самовозгорается даже при комнатной температуре. При горении магния (внимание, любители загара!) выделяется большое количество ультрафиолетовых лучей и тепла — чтобы нагреть стакан ледяной воды до кипения, нужно сжечь всего 4 г магния. На воздухе магний быстро тускнеет, так как покрывается окисной пленкой. Эта пленка служит надежным панцирем, предохраняющим металл от дальнейшего окисления. Химические свойства магния довольно своеобразны. Он легко отнимает кислород и хлор у большинства элементов, не боится едких щелочей, соды, керосина, бензина и минеральных масел. В то же время он совершенно не выносит действия морской и минеральной воды и довольно быстро растворяется в них. Почти не реагируя с холодной пресной водой, он энергично вытесняет водород из воды горячей. Mg (раск.) + Н2О = MgO + H2↑ Mg + 2HCl = MgCl2 + H2 2Mg + О2 = 2MgO; 3Mg + N2 = Mg3N2 Земная кора богата магнием — в ней содержится более 2,1% этого элемента. Лишь шесть элементов периодической системы встречаются на Земле чаще магния. Он входит в состав почти двухсот минералов. Но получают его в основном из трех — магнезита, доломита и карналлита. В нашей стране богатые месторожения магнезита расположены на Среднем Урале (Саткинское) и в Оренбургской области (Халиловское). А в районе города Соликамска разрабатывается крупнейшее в мире месторождение карналлита. Доломит — самый распространенный из магнийсодержащих минералов — встречается в Донбассе, Московской и Ленинградской областях и многих других местах. Получают металлический магний двумя способами — электротермическим (нли металлотермическим) и электролитическим. Как явствует из названий, в обоих процессах участвует электричество. Но в первом случае его роль сводится к обогреву реакционных аппаратов, а восстанавливают окись магния, полученную из минералов, каким-либо восстановителем, например углем, кремнием, алюминием. Этот способ довольно перспективен, в последнее время он находит все большее применение. Однако основной промышленный способ получения магния — второй, электролитический. Электролитом служит расплав безводных хлоридов магния, калия и натрия; металлический магний выделяется на железном катоде, а на графитовом аноде разряжаются ионы хлора. Процесс идет в специальных ваннах электро- лизерах. Расплавленный магний всплывает на поверхность ванны, откуда его время от времени выбирают вакуум-ковшом и затем разливают по формам. Но на этом процесс не заканчивается: в таком магнии еще слишком много примесей. Поэтому неизбежен второй этап — очистка магния. Рафинировать магний можно двумя путями — переплавкой и флюсами или возгонкой в вакууме. Смысл первого метода общеизвестен: специальные добавки — флюсы — взаимодействуют с примесями и превращают их в соединения, которые легко отделить от металла механическим путем. Второй метод — вакуумная возгонка — требует более сложной аппаратуры, но с его помощью получают более чистый магний. Возгонку ведут в специальных вакуум-аппаратах—стальных цилиндрических ретортах. «Черновой» металл помещают на дно реторты, закрывают ее и выкачивают воздух. Затем нижнюю часть реторты нагревают, а верхняя все время охлаждается наружным воздухом. Под действием высокой температуры магний возгоняется — переходит в газообразное состояние, минуя жидкое. Пары его поднимаются и конденсируются на холодных стенках верхней части реторты. Таким путем можно получать очень чистый металл, содержащий свыше 99,99% магния. Но не только земная кора богата магнием — практически неисчерпаемые и постоянно пополняющиеся запасы его хранят голубые кладовые океанов и морей. В каждом кубометре морской воды содержится около 4 кг магния. Всего же в водах мирового океана растворено более 6.1016 т этого элемента. Как добывают магний из моря? Морскую воду смешивают в огромных баках с известковым молоком, приготовленным из перемолотых морских раковин. При этом образуется так называемое магнезиальное молоко, которое высушивается и превращается в хлорид магния. Ну, а дальше в ход идут электролитические процессы. Услугами магния широко пользуется медицина: всем хорошо знакома «английская соль» MgSО4.7H2О. При приеме внутрь она служит надежным и быстродействующим слабительным, а при внутримышечных или внутривенных вливаниях снимает судорожное состояние, уменьшает спазмы сосудов. Чистая окись магния (жженая магнезия) применяется при повышенной кислотности желудочного сока, изжоге, отравлении кислотами. Перекись магния служит дезинфицирующим средством при желудочных расстройствах. Но медициной не ограничиваются области применения соединений магния. Так, окись магния используют в производстве цементов, огнеупорного кирпича, в резиновой, промышленности. Перекись магния («новозон») применяют для отбелки тканей. Сернокислый магний используют в текстильной и бумажной промышленности как протраву при крашении, водный раствор хлорида магния — для приготовления магнезиального цемента, ксилолита и других синтетических материалов. Карбонат магния MgCО3 находит применение в производстве теплоизоляционных материалов. И, наконец, еще одно обширное поле деятельности магния — органическая химия. Магниевый порошок используют для обезвоживания таких важных органических веществ, как спирт п анилин. Магнийорганические соединения широко применяют при синтезе многих органических веществ. И еще в одной грандиозной работе — аккумуляции солнечной энергии — участвует магний. Он входит в состав хлорофилла, который поглощает солнечную энергию и с ее помощью превращает углекислый газ и воду в сложные органические вещества (сахар, крахмал и др.), необходимые для питания человека и животных. Без хлорофилла не было бы жизни, а без магния не было бы хлорофилла — в нем содержится 2% этого элемента. Много ли это? Судите сами: общее количество магния в хлорофилле всех растений Земли составляет около 100 млрд. т! Элемент № 12 входит и в состав практически всех живых организмов. Итак, деятельность магния в природе и народном хозяйстве весьма многогранна. Окись магния (Жженая магнезия) Формула: MgO Применяется в составе магнезиальных цементов; для изготовления огнеупоров; в качестве наполнителя в резиновой промышленности. Получается тяжелая магнезия для цементов и строительных материалов обжигом магнезита при 700°, для огнеупоров - при 1500-1800°. Легкую магнезию получают прокаливанием карбоната или основного карбоната магния. Представляет собой белый порошок. Легкая магнезия растворяется в кислотах, с водой дает Mg(OH)2. Тяжелая магнезия кислотостойка, в воде практически нерастворима. Технический продукт содержит примеси СаО, Аl2O3, SiO2 и др. Гидроксид магния — неорганический гидроксид щелочноземельного металла магния. Относится к классу нерастворимых оснований. При стандартных условиях гидроксид магния представляет собой бесцветные кристаллы с гексагональной решёткой. При температуре выше 350 °C разлагается на оксид магния и воду. Поглощает углекислый газ и воду из воздуха с образованием основного карбоната магния. Гидроксид магния практически нерастворим в воде. Является сильным основанием. Встречается в природе в виде минерала брусита. Получение: Взаимодействие растворимых солей магния с щелочами:
Взаимодействие раствора хлорида магния с обожжённым доломитом:
Взаимодействие металлического магния с парами воды:
Химические свойства: Разложение при нагревании до 350 °C:
Взаимодействие с кислотами с образованием соли и воды (реакция нейтрализации):
Взаимодействие с кислотными оксидами с образованием соли и воды:
Гидроксид магния используется в качестве пищевой добавки, для связывания диоксида серы, как флокулянт для очистки сточных вод, в качестве огнезащитного средства в термопластических полимерах (полиолефины, ПВХ), как добавка в моющие средства, для получения оксида магния, рафинирования сахара, в качестве компонента зубных паст. В медицине его применяют в качестве лекарства для нейтрализации кислоты в желудке, а также как очень сильное слабительное. Карбонат магния, магний углекислый, MgCO3 — магниевая соль угольной кислоты. Бесцветные кристаллы, плотность 3,037 г/см³. При 500 °C заметно, а при 650 °C полностью разлагается на MgO и CO2. Растворимость карбоната магния в воде незначительна (22 мг/л при 25 °C) и уменьшается с повышением температуры. При насыщении CO2 водной суспензии MgCO3 последний растворяется вследствие образования гидрокарбоната Мg(HCO3)2. Из водных растворов в отсутствие избытка CO2 выделяются основные карбонаты магния. С карбонатами ряда металлов карбонат магния образует двойные соли, к которым относится и природный минерал доломит MgCO3·CaCO3. Карбонат магния широко распространён в природе в виде минерала магнезита. Основной карбонат магния 3MgCO3·Mg(OH)2·3H2O (так называемая белая магнезия) применяют как наполнитель в резиновых смесях, для изготовления теплоизоляционных материалов. В медицине и в качестве пищевой добавки E504 используется основной карбонат магния 4MgCO3·Mg(OH)2·nH2O Спортивная магнезия 4MgCO3·Mg(OH)2·4H2O используется для подсушивания рук и, как следствие, увеличения надежности хвата. Карбонат магния необходим в производстве стекла, цемента, кирпича.
Щелочноземельные элементы: растворимые (галогениды, нитраты, ацетаты) и нерастворимые (сульфаты, карбонаты, оксалаты) соли. Изменение термической устойчивости карбонатов, сульфатов, нитратов в ряду кальций – барий. При взаимодействии с кислотами окислы и гидроокиси щелочноземельных металлов легко образуют соответствующие соли. Последние, как правило, бесцветны. Из производных обычных минеральных кислот соли с анионами Cl–, Br–, J– и NO3- – хорошо растворимы; напротив, с анионами F–, SO42–, CO32–и PO43–малорастворимы в воде. В противоположность ионам Са2+ и Sr2+ ион Ba2+ сильно ядовит. Многие соли рассматриваемых элементов находят разнообразное практическое использование. Галогениды щелочноземельных металлов по своим свойствам делятся на две довольно резко обособленные группы. К одной относятся фториды, к другой – производные остальных галоидов, Фториды почти нерастворимы не только в воде, но и в разбавленных кислотах. Кристаллогидраты для них неизвестны. Хлориды, бромиды и иодиды хорошо растворимы в воде и из растворов выделяются в виде кристаллогидратов. Азотнокислый барий кристаллизуется при обычных условиях без воды. Напротив, нитраты Са и Sr выделяются в виде кристаллогидратов. Последние легко растворимы в воде, тогда как растворимость Ва(NO3)3 и Ra(NO3)2 значительно меньше. Нитрат кальция широко применяется в качестве азотсодержащего минерального удобрения. Нитраты стронция и бария служат в пиротехнике для изготовления составов, сгорающих красным (Sr)j или зеленым (Ва) пламенем. Безводные нитраты бериллия и некоторых других металлов невозможно получить дегидратацией кристаллогидратов вследствие необратимого гидролиза. Обычно их получают из безводных хлоридов взаимодействием с диоксидом азота, образующуюся соль нитрозония разлагают в вакууме при слабом нагревании: ВеС12 + 4N204 = [N0]2[Be(N03)4] + 2NOC1 [NО]2[Be(NО3)4] = Be(NО3)2 + 4NО2 Сернокислые соли Sr и Ва кристаллизуются без воды выше 66°С в безводном состоянии выделяется из раствора и сульфат кальция, ниже указанной температуры осаждается гипс – CaSO4 ·2H2O. В воде рассматриваемые сульфаты труднорастворимы, причем по ряду Са–Ra растворимость быстро уменьшается, а их термическая устойчивость возрастает. Нагревание до 150°С обусловливает переход гипса в более бедный водой гидрат 2CaSO4 ·H2 O. При замешивании теста из порошка этого гидрата с водой (60–80% от его веса) происходит обратное присоединение последней, сопровождающееся отвердеванием всей массы вследствие ее закристаллизовывания. На этом основано применение гипса для изготовления слепков с различных предметов, а также в качестве вяжущего строительного материала. Углекислые соли щелочноземельных металлов практически нерастворимы в воде. При накаливании они отщепляют СО2 и переходят в соответствующие окиси. По ряду Са–Sr––Ва термическая устойчивость карбонатов быстро возрастает, что объясняется увеличением в этом ряду энергии кристаллической решетки. Наиболее практически важным из них является карбонат кальция. Применение отдельных природных разновидностей СаСО3 весьма различно. Известняк служит исходным сырьем для получения важнейших строительных материалов – извести и цемента. Мел используется в качестве минеральной краски, как основа составов для полировки и т. д. Мрамор является прекрасным материалом для скульптурных работ, изготовления электрических распределительных щитов и т. д. Наряду с рассмотренными выше солями для химии Са, Sr и Ва весьма важны их известные только в растворе кислые карбонаты Э(НСО3)2. Они образуются при взаимодействии растворенного в воде углекислого газа с нормальными карбонатами по схеме: ЭСО3 + СО2 + Н2 О = Э(НСО3)2 Реакция эта обратима, причем нагревание смещает ее равновесие в сторону распада бикарбоната. Довольно часто из бикарбонатов щелочноземельных металлов в природных водах содержится только Са(НСО3)2. Наличие его придает воде приятный освежающий вкус (который отсутствует у дистиллированной воды). Средний ацетат бериллия получают растворением бериллия в ледяной уксусной кислоте или нагреванием оксоацетата с ацетилхлоридом в ледяной уксусной кислоте. При переходе от бериллия к магнию склонность к гидролизу уменьшается, а соли кальция, стронция и бария с сильными кислотами вообще не гидролизуются.
Бор. Причина преобладания у бора неметаллических свойств. Получение бора, его физические и химические свойства. Соединения бора с металлами и неметаллами. Карбид бора; нитрид бора гексагональный и кубический (боразон). Галогениды бора. Неорганические полимеры на основе соединений бора. Тетрафтороборная кислота, ее соли. Боразол – аналог бензола. Бор — элемент главной подгруппы третьей группы, второго периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 5. Бор — тугоплавкий диамагнитный порошок черного (кристаллический) или бурого (аморфный) цвета, плохой проводник тепла и электричества. Известно более 10 аллотропных модификаций бора. Впервые получен в 1808 году французскими физиками Ж. Гей-Люссаком и Л. Тенаром нагреванием борного ангидрида B2O3 с металлическим калием. Через несколько месяцев бор получил Х. Дэви электролизом расплавленного B2O3. Чрезвычайно твёрдое вещество (уступает только алмазу, нитриду углерода, нитриду бора (боразону), карбиду бора, сплаву бор-углерод-кремний, карбиду скандия-титана). В природе бор находится в виде двух изотопов 10В (20 %) и 11В (80 %). 10В имеет очень высокое сечение поглощения тепловых нейтронов, поэтому 10В в составе борной кислоты применяется в атомных реакторах для регулирования реактивности. Химические свойства. По многим физическим и химическим свойствам неметалл бор напоминает кремний. Химически бор довольно инертен и при комнатной температуре взаимодействует только со фтором:
При нагревании бор реагирует с другими галогенами с образованием тригалогенидов, с азотом образует нитрид бора BN, с фосфором — фосфид BP, с углеродом — карбиды различного состава (B4C, B12C3, B13C2). При нагревании в атмосфере кислорода или на воздухе бор сгорает с большим выделением теплоты, образуется оксид B2O3:
С водородом бор напрямую не взаимодействует, хотя известно довольно большое число бороводородов (боранов) различного состава, получаемых при обработке боридов щелочных или щелочноземельных металлов кислотой:
При сильном нагревании бор проявляет восстановительные свойства. Он способен, например, восстановить кремний или фосфор из их оксидов:
Данное свойство бора можно объяснить очень высокой прочностью химических связей в оксиде бора B2O3. При отсутствии окислителей бор устойчив к действию растворов щелочей. В горячей азотной, серной кислотах и в царской водке бор растворяется с образованием борной кислоты. Оксид бора — типичный кислотный оксид. Он реагирует с водой с образованием борной кислоты:
При взаимодействии борной кислоты со щелочами возникают соли не самой борной кислоты — бораты (содержащие анион BO33−), а тетрабораты, например:
Получение. Аморфный бор, сильно загрязненный боридами металлов, получают металлотермическим восстановлением оксида или обезвоженной буры: В203 + 3Mg = 2В + 3MgO Более чистый продукт образуется при восстановлении летучих соединений бора водородом на нагретой до 1150 °С танталовой проволоке: 2BBr3 + ЗН2 = 2В + 6НВr или при их термическом разложении: 2BI3+2H2 = 2В + 3I2 Соединения бора. Сульфид бора (B2S3) образуется в виде бесцветной стекловидной массы при накаливании бора в парах серы. Водой он полностью разлагается на борную кислоту и H2 S. С азотом бор соединяется только выше 1200 °С. Нитрид бора (BN) представляет собой белый порошок, плавящийся лишь около 3000 °С (под давлением). По кристаллической структуре BN сходен с графитом. Карбид бора (В4С) образуется в виде черных блестящих кристаллов принакаливании смеси бора (или В2 О3) с углем в электрической печи. Он отличается тугоплавкостью (т. пл. 2550 °С) и чрезвычайной твердостью (близкой к твердости алмаза). И нитрид и карбид бора характеризуются большой устойчивостью по отношению к различным химическим воздействиям. БОРА НИТРИД, BN, кристаллический, имеет три модификации: гексагональную a-BN, кубическую b-BN (боразон) и ромбоэдрическую g-BN. Гексагональный нитрид бора альфа-BN. Кристаллическая структура a-BN состоит из графитоподобных сеток, расположенных, в отличие от структуры графита точно одна под другой с чередованием атомов бора и азота. Белый, похожий на тальк порошок a-BN, получают из элементов при температурах выше 2000 °С. Нитрид бора может быть получен также прокаливанием бора (или B2O3) в атмосфере аммиака или при нагревании смеси B2O3 с восстановителями (углем, магнием) в атмосфере аммиака. По смазочным свойствам a-BN превосходит графит. В спрессованном состоянии нитрид бора обладает полупроводниковыми свойствами, а при наличии небольшого количества примесей обладает люминесцентными свойствами. Нитрид бора при комнатной температуре химически инертен, не реагирует с кислородом или хлором, кислотами или щелочами. Кислород и хлор начинают действовать на него при температурах выше 700 °С. Реагирует с фтором (образуя BF3 и N2) и с HF (образуя NH4BF4); горячие растворы щелочей разлагают его с выделением NH3. При температуре выше 1000°С начинает разлагаться на элементы. Алмазоподобная форма бета-BN (боразон). При давлении выше 62 тыс атм и температурах выше 1350 °С происходит полиморфное превращение графитоподобной гексагональной b-BN модификации в кубическую алмазоподобную b-BN структуру. Хорошими катализаторами такого превращения являются щелочные и щелочноземельные металлы. Как и в случае перехода графит—алмаз, полиморфное превращение сопровождается резким изменением свойств нитрида бора. Кристаллы боразона, полученные при аллотропическом переходе BN (гекс.) — BN (куб.) при высоких давлениях, имеют вид полиэдров, обычно тетраэдров или октаэдров. Они прозрачны, а их цвет зависит от наличия и типа примесей. Размер образующихся кристаллов боразона зависит от давления и температуры процесса. Избыток бора в реакционной смеси придавал полученным кристаллам боразона коричневый или черный цвет, бериллий — синий, сера — желтый. Твердость его при оценке по шкале Мооса соизмерима с твердостью алмаза (около 10 баллов), однако боразон сильно превосходит алмаз по термостойкости (до 2000 °С) и ударной прочности. Химическая стойкость боразона значительно выше, чем обычной формы нитрида бора. Ромбоэдрический гамма-BN.
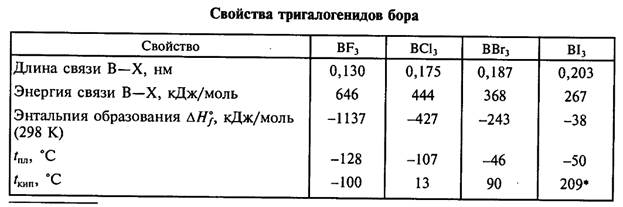
Ромбоэдрическая модификация g-BN обнаружена наряду с гексагональной при получении нитрида бора взаимодействием бората натрия с цианистым калием. Нитрид бора и материалы на его основе занимают заметное место в ряду важнейших инструментальных материалов и являются основой многих современных технологий. Он нашел широкое применение в реакциях промышленного органического синтеза и при крекинге нефти, в изделиях высокотемпературной техники, в производстве полупроводников, получении высокочистых металлов, газовых диэлектриков, как средство для тушения возгораний. Из нитрида бора изготовляют высокоогнеупорные материалы, проявляющие как полупроводниковые, так и диэлектрические свойства. Основанием для широкого применения боразона в инструментах, послужила наибольшая твёрдость, приближающаяся к твёрдости алмаза. Из боразона изготавливают изделия, применяемые в высокотемпературной технике (тигли, изоляторы, тигли для получения полупроводниковых кристаллов, детали электровакуумных приборов); он применяется для производства полупроводниковых приборов и интегральных схем (твердотельные планарные источники примеси бора, диэлектрические прокладки конденсаторов), деталей электровакуумных приборов (окон выводов энергии, стержней теплоотводов). Галогениды бора по строению и свойствам существенно отличаются от галогенидов других элементов 13-й группы. Известны четыре высших галогенида бора. Все они состоят из молекул ВХ3, имеющих форму правильного треугольника, в центре которого расположен атом бора в состоянии sp2-гибридизации. Связи В—X оказываются короче рассчитанных для одинарной сигма-связи. С увеличением размера атомов галогенов прочность связей В—X и устойчивость молекул ВХ3 падают.
В ряду галогенидов бора от фторида к иодиду межмолекулярные взаимодействия усиливаются, благодаря чему растут температуры плавления и кипения (см. табл. 4.4). При обычных условиях BF3 и ВС13— газы, ВВг3 — жидкость, а ВI3 — летучее твердое вещество. Трифторид BF3 получают фторированием боратов: 6CaF2 + Na2B407 + 8H2S04(конц.)= 4BF3t + 2NaHS04 + 6CaS04 + 7H20 борной кислоты или ее ангидрида: В203 + 6NaBF4 + 3H2S04(конц.)= 8BF3 + 3Na2S04 + 3H20 a BCl3 и BBr3 — прямым синтезом, галогенированием смеси оксида бора с углеродной сажей: 700 °С В203 + ЗС + ЗС12 (Br2 )= ЗСО + 2ВС13 (ВВг3) или пропусканием трифторида бора над галогенидом алюминия: А1Вг3 + BF3 = BBr3 + A1F3 Трииодид ВI3 образуется при взаимодействии борогидрида лития LiBH4 с иодом при -78 °С: LiBH4 + 4I2 = BI3 + 4HI + LiI Тригалогениды бора — сильные кислоты Льюиса (акцепторы электронов) и легко взаимодействуют с молекулами — донорами электронов, т. е. основаниями Льюиса: BF3 + NH3 = F3B:NH3 BF3 + 0(C2H5)2=F3B:0(C2H5)2 при этом sp2-гибридизация орбиталей переходит в sp3-гибридизацию, плоская молекула приобретает пирамидальную конфигурацию, и координационное число атома бора повышается до четырех. Кислотность соединений ВХ3 проявляется и в их склонности к гидролизу. Хлорид, бромид и иодид дымят на влажном воздухе, а водой мгновенно разлагаются: ВХ3 + 3H2O = Н3В03 + ЗНХ (X = Сl, Вг, I) Фторид медленно взаимодействует с водой: 4BF3 + ЗН20 = Н3В03 + 3HBF4 При пропускании BF3 через ледяную воду может быть выделен гидрат BF3.2H20, имеющий ионное строение: H30+[BF30H]-. Тетрафтороборная кислота HBF4, образующаяся при гидролизе BF3, гораздо сильнее плавиковой (рKa равна-0,2) и подобно ей ядовита. Она существует только в растворах, которые готовят, растворяя борную кислоту в 40 %-м растворе HF: Н3В03 + 4HF = HBF4 + ЗН20 Нейтрализацией растворов тетрафтороборной кислоты получают ее соли — тетрафторобораты. Они более устойчивы, чем кислота, и плавятся без разложения. Na[BF4] удобно получать фторированием буры: 14HF + Na2B407 + 2NaF = 4NaBF4 + 7Н2О Свежеприготовленные растворы тетрафтороборатов щелочных металлов имеют нейтральную среду, однако при хранении они постепенно подщелачиваются за счет слабого гидролиза. Кислоту HBF4 и ее соли используют в качестве компонентов антикоррозионных покрытий, для нанесения защитных металлических пленок, в производстве ионообменных и ионоселективных мембран, в металлургии для получения сплавов Аl — В и нержавеющей стали. Некоторые тетрафторобораты активны в качестве катализаторов органических реакций. Боразол.
Являясь неорганическим аналогом бензола, боразол напоминает бензол по своим физическим свойствам (агрегатное состояние, интервал кипения, плотность и т. п.); в то же время, химические свойства боразола и бензола резко различаются. Реакционная способность боразола выше, чем у бензола, вследствие полярности связей (три атома азота поставляют свои неподеленные электронные пары на свободные орбитали атомов бора). Так, он окисляется на воздухе, растворим в воде, с которой постепенно реагирует с образованием В(ОН)3, NH3 и Н2, и менее термически устойчив, чем бензол. Атомы Н, связанные с атомами B, способны замещаться без разрушения цикла. Так, при действии BCl3 или BBr3 на боразол при нагревании, образуются твердые устойчивые соединения — тригалогенборазолы B3N3H3Hal3. Атомы H при N неспособны вступать в реакции замещения. Получение. Боразол можно получить нагреванием тетрагидробората лития и хлорида аммония:
По реакции диборана с аммиаком, которая также проводится при нагревании:
Реакцией трихлорида бора с хлоридом аммония. Реакция идет в две стадии:
Боразол используют для получения BN, его орг. производные - для синтеза термостойких полимеров. Напр., при пиролизе N-трифенилборазола образуется полимер состава [—(C6H5)3N3B3H—]23, в котором боразольные циклы связаны через атомы бора. 28. Получение, строение, свойства диборана (трехцентровая двухэлектронная связь). Гомологические ряды гидридов бора: ВnHn+4 и ВnHn+6. Бориды металлов. Гидриды бора (или бораны) — один из самых необычных классов неорганических соединений с особыми структурными принципами организации химических связей, сложной стехиометрией, большим разнообразием химических реакций. Бораны — ядовитые, неустойчивые молекулярные соединения с крайне неприятным запахом, хорошо растворимые в органических растворителях. С увеличением молекулярной массы растут их температуры плавления и кипения: при комнатной температуре диборан B2H6 — газ, пентаборан В5Н9 — жидкость, а декаборан В10Н14 — твердое вещество. Бораны химически активны, легко окисляются на воздухе и разлагаются водой. Моноборан ВН3 неустойчив. Из-за наличия трех связей В—Н и четырех орбиталей атом бора в ВН3 координационно ненасыщен, и молекула ВН3 легко присоединяет молекулы или ионы с неподеленными электронными парами, например молекулу аммиака, образуя прочные молекулярные соединения: Н3В + NH3 = H3B:NH3 Моноборан ВН3 выделен конденсацией паров таких соединений при температуре жидкого азота.
Особое место среди гидридов бора занимает диборан В2Н6, являющийся исходным веществом для получения всех остальных боранов. Его синтезируют восстановлением соединений бора гидридом натрия при нагревании (175 °С): 2BF3(г.)
|
||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 1177; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.135.206.19 (0.017 с.) |





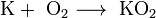




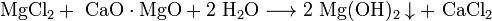





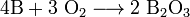
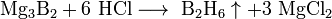
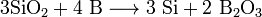

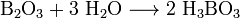

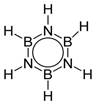 Боразол (боразин, триборинтриимид) — химическое вещество с химической формулой B3H6N3, бесцветная жидкость. Молекула представляет собой шестичленное плоское кольцо, в котором чередуются атомы бора и азота, каждый из них соединён с одним атомом водорода.
Боразол (боразин, триборинтриимид) — химическое вещество с химической формулой B3H6N3, бесцветная жидкость. Молекула представляет собой шестичленное плоское кольцо, в котором чередуются атомы бора и азота, каждый из них соединён с одним атомом водорода.