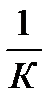Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
По принадлежности к определенному классу соединенийСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
По принадлежности к определенному классу соединений a) Комплексные кислоты Н[AuCl4] - хлористозолотая кислота б) Комплексные основания [Ag (NH3)2]OH - гидроксид диамминосеребра в) комплексные соли K2[PtCl4] – хлорплатинит калия По природе лигандов а) аквокомплексы -лигандами являются молекулы воды. [Co(H2O)6]SO4; [Cu(H2O)4](NO3)2 б) аммиакаты -лигандами являются молекулы аммиака [Ag(NH3)2]Cl; [Cu(NH3)4]SO4; [Co(NH3)6]Cl2 в) гидроксокомплексы- соединения с ОН --группами в виде лигандов. K3[Al(OH)6]; Nа 2[Zn(OH)4] г) ацидокомплексы- содержат в качестве лигандов анионы различных кислот. По знаку заряда комплекса а) Комплексные катионы [Co(NH3)6]2+Cl2; [Zn(NH3)4]2+Cl2 б) Комплексные анионы K2[HgI4]2-; K3Fe[CN)6]3- в) нейтральные комплексы - не имеют внешней сферы. [Fe(CO)5]; [Ni(CO)4]; [Co(NH3)3Cl3] Более сложны бикомплексы - содержат комплексный катион и комплексный анион: [Co (NH3)6] [Fe (CN) 6] Особую группу составляют сверхкомплексы, в которых число лигандов превышает координационное число комплексообразователя: CuSO4 · 5H2O FeSO4 · 7H2O Дентантность (координационная емкость) лиганда - это число координационных мест, которое может занимать данный лиганд. Дентантность определяется числом донорных атомов, входящих в его состав. Лиганды, содержащие 2 и более донорных атомов называют полидентантными.Число монодентантных лигандов в координационной сфере равно координационному числу комплексообразователя.Многие комплексные соединения, содержащие полидентантные лиганды, являются хелатами. Лиганды захватывают комплексообразователь подобно клешне рака (греч. Chele – клешня). Лиганд присоединяется к комплексообразователю одновременно двумя типами связей- ионной и ковалентной, возникшей по донорно- акцепторному механизму (стрелка от донора к акцептору). Комплексообразователь как бы втянут внутрь лиганда, охвачен связями наподобие клешни рака, отсюда и название (хелат). Пример хелата - это двунатриевая соль этилендиаминтетрауксусной кислоты, известная под названием трилона Б (или комплексон III)
1) сначала называют анион, 2) затем катион в родительном падеже и как у простых солей справа налево перечисляют все составные части. Название комплексного катиона составляют так: сначала указывают число, (используя греческие числительные ди, три, тетра, гекса и т.д.) и названия нейтральных лигандов, вода - аква, аммиак - аммин, затем числа и названия отрицательно заряженных лигандов с окончанием «о» (Cl- - хлоро, SO4- - сульфато, ОН- -гидроксо) последним указывают комплексообразователь, указывая степень его окисленности (в скобках римскими цифрами после названия комплексообразователя). Название комплексного аниона составляют аналогично названию катиона, но степень окисленности комплексообразователя указывают перед его названием. Окончание у комплексного аниона «АТ». Названия нейтральных комплексов образуют, так же как и катионов, но комплексообразователь называют в именительном падеже, а степень окисленности не указывают, т.к. она определяется электроотрицательностью комплекса. K3[Fe(CN)6] – гексацианноферрат (III) калия [Al(H2O)6]Cl3 – хлорид гексааквааллюминия K[Co+3(NH30)4CO3]+Cl- - хлорид карбонато-тетраамминкобальта (III) [Pt(NH3)2Cl4]0 – тетрахлордиаммин платина Изомеры- вещества, имеющие одинаковый качественный и количественный состав, но разное строение. У комплексных соединений наиболее распространены следующие виды изомерии: 1)Геометрическая (цис - транс) изомерия обусловлена различными положениями лигандов относительно друг друга. Например диамминтетрахлорплатина [Pt(NH3)2Cl4]0
2) Гидратная - обусловлена неодинаковым расположением молекул воды между внутренней и внешней сферами комплексных соединений: [Cr(H2O)6]Cl3; [CrCl2(H2O)4]Cl · 2H2O 3)Ионизационная - неодинаковое распределение кислотных остатков (ионов) между внутренней и внешней сферами комплексных соединений: [CoBr(NH3)5]SO4 -Сульфат пентаамминбромокобальта (III) - к расно-фиолетовый [CoSO4(NH3)5]Br -Бромид пентаамминсульфатокобальта (III) – красный 4)Координационная:
1.МВС 2.Теория кристаллического поля (ТКП) 3.ММО МВС. Очень наглядным способом описания комплексных соединений является МВС, предложенный и разработанный Полингом в 30-х годах, вскоре после создания квантовой механики. В основе метода лежат следующие положения: 1) Мерой прочности связи служит степень перекрывания орбиталей. 2) Орбитали центрального атома, подвергаются гибридизации.. Гибридизация электронных орбиталей комплексообразователя определяет геометрию комплекса. 3) Дополнительное упрочнение комплекса обусловлено тем, что наряду с δ-связями могут возникать и π-связи. 4) Исходя из заселенности орбиталей объясняются магнитные свойства.
Карбонилы – комплексы, в к-рых комплексообразователииграют атомы переходных металлов с нулевой ст.о. Лигандами явл. Нейтральные молекулы. Диамогнитные св-ва в-ва, т.к. все электроны металла спарены.
Комплексные соединения в растворе ведут себя как сильные электролиты, т.е. полностью диссоциируют на ионы. Идет первичная диссоциация.
Наряду с этим процессом хоть и в незначительной степени, происходит вторичная диссоциация внутренней сферы комплекса, т.к. комплексный ион является слабым электролитом.
Применим закон действующих масс, к равновесиям диссоциации слабых электролитов, получим выражения констант нестойкости комплексных ионов.
Константа нестойкости есть мера прочности комплекса. Из 2-х приведенных комплексов более устойчив второй, ему отвечает меньшая КН и меньшая равновесная концентрация ионов серебра в растворе Вместо константы нестойкости иногда пользуются величиной обратной, называемой константой устойчивости Куст = 1/кн, или константой образования комплекса. Важно отметить, что диссоциация комплексных ионов, аналогично слабым электролитам протекает ступенчато. Например: у комплекса [Ag(NH3)2] отщепляется сначала одна молекула аммиака, а затем вторая. I ст. [Ag(NH3)2]↔ [Ag(NH3)]+ + NH3 K1 = 6·10-4 II ст. [Ag(NH3)]+↔ Ag+ + NH3 K2 = 1·10-4 Произведения констант последовательных ступеней диссоциации дает полную константу нестойкости данного комплекса:
Целый ряд соединений, которые рассматриваются как комплексные имеет малоустойчивую внутреннюю сферу называются двойными солями. Их обозначают не так как комплексные, а как соединения молекул, например K 2SO 4 · Al 2(SO4)3. В ацидокомплексе связи между комплексообразователем и лигандами имеют ионный характер. Двойные соли отличаются от комплексных солей диссоциацией комплексного иона. У двойных солей диссоциация комплексного иона полная, а у комплексных солей- незначительная. Получаются двойные соли посредством кристаллизации из растворов, содержащих указанные ионы. При растворении в воде эта соль диссоциирует на ионы
К двойным солям относится соль Мора
Двойной хлорид калия и меди
Двойными солями называются продукты замещения атомов водорода в кислотах на два различных катиона.
Степень окисления (СО) - условный заряд атома элемента, вычисленный исходя из предположения,что молекула состоит из ионов. Реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ, называются окислительно – восстановительными. Другими словами это реакции, связанные с передачей электронов от одних атомов к другим. Окисление – процесс отдачи электронов атомом, молекулой или ионом, степень окисления при этом повышается. Восстановление – процесс присоединения электронов атомом, молекулой, ионом. Степень окисления при этом понижается. Восстановители – молекулы или ионы отдающие электроны, сами при этом восстановители окисляются. Окислители – молекулы или ионы, присоединяющие электроны,во время реакции окислители восстанавливаются. Окислители –элементы которе обладают высокой электроотрицательностью,, например, F2, O2, Cl2, Br2, S,K 2Cr+62O7, KMn+7O4, HN+5O3, H2S+6O4, HCl+7O4, K2Cr+6O4,Ag +, Au3+, Cu2+, H+, Fe3+, и т.д. Восстановители –элементами с низкой электроотрицательностью:H2, B, C, Fr,Fe+2Cl 2, Cr2+3(SO4)3, KCl-1, H2S-2, N-3H3, H2S+4O3. Вещества, содержащие элементы в промежуточных степенях окисления, могут выполнять как функции окислителей, так и восстановителей, т.е. обладают окислительно – восстановительной двойственностью. 1. Реакции, протекающие без изменения С.О. атомов, входящих в состав реагирующих веществ. К ним относятся а) реакции обмена, например: Ba 2+Cl-2 + K2+S+6O-24 = Ba+2S+6O-24 ↓ + 2K+Cl - б) некоторые реакции соединения, разложения NaOH + CO2 = NaHCO3 CaCO3 =t CaO + CO2 2. Реакции, сопровождающиеся изменением С.О. атомов реагирующих веществ. К данному типу относятся реакции окисления-восстановления а) реакции замещения Cu SО4(p) + Zn(k) = Cu(k) + ZnSO4(p) ΔG0298 = -212кДж\моль Ca + 2H2O = Ca(OH)2 + H2 ↑ б) некоторые реакции соединения, разложения Ba + O2 = 2BaO NH4NO2 = N2 +2H2O N lg a восст. ЭДС = Е0окисл. – Е0восст.; Сисх./ Спрод.= 1/К В состоянии равновесия активности реагентов и продуктов приобретут равные значения и ЭДС станет равной нулю, а выражение под знаком логарифма 1/К, тогда ln1/K = ln1 - lnK; ln1=0 O = ΔE0+(R · T/ n· F) · ln ΔЕ0- (R · T/n · F) · lnK или +n ∙ F · Δ E0 = RT · lnK
- n· F · ΔE0 = Δ G В соответствии со II законом термодинамики самопроизвольно протекают только процессы имеющие Δ G<0, то реакция ОВР идет слева направо, только если ЭДС>0. ΔGp = -RT· lnK = -nF· ΔE0 Если взаимодействует сильный окислитель с сильным восстановителем, то происходит односторонний процесс. Он практически протекает до конца, т.к. его продуктами обычно является соединения со слабо выраженными окислительно–восстановительными свойствами. При малом отличии окислительно–восстановительной активности исходных веществ и продуктов реакции процесс является двусторонним. Для количественной оценки направленности процессов пользуются значениями G0 реагентов и продуктов реакции, а для частного случая ОВР, протекающих в разбавленных водных растворах при t=250С, 101кПа можно пользоваться значениями нормальных электродных потенциалов. Сопоставляя электродные потенциалы соответствующих систем,, можно заранее определять направление в котором будет протекать ОВР. Стандартная э.д.с. Е0 гальванического элемента связана со стандартной энергией Гиббса ∆ G0 протекающей в элементе реакции соотношением. ∆ G0=-nF· ∆E0 С другой стороны ∆G0 связана с константой равновесия К реакции уравнением. n ·F·ΔE0 = 2,3 · RT · lgK lgK = n ∙F · Δ E0 / 2,3 RT lgK = n ∙ Δ E0 / 0,059 Эту работу можно предоставить как количество переменного в ходе этого процесса электричества nF (n – число электронов, переходящих от восстановителя к окислителю в элементарном акте реакции, F – постоянная Фарадея), умноженнае на разность потенциалов Е между электродами соответствующего гальванического элемента. ΔG= - n· F · Δ E Для ОВР при Т = 298 ΔG0= - n ·F · ΔE0
При условиях, отличающихся от стандартных, для системы Ox + ne ↔ Red электродный потенциалопределяется уравнением Нернста
Eoх/Red = E00х/Red - (RT/n· F) · ln(C(Red)/С(Ox)) Eox/Red и E0ox/Red - электродный и стандартный потенциалы системы. n – число электронов, участвующих в процессе. C(Red) и Cox молярные концентрации восстановленной и окисленной форм.
Eox/Red = E0ox/Red – (0,059/n) · lg C(Red)/С(Ox) или
Например: для системы MnO4- + 8H+ + 5e ↔ Mn2+ + 4H2O E MnO-4/ Mn2+ = 1,51 – (0,059/5) · lg (CMn2+/СMnO-4 · C(H+)8) Пример: Выбрать галогенид калия в качестве восстановителя для FeCl3
2KГ- + 2 Fe 3+Cl3(P) = Г02 + 2KCl(P) + 2 Fe 2+Cl2(P) (Г = F-, Cl-, Br-, I- ) По таблице: E0Fe3+/Fe+2 = +0,77B E0F2/2F- = + 2,86B E0Cl2/2Cl- = + 1,36B E0Br2/2Br- = +1,07B E0I2/2I- = +0,54B < 0.77 B Вычислим э.д.с. с участием гологенидов для KI
ΔЕ0298 = Е0окисл. – Е0восст. = 0,77 – 0,54 = 0,23В > 0. Только иодид калия будет изменение энергии Гиббса реакции ΔGреакции = ∑ΔG0298f(конечные) - ∑ΔG0298f(исходные) На примере реакции 2NaOH + H2SO4 = Na2SO4 + H2O Энергии Гиббса образования ΔGof(NaOH) ΔGof(H2SO4) ΔGof(H2O) ΔGof(Na2SO4) ΔGреакции=[ΔGNa2SO4+ΔGH2O] - [ΔGH2SO4+ΔGNaOH*2] Гальванический элемент широко используются в телефонных аппаратах, игрушках, системах сигнализации и др. Поскольку спектр приборов, в которых используются сухие элементы, весьма широк и, кроме того требуется их периодическая замена Электролиз – это совокупность процессов, проходящих на электродах при прохождении электрического тока через раствор или расплав электролита. Электролиты – проводники второго рода. При электролизе катод служит восстановителем (отдает электроны катионам), а анод – окислителем (принимает электроны от анионов). Сущность электролиза состоит в осуществлении за счет электрической энергии химических реакций – восстановления на катоде (К) и окисления на аноде (А). Эти процессы называются процессами (реакциями) электровосстановления и электроокисления. Восстановительное и окислительное действие электрического тока во много раз сильнее действия химических окислителей и восстановителей. Различают электролиз расплавов и растворов электролитов. Электролиз расплавов солей 1) Все катионы металлов восстанавливаются на катоде: К(-): Zn2+ + 2e- → Zn0; Na+ + 1e- → Na0 2) Анионы бескислородных кислот окисляются на аноде: А(+): 2Cl¯ - 2e-→Cl2 3) Анионы кислородсодержащих кислот образуют соответствующий кислотный оксид и кислород: А(+): 2SO42ˉ - 4e- → 2SO3 + O2 Электролиз водных растворов электролитов На ход процесса электролиза и характер конечных продуктов большое влияние оказывают природа растворителя, материал электродов, плотность тока на них и другие факторы. В водных растворах электролитов, кроме гидратированных катионов и анионов, присутствуют молекулы воды, которые также могут подвергаться электрохимическому окислению и восстановлению. Какие именно электрохимические процессы будут протекать на электродах при электролизе, зависит от значения электродных потенциалов соответствующих электрохимических систем. Анодные процессы. При электролизе веществ используется инертные, не изменяющиеся в процессе электролиза аноды (графитовые, платиновые) и растворимые аноды, окисляющиеся в процессе электролиза легче, чем анионы (из цинка, никеля, серебра, меди и других металлов). 1) Анионы бескислородных кислот (S2ˉ, I¯, Br¯, Cl¯) при их достаточной концентрации легко окисляются до соответствующих простых веществ. 2) При электролизе водных растворов щелочей, кислородсодержащих кислот и их солей, а также плавиковой кислоты и фторидов происходит электрохимическое окисление воды с выделение кислорода: в щелочных растворах: 4OH¯ - 4e- → O2 + 2H2O в кислых и нейтральных растворах: 2H2O - 4e- → O2 + 4H+ Применение электролиза. Получение целевых продуктов путем электролиза позволяет сравнительно просто (регулируя силу тока) управлять скоростью и направленностью процесса, благодаря чему можно осуществлять процессы как в самых "мягких", так и в предельно "жестких" условиях окисления или восстановления, получая сильнейшие окислители и восстановители. Путем электролиза производят Н2 и О2 из воды, С12 из водных р-ров NaCl, F2 из расплава KF в KH2F3. Гидроэлектрометаллургия - важная отрасль металлургии цветных металлов (Сu, Bi, Sb, Sn, Pb, Ni, Co, Cd, Zn); она применяется также для получения благородных и рассеянных металлов, Мn, Сr. Электролиз используют непосредственно для катодного выделения металла после того, как он переведен из руды в р-р, а р-р подвергнут очистке. Такой процесс наз. электроэкстракцией. Электролиз применяют также для очистки металла - электролитич. рафинирования (электрорафинирование). Этот процесс состоит в анодном растворении загрязненного металла и в последующем его катодном осаждении. Рафинирование и электроэкстракцию проводят с жидкими электродами из ртути и амальгам (амальгамная металлургия) и с электродами из твердых металлов. Электролиз расплавов электролитов - важный способ произ-ва мн. металлов. Так, напр., алюминий-сырец получают электролизом криолит-глиноземного расплава (Na3AlF6 + A12O3), очистку сырца осуществляют электролитич. рафинированием. При этом анодом служит расплав А1, содержащий до 35% Сu (для утяжеления) и потому находящийся на дне ванны электролизера. Средний жидкий слой ванны содержит ВаС12, A1F3 и NaF, a верхний - расплавленный рафинир. А1 и служит катодом. Электролиз расплава хлорида магния или обезвоженного карналлита - наиб. распространенный способ получения Mg. В пром. масштабе электролиз расплавов используют для получения щелочных и щел.-зем. металлов, Be, Ti, W, Mo, Zr, U и др. К электролитич. способам получения металлов относят также восстановление ионов металла другим, более электро-отрицат. металлом. Выделение металлов восстановлением их водородом также часто включает стадии электролиза - электрохим. ионизацию водорода и осаждение ионов металла за счет освобождающихся при этом электронов. Важную роль играют процессы совместного выделения или растворения неск. металлов, совместного выделения металлов и мол. водорода на катоде и адсорбции компонентов р-ра на электродах. Электролиз используют для приготовления металлич. порошков с заданными св-вами. АККУМУЛЯТОРЫ электрические (от лат. accumulator- собиратель, накопитель), хим. источники тока многократного действия. При заряде от внеш. источника электрич. тока в аккумуляторе накапливается энергия, к-рая при разряде вследствие хим. р-ции непосредственно превращ. снова в электрическую и выделяется во внеш. цепь. По принципу работы и осн. элементам конструкции аккумуляторы не отличаются от гальванических элементов, но электродные р-ции, а также суммарная токообразующая р-ция в аккумуляторах обратимы. Поэтому после разряда аккумулятора может быть снова заряжен пропусканием тока в обратном направлении: на положит. электроде при этом образуется окислитель, на отрицательном-восстановитель.
Наиб. распространены свинцовые аккумуляторы, часто наз. также кислотными. Их действие основано на р-ции:
Коррозия – процесс самопроизвольно разрушения металла в результате физ-хим. взаимодействия с окружающей средой. По механизму:химическая и электрохимическая. Химическая-разрушение металла при его окислении без возникновения электрического тока. Электрохимическая- разрушение металла в среде электролита с возникновением внутри системы электрического тока. Коррозия подвергает детали и узлы двигателей, газовых турбин, ракетных установок. Хим коррозия встречается в процессе обработки металлов при высоких температурах и напряжении. Электрохим.каррозия может протекать: в электролитах, в почве, в атмосфере любого влажного газа.
В качестве защиты от коррозии может применяться нанесение какого-либо покрытия, которое препятствует образованию коррозионного элемента (пассивный метод) Красочное покрытие, полимерное покрытие и эмалирование должны, прежде всего, предотвратить доступ кислорода и влаги. Часто также применяется покрытие, например, стали другими металлами, такими как цинк, олово, хром, никель. Цинковое покрытие защищает сталь даже когда покрытие частично разрушено. Цинк имеет более отрицательный потенциал и корродирует первым. Ионы Zn2+ токсичны. При изготовлении консервных банок применяют жесть, покрытую слоем олова. В отличие от оцинкованной жести, при разрушении слоя олова корродировать, притом усиленно, начинает железо, так как олово имеет более положительный потенциал. Другая возможность защитить металл от коррозии — применение защитного электрода с большим отрицательным потенциалом, например, из цинка или магния. Для этого специально создаётся коррозионный элемент. Защищаемый металл выступает в роли катода, и этот вид защиты называют катодной защитой. Растворяемый электрод, называют, соответственно, анодом протекторной защиты Этот метод применяют для защиты от коррозии морских судов, мостов, котельных установок, расположенных под землей труб. Для защиты корпуса судна на наружную сторону корпуса крепят цинковые пластинки. Если сравнить потенциалы цинка и магния с железом, они имеют более отрицательные потенциалы. Но тем не менее корродируют они медленнее вследствие образования на поверхности защитной оксидной плёнки, которая защищает металл от дальнейшей коррозии. Образование такой плёнки называют пассивацией металла. У алюминия её усиливают анодным окислением (анодирование). При добавлении небольшого количества хрома в сталь на поверхности металла образуется оксидная плёнка. Содержание хрома в нержавеющей стали — более 12 процентов. Катодная защита от коррозии Катодная электрохимическая защита от коррозии применяется тогда, когда защищаемый металл не склонен к пассивации. Это один из основных видов защиты металлов от коррозии. Суть катодной защиты состоит в приложении к изделию внешнего тока от отрицательного полюса, который поляризует катодные участки коррозионных элементов, приближая значение потенциала к анодным. Положительный полюс источника тока присоединяется к аноду. При этом коррозия защищаемой конструкции почти сводится к нулю. Анод же постепенно разрушается и его необходимо периодически менять. Существует несколько вариантов катодной защиты: поляризация от внешнего источника электрического тока; уменьшение скорости протекания катодного процесса (например, деаэрация электролита); контакт с металлом, у которого потенциал свободной коррозии в данной среде более электроотрицательный (так называемая, протекторная защита). Поляризация от внешнего источника электрического тока используется очень часто для защиты сооружений, находящихся в почве, воде (днища судов и т.д.). Кроме того данный вид коррозионной защиты применяется для цинка, олова, алюминия и его сплавов, титана, меди и ее сплавов, свинца, а также высокохромистых, углеродистых, легированных (как низко так и высоколегированных) сталей. Внешним источником тока служат станции катодной защиты, которые состоят из выпрямителя (преобразователь), токоподвода к защищаемому сооружению, анодных заземлителей, электрода сравнения и анодного кабеля. Катодная защита применяется как самостоятельный, так и дополнительный вид коррозионной защиты. Главным критерием, по которому можно судить о эффективности катодной защиты, является защитный потенциал. Защитным называется потенциал, при котором скорость коррозии металла в определенных условиях окружающей среды принимает самое низкое (на сколько это возможно) значение. В использовании катодной защиты есть свои недостатки. Одним из них является опасность перезащиты. Перезащита наблюдается при большом смещении потенциала защищаемого объекта в отрицательную сторону. При этом выделяется. В результате – разрушение защитных покрытий, водородное охрупчивание металла, коррозионное растрескивание. Протекторная защита (применение протектора) Разновидностью катодной защиты является протекторная. При использовании протекторной защиты к защищаемому объекту подсоединяется металл с более электроотрицательным потенциалом. При этом идет разрушение не конструкции, а протектора. Со временем протектор корродирует и его необходимо заменять на новый. Протекторная защита эффективна в случаях, когда между протектором и окружающей средой небольшое переходное сопротивление. Каждый протектор имеет свой радиус защитного действия, который определяется максимально возможным расстоянием, на которое можно удалить протектор без потери защитного эффекта. Применяется протекторная защита чаще всего тогда, когда невозможно или трудно и дорого подвести к конструкции ток. Протекторы используются для защиты сооружений в нейтральных средах (морская или речная вода, воздух, почва и др.). Для изготовления протекторов используют такие металлы: магний, цинк, железо, алюминий. Чистые металлы не выполняют в полной мере своих защитных функций, поэтому при изготовлении протекторов их дополнительно легируют. Железные протекторы изготавливаются из углеродистых сталей либо чистого железа. Ингибиторы коррозии, химические соединения или их композиции, присутствие которых в небольших количествах в агрессивной среде замедляет коррозию металлов. Защитное действие ингибиторов коррозии обусловлено изменением состояния поверхности металла вследствие адсорбции (адсорбц. ингибиторы коррозии) или образования с ионами металла труднорастворимых соединений. Последние образуют на поверхности пленку, которая существенно тоньше конверсионных защитных покрытий (см. Защита от коррозии). Замедление коррозии происходит из-за уменьшения площади активной поверхности металла и изменения энергии активации электродных реакций, лимитирующих сложный коррозионный процесс. ингибиторы коррозии могут тормозить анодное растворение и вызывать пассивацию металла (анодные ингибиторы коррозии), снижать скорость катодного процесса (катодные ингибиторы коррозии) или замедлять оба эти процесса (смешанные ингибиторы коррозии). По принадлежности к определенному классу соединений a) Комплексные кислоты Н[AuCl4] - хлористозолотая кислота б) Комплексные основания [Ag (NH3)2]OH - гидроксид диамминосеребра в) комплексные соли K2[PtCl4] – хлорплатинит калия По природе лигандов а) аквокомплексы -лигандами являются молекулы воды. [Co(H2O)6]SO4; [Cu(H2O)4](NO3)2 б) аммиакаты -лигандами являются молекулы аммиака [Ag(NH3)2]Cl; [Cu(NH3)4]SO4; [Co(NH3)6]Cl2 в) гидроксокомплексы- соединения с ОН --группами в виде лигандов. K3[Al(OH)6]; Nа 2[Zn(OH)4] г) ацидокомплексы- содержат в качестве лигандов анионы различных кислот. По знаку заряда комплекса а) Комплексные катионы [Co(NH3)6]2+Cl2; [Zn(NH3)4]2+Cl2 б) Комплексные анионы K2[HgI4]2-; K3Fe[CN)6]3- в) нейтральные комплексы - не имеют внешней сферы. [Fe(CO)5]; [Ni(CO)4]; [Co(NH3)3Cl3] Более сложны бикомплексы - содержат комплексный катион и комплексный анион: [Co (NH3)6] [Fe (CN) 6] Особую группу составляют сверхкомплексы, в которых число лигандов превышает координационное число комплексообразователя: CuSO4 · 5H2O FeSO4 · 7H2O Дентантность (координационная емкость) лиганда - это число координационных мест, которое может занимать данный лиганд. Дентантность определяется числом донорных атомов, входящих в его состав. Лиганды, содержащие 2 и более донорных атомов называют полидентантными.Число монодентантных лигандов в координационной сфере равно координационному числу комплексообразователя.Многие комплексные соединения, содержащие полидентантные лиганды, являются хелатами. Лиганды захватывают комплексообразователь подобно клешне рака (греч. Chele – клешня). Лиганд присоединяется к комплексообразователю одновременно двумя типами связей- ионной и ковалентной, возникшей по донорно- акцепторному механизму (стрелка от донора к акцептору). Комплексообразователь как бы втянут внутрь лиганда, охвачен связями наподобие клешни рака, отсюда и название (хелат). Пример хелата - это двунатриевая соль этилендиаминтетрауксусной кислоты, известная под названием трилона Б (или комплексон III)
1) сначала называют анион, 2) затем катион в родительном падеже и как у простых солей справа налево перечисляют все составные части. Название комплексного катиона составляют так: сначала указывают число, (используя греческие числительные ди, три, тетра, гекса и т.д.) и названия нейтральных лигандов, вода - аква, аммиак - аммин, затем числа и названия отрицательно заряженных лигандов с окончанием «о» (Cl- - хлоро, SO4- - сульфато, ОН- -гидроксо) последним указывают комплексообразователь, указывая степень его окисленности (в скобках римскими цифрами после названия комплексообразователя). Название комплексного аниона составляют аналогично названию катиона, но степень окисленности комплексообразователя указывают перед его названием. Окончание у комплексного аниона «АТ». Названия нейтральных комплексов образуют, так же как и катионов, но комплексообразователь называют в именительном падеже, а степень окисленности не указывают, т.к. она определяется электроотрицательностью комплекса. K3[Fe(CN)6] – гексацианноферрат (III) калия [Al(H2O)6]Cl3 – хлорид гексааквааллюминия K[Co+3(NH30)4CO3]+Cl- - хлорид карбонато-тетраамминкобальта (III) [Pt(NH3)2Cl4]0 – тетрахлордиаммин платина Изомеры- вещества, имеющие одинаковый качественный и количественный состав, но разное строение. У комплексных соединений наиболее распространены следующие виды изомерии: 1)Геометрическая (цис - транс) изомерия обусловлена различными положениями лигандов относительно друг друга. Например диамминтетрахлорплатина [Pt(NH3)2Cl4]0
2) Гидратная - обусловлена неодинаковым расположением молекул воды между внутренней и внешней сферами комплексных соединений: [Cr(H2O)6]Cl3; [CrCl2(H2O)4]Cl · 2H2O 3)Ионизационная - неодинаковое распределение кислотных остатков (ионов) между внутренней и внешней сферами комплексных соединений: [CoBr(NH3)5]SO4 -Сульфат пентаамминбромокобальта (III) - к расно-фиолетовый [CoSO4(NH3)5]Br -Бромид пентаамминсульфатокобальта (III) – красный 4)Координационная:
1.МВС 2.Теория кристаллического поля (ТКП) 3.ММО МВС. Очень наглядным способом описания комплексных соединений является МВС, предложенный и разработанный Полингом в 30-х годах, вскоре после создания квантовой механики. В основе метода лежат следующие положения: 1) Мерой прочности связи служит степень перекрывания орбиталей. 2) Орбитали центрального атома, подвергаются гибридизации.. Гибридизация электронных орбиталей комплексообразователя определяет геометрию комплекса. 3) Дополнительное упрочнение комплекса обусловлено тем, что наряду с δ-связями могут возникать и π-связи. 4) Исходя из заселенности орбиталей объясняются магнитные свойства.
Карбонилы – комплексы, в к-рых комплексообразователииграют атомы переходных металлов с нулевой ст.о. Лигандами явл. Нейтральные молекулы. Диамогнитные св-ва в-ва, т.к. все электроны металла спарены.
Комплексные соединения в растворе ведут себя как сильные электролиты, т.е. полностью диссоциируют на ионы. Идет первичная диссоциация.
Наряду с этим процессом хоть и в незначительной степени, происходит вторичная диссоциация внутренней сферы комплекса, т.к. комплексный ион является слабым электролитом.
Применим закон действующих масс, к равновесиям диссоциации слабых электролитов, получим выражения констант нестойкости комплексных ионов.
Константа нестойкости есть мера прочности комплекса. Из 2-х приведенных комплексов более устойчив второй, ему отвечает меньшая КН и меньшая равновесная концентрация ионов серебра в растворе Вместо константы нестойкости иногда пользуются величиной обратной, называемой константой устойчивости Куст = 1/кн, или константой образования комплекса. Важно отметить, что диссоциация комплексных ионов, аналогично слабым электролитам протекает ступенчато. Например: у комплекса [Ag(NH3)2] отщепляется сначала одна молекула аммиака, а затем вторая. I ст. [Ag(NH3)2]↔ [Ag(NH3)]+ + NH3 K1 = 6·10-4 II ст. [Ag(NH3)]+↔ Ag+ + NH3 K2 = 1·10-4 Произведения констант последовательных ступеней диссоциации дает полную константу нестойкости данного комплекса:
Целый ряд соединений, которые рассматриваются как комплексные имеет малоустойчивую внутреннюю сферу называются двойными солями. Их обозначают не так как комплексные, а как соединения молекул, например K 2SO 4 · Al 2(SO4)3. В ацидокомплексе связи между комплексообразователем и лигандами имеют ионный характер. Двойные соли отличаются от комплексных солей диссоциацией комплексного иона. У двойных солей диссоциация комплексного иона полная, а у комплексных солей- незначительная. Получаются двойные соли посредством кристаллизации из растворов, содержащих указанные ионы. При растворении в воде эта соль диссоциирует на ионы
К двойным солям относится соль Мора | ||
|
| Поделиться: |