
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опыт 1. Получение и свойства гидроксида цинкаСодержание книги
Поиск на нашем сайте
В три пробирки внести по 2 капли раствора сульфата цинка и 2 н раствора гидроксида натрия до образования осадка. В первую пробирку к образовавшемуся осадку гидроксида цинка добавить избыток раствора соляной кислоты, во вторую пробирку – избыток раствора гидроксида натрия, в третью пробирку – избыток раствора аммиака. - Охарактеризовать внешний вид осадка гидроксида цинка; - составить уравнение реакции образования гидроксида цинка в молекулярной и ионной форме ZnSO4 + NaOH → недост.
- отметить растворение осадка гидроксида цинка в избытке раствора соляной кислоты……………………; раствора гидроксида натрия………………………. - составить уравнения реакций взаимодействия гидроксида цинка с соляной кислотой в молекулярной и ионной форме: Zn(OH)2 + HCl → …
- составить уравнение реакции взаимодействия гидроксида цинка с избытком гидроксида натрия, учитывая, что образуется тетрагидроксоцинкат натрия Zn(OH)2 + NaOH (изб.) →
- ответить, какие кислотно-основные свойства проявляет гидроксид цинка
- объяснить значение терминов «амфотерный оксид», «амфотерный гидроксид».
- объяснить растворение гидроксида цинка в избытке аммиака
- составить уравнение реакции, учитывая, что происходит образование гидроксида тетрааминцинка Zn(OH)2 + NH3 → …
- вывод
Опыт 2. Получение и свойства гидроксида меди (II) В четыре пробирки внести по 2 капли раствора сульфата меди (II) и 2 н раствора гидроксида натрия до образования осадка. В первую пробирку к образовавшемуся осадку гидроксида меди (II) добавить избыток раствора соляной кислоты; во вторую пробирку – избыток раствора гидроксида натрия; в третью пробирку – избыток концентрированного раствора аммиака; четвертую пробирку нагреть в пламени спиртовки. - Охарактеризовать внешний вид осадка гидроксида меди (II);
- составить уравнение реакции образования гидроксида меди (II) в молекулярной и ионной форме CuSO4 + NaOH → …
- отметить, в избытке какого раствора - соляной кислоты или гидроксида натрия- осадок гидроксида меди (II) растворился полностью…. составить уравнение реакции взаимодействия гидроксида меди (II) с соляной кислотой в молекулярной и ионной форме: Cu(OH)2 + HCl → …
- отметить, как изменился цвет раствора во второй пробирке при добавлении избытка гидроксида натрия; объяснить, учитывая возможность образования в незначительной степени гидроксокомплекса, составить уравнение реакции Cu(OH)2 + NaOH
- ответить, какие свойства - кислотные или основные - преобладают у гидроксида меди (II)………….. - отметить изменения в третьей пробирке в избытке раствора аммиака; - составить уравнение реакции учитывая, что растворение гидроксида меди (II) в избытке раствора аммиака происходит в результате образования гидроксида тетрааминмеди (II) Cu(OH)2 + NH3 → …
- отметить, какие изменения происходят при нагревании осадка гидроксида меди (II) в четвертой пробирке; - составить уравнение термического разложения гидроксида меди (II), учитывая, что образуются оксид меди (II) и вода. to Cu(OH)2 → … + … - вывод
Опыт 3. Гидролиз солей меди (II) Налить в пробирку 1-2 капли раствора соли меди (II) и 2-3 капли раствора карбоната натрия. - Отметить изменения в пробирке….
- Составить молекулярное и ионное уравнения реакций, учитывая, что образуется осадок карбоната гидроксомеди (II): СuSO4 + Na2CO3 + H2O → (CuOH)2CO3 + NaHCO3 + Na2SO4
-вывод Опыт 4. Окислительные свойства солей меди (II) а). Внести в пробирку по 1-2 капли сульфата меди (II) и иодида калия. - Отметить изменения в пробирке.
- Написать уравнение реакции сульфата меди (II) с иодидом калия, учитывая, что образуются иодид меди (I) и йод: СuSO4 + KI →
Для определения цвета выпавшего осадка иодида меди (I) необходимо свободный йод, маскирующий своей окраской цвет осадка, перевести в бесцветный ион. Для этого прибавить в пробирку несколько капель раствора тиосульфата натрия до исчезновения бурой окраски. - Взаимодействие йода с тиосульфатом натрия протекает в соответствии с уравнением: 2Na2S2O3 + I2 → 2NaI + Na2S4O6
Цвет иодида меди (I)…………. К осадку иодида меди (I) прибавить несколько капель раствора тиосульфата натрия до растворения осадка вследствие образования хорошо растворимого комплексного соединения меди (I), Na3[Cu(S2O3)2]. - Составить уравнение реакции: CuI + Na2S2O3 → Na3[Cu(S2O3)2] + NaI б). В пробирку внести 1-2 капли раствора соли меди (II) и 1-2 капли раствора тиосульфата натрия - Na2S2О3. Обесцвечивание раствора обусловлено превращением ионов меди (II) в тиосульфат меди (I):
2 Cu2+ + 3S2O32- ® Cu2S2O3 + S4O62- Раствор прокипятить, отметить цвет осадка сульфида меди (I), образующегося при кипячении по реакции Cu2S2O3 + H2O ® Cu2S¯ + SO42- + 2H+.
Реакция может быть использована для отделения ионов Cu2+ от ионов Cd2+. - вывод
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
Уфимский государственный нефтяной технический университет
Кафедра «Общая и аналитическая химия»
Дисциплина «Общая и неорганическая химия»
ОТЧЕТ По лабораторной работе №9, 10 На тему: «Химические свойства металлов VIIIБ – подгруппы и их соединений. Железо, кобальт, никель»
Выполнил студент группы__________ ______________ Фамилия И.О. (Подпись, дата)
Принял доцент кафедры ОАХ ______________ (Подпись, дата) Цель работы: - Изучить свойства металлов VIIIБ – подгруппы; - Изучить свойства характеристичных соединений металлов VIIIБ – подгруппы. Краткая теория. 1. Положение элементов в периодической системе, свойства атомов Электронные конфигурации атомов, валентные электроны металлов VIIIБ- подгруппы:
Степени окисления металлов VIIIБ - подгруппы …………..……..…….
2. Свойства простых веществ – металлов: - положение в «ряду стандартных окислительно-восстановительных (электродных) потенциалов металлов» φ(Men+/Me) = - активность металлов: - пассивирование металлов…….. Составьте уравнения реакций: - взаимодействие с кислородом: а) Fe б) Co
- взаимодействие с галогенами (хлором): а) Fe б) Ni - взаимодействие с серой: а) Fe б) Co - взаимодействие с водой термодинамически невозможно для металлов……….. - взаимодействие с водой для металла………….. термодинамически возможно, в воде ……………………. - взаимодействие с водными растворами кислот, окисляющими H+ (HF, HCl, HBr, HI, разбавленной H2SO4, H3PO4, RCOOH и другими): а) Fe + HBr → б) Co + H2SO4(разб) → б) Fe + H2SO4(разб) → б) Ni + H2SO4(разб) → - взаимодействие с концентрированной H2SO4: а) Ni + H2SO4(конц) → ………….+ SO2 + H2O
б) Co + H2SO4(конц) → ………….+ S + H2O - взаимодействие с разбавленной и концентрированной HNO3: а) Co + HNO3(разб) → ………….+ N2O + H2O
б) Ni + HNO3(конц) → ………….+ NO2 + H2O
3. Свойства оксидов и гидроксисоединений металлов VIIIБ - подгруппы: - формулы оксидов металлов VIIIБ - подгруппы ……………………………………….
- формулы гидроксидов металлов VIIIБ - подгруппы ……………………………
- растворимость, взаимодействие с водой оксидов и гидроксидов металлов VIIIБ – подгруппы…… - диссоциация в водном растворе гидроксида железа(II):
Основные свойства проявляют оксид и гидроксид железа …………. При сплавлении амфотерные свойства проявляют оксид и гидроксид железа …………. - взаимодействие оксидов и гидроксидов металлов VIIIБ - подгруппы с кислотами и кислотными оксидами. а) Fe2O3 + H2SO4 →
б) Fe(OH)2 + H2SO4 →
в) Ni(OH)2 + H2SO4 → - взаимодействие оксида и гидроксида железа (III) с основаниями при сплавлении происходит с образованием простых солей (назовите их) и воды Fe2O3 + NaOH → ….. + H2O
4. Растворимость солей, гидролиз солей Плохо растворимы соли железа(II)……………………….. железа (III)…………….,
кобальта(II) …………………………, никеля(II)………………………………… Растворимые сульфат железа(II) и сульфат железа(III)подвергается гидролизу по …………….., среда в растворе …………………….
5. Окислительно-восстановительные свойства соединений металлов VIIIБ - подгруппы - Используя значения ОВП, приведенных на диаграмме Латимера, охарактеризовать окислительно-восстановительные свойства соединений железа. Укажите соединения, проявляющие а) только окислительные свойства……… б) только восстановительные свойства……. в) двойственные окислительно-восстановительные свойства……. г) в ряду Fe2+ Co2+ Ni2+ восстановительные свойства ионов Me2+………………... д) в ряду Fe3+ Co3+ Ni3+ окислительные свойства ионов Me3+………………...
Диаграмма Латимера для триады Fe - Co – Ni:
+2,20 +0,771 - 0,4402
+1,808 -0,277
+2,25 -0,250
-0,49
Окислительные свойства соединений………………более выражены в …………………. среде
Восстановительные свойства соединений……………более выражены в …………………. Среде.
В присутствии аммиака восстановительные свойства металлов Co и Ni……………….. 6. Комплексные соединения металлов VIIIБ - подгруппы Катионы металлов VIIIБ - подгруппы образуют устойчивые комплексные соединения с аммиаком, цианид- и другими ионами. Поэтому оксиды, гидроксиды кобальта и никеля растворяются, например, в избытке аммиака. CoO + 6 NH4OH → [Co(NH3)6](OH)2 + 5H2O гидроксид гекса аминкобальта(II) Ni(OH)2 + 6 NH4OH → [Ni(NH3)6](OH)2 + 6H2O гидроксид гекса аминникеля(II)
|
|||||||
|
Последнее изменение этой страницы: 2016-07-16; просмотров: 265; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.103.8 (0.011 с.) |

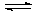 …
…
 FeO42- Fe3+ Fe2+ Fe
FeO42- Fe3+ Fe2+ Fe +0,36 -1,5
+0,36 -1,5
 [Fe(CN)6]3- [Fe(CN)6]4-
[Fe(CN)6]3- [Fe(CN)6]4- + 0,178
+ 0,178

 NiO(OH) Ni2+ Ni
NiO(OH) Ni2+ Ni [Ni(NH3)6]3+
[Ni(NH3)6]3+


