
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Взаимодействие металлического железа с концентрированной серной кислотой, азотной кислотой изучено в лабораторной работе 4,5 «общие свойства металлов», коррозия железа — в ЛР 2.Содержание книги
Поиск на нашем сайте
Опыт 1. Получение и кислотно-основные свойства гидроксида железа (II) В две пробирки внести по 2 капли раствора сульфата железа (II) (соли Мора) и 2 н раствора гидроксида натрия до образования осадка. В первую пробирку к образовавшемуся осадку гидроксида железа (II) добавить избыток раствора соляной кислоты, во вторую пробирку – избыток раствора гидроксида натрия: – охарактеризовать внешний вид осадка……..
- составить уравнения реакции образования гидроксида железа (II) в молекулярной и ионной форме FeSO4 + NaOH → …
- отметить, с каким раствором - соляной кислоты или гидроксида натрия - взаимодействует гидроксид железа (II)…………. - составить уравнение реакции гидроксида железа (II) с соляной кислотой в молекулярной и ионной форме Fe(OH)2 + HCl → …
- отметить, как изменяется внешний вид осадка Fe(OH)2 во второй пробирке при хранении на воздухе, объяснить……………
- составить уравнение реакции окисления гидроксида железа (II) на воздухе Fe(OH)2 + O2 + … → … - сделать вывод о свойствах гидроксида железа (II).
Опыт 2. Восстановительные свойства железа (II) а) В пробирку внести по 2 капли раствора сульфата железа (II) (соли Мора) и 2 н раствора гидроксида натрия до образования осадка. Добавить 2-3 капли 3%-ного раствора перекиси водорода (Н2О2). - Отметить, изменение цвета осадка …..
- Написать уравнение реакции окисления гидроксида железа (II) перекисью водорода до гидроксида железа (III). Fe(OH)2 + Н2О2 ® - Указать окислитель…………., восстановитель…………………..; - Рассчитать ЭДС реакции: ЭДС = φок. – φвос. = - возможно ли самопроизвольное протекание реакции при стандартных условиях… - Вывод
б) Внести в пробирку 3 капли раствора перманганата калия (KMnO4), 2 капли 2н раствора серной кислоты и несколько кристалликов соли Мора. - Отметить, какие изменения происходят в пробирке
- Восстановителем в данной реакции является………….., окислителем - ……….. - Составить уравнение реакции: KMnO4 + H2SO4 + FeSO4 ® MnSO4 + K2SO4 + H2O +.....
- Вывод
Опыт 3. Получение и кислотно-основные свойства гидроксида железа (III) В две пробирки внести по 2 капли раствора хлорида железа (III) и 2 н раствора гидроксида натрия до образования осадка. В первую пробирку к образовавшемуся осадку гидроксида железа (III) добавить избыток раствора соляной кислоты, во вторую пробирку – избыток концентрированного раствора гидроксида натрия: - охарактеризовать внешний вид осадка
- составить уравнение реакции образования гидроксида железа (III) в молекулярной и ионной форме: FeCl3 + NaOH → …
- отметить, в избытке какого раствора - соляной кислоты или гидроксида натрия - осадок гидроксида железа (III) растворился полностью - составить уравнение реакции взаимодействия гидроксида железа (III) с соляной кислотой в молекулярной и ионной форме: Fe(OH)3 + HCl → …
- частично растворяясь в избытке концентрированного раствора гидроксида натрия, гидроксид железа (III) образует гидроксокомплекс, составить уравнение, отметить в каком направлении смещено это равновесие: Fe(OH)3 + NaOH - отметить, какие свойства - кислотные или основные - преобладают у гидроксида железа (III)…….. - сравнить кислотно-основные свойства гидроксида железа (II) и гидроксида железа (III)……… - Вывод
Опыт 4. Окислительные свойства железа (III) В пробирку с 3 каплями раствора соли железа (III) добавить 1-2 капли раствора иодида калия (KI). - Отметить, какие изменения происходят в пробирке ……. - Составить уравнение реакции, учитывая, что одним из продуктов реакции является I2. FeCl3 + KI → …
- как изменилась степень окисления железа ………………, йода………………… - Указать окислитель…………., восстановитель…………………..; - Рассчитать ЭДС реакции: ЭДС = φок. – φвос. =
- возможно ли самопроизвольное протекание реакции при стандартных условиях… - Ион Fe3+ проявляет …………………… свойства - Вывод
Опыт 5. Получение и свойства гидроксида кобальта (II) В три пробирки поместить по 2 - 3 капли раствора соли кобальта (II) и добавлять по каплям раствор гидроксида натрия; сначала появляется синий осадок основной соли, который затем становится розовым, что указывает на образование гидроксида кобальта (II). К осадку в первой пробирке добавить несколько капель 2 н раствора соляной кислоты, осадок во второй пробирке тщательно размешать стеклянной палочкой, а в третью - прибавить 2-3 капли 3%-ного раствора пероксида водорода (сохранить для опыта 10). – охарактеризовать внешний вид осадка……..
- составить уравнения реакции образования гидроксида кобальта(II) в молекулярной и ионной форме CoSO4 + NaOH → …
- отметить, с каким раствором - соляной кислоты или гидроксида натрия - взаимодействует гидроксид кобальта(II)…………. - составить уравнение реакции гидроксида кобальта(II) с соляной кислотой в молекулярной и ионной форме Co(OH)2 + HCl → …
- отметить, как изменяется внешний вид осадка Co(OH)2 во второй пробирке при хранении на воздухе ……………
- составить уравнение реакции медленного окисления гидроксида кобальта(II) на воздухе Co(OH)2 + O2 + … → …
- Быстрое окисление гидроксида кобальта (II) наблюдается в пробирке с ………… - Составить уравнение реакции окисления гидроксида кобальта(II) перекисью водорода до гидроксида кобальта(III). Co(OH)2 + Н2О2 ®
- Указать окислитель…………., восстановитель…………………..; - Рассчитать ЭДС реакции: ЭДС = φок. – φвос. = - Сравнить полученные результаты с результатом опыта по окислению гидроксида железа (II)
-Указать какой ион - Co2+ или Fe2+ - является более сильным восстановителем ……. - сделать вывод о свойствах гидроксида кобальта (II)
Опыт 6. Свойства гидроксида кобальта (III) (показательный) К осадку гидроксида кобальта (III), полученному в опыте 9, прибавить несколько капель концентрированного раствора соляной кислоты. Над отверстием пробирки подержать фильтровальную бумагу, смоченную раствором йодида калия. - Отметить, какие изменения происходят в пробирке ……………… ………………………………….на фильтровальной бумаге……………… - Составить уравнение реакции, учитывая, что одним из продуктов реакции является Cl2. Co(OH)3 + HCl → …
- как изменилась степень окисления хлора ………………, кобальта………………… - Указать окислитель…………., восстановитель…………………..; - Рассчитать ЭДС реакции: ЭДС = φок. – φвос. =
- возможно ли самопроизвольное протекание реакции при стандартных условиях… - Co(OH)3 проявляет …………………… свойства - Вывод
|
||||
|
Последнее изменение этой страницы: 2016-07-16; просмотров: 124; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.140.188.174 (0.006 с.) |

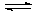 …
…


