
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Поменять местами электроды (опыт 2), вследствие чего анод окажется омеднённым. Снова пропустить электрический ток.Содержание книги
Поиск на нашем сайте
- Отметить, какие изменения происходят на электродах;
- составить уравнения электролитической диссоциации CuSO4 и H2O: CuSO4
H2O - составить уравнение гидролиза CuSO4 в растворе;
- в растворе CuSO4………………….. среда - возможные окислители:…………………… - выбрать окислитель, характеризующийся наибольшим значением окислительно-восстановительного потенциала:
- составить уравнение катодной реакции: (процесс …………….…); - возможные восстановители:……………….. - выбрать восстановитель, характеризующийся наименьшим значением окислительно-восстановительного потенциала:
- составить уравнение анодной реакции: (процесс ………………...); - составить суммарное уравнение электролиза раствора сульфата меди (II) с активным медным анодом, объединив уравнения катодной и анодной реакций с учетом коэффициентов электронного баланса:
- ответить, каковы области практического использования электролиза водных растворов солей с активным анодом.
Вывод:
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
Уфимский государственный нефтяной технический университет
Кафедра «Общая и аналитическая химия»
Дисциплина «Общая и неорганическая химия»
ОТЧЕТ
по лабораторной работе №4,5
На тему: «Общие свойства металлов»
Выполнил студент группы__________ ______________ Фамилия И.О. (Подпись, дата) Принял доцент кафедры ОАХ ______________ (Подпись, дата) Цель работы: - научиться оценивать химическую активность металлов по положению в Периодической системе; - научиться пользоваться рядом стандартных ОВП; - научиться сравнивать химическую активность металлов; - изучить взаимодействие металлов с различными окислителями — неметаллами; - изучить взаимодействие металлов с водой, водными растворами щелочей, кислот;
Краткая теория. Активность металлов увеличивается в главной подгруппе в направлении………………… в побочной подгруппе — ……………………… в периоде — Составьте уравнения реакций: - взаимодействие с кислородом: а) K б) Be - взаимодействие с галогенами (хлором): а) Cs б) Sr - взаимодействие с серой: а) Rb б) Mg - взаимодействие с азотом: а) Li б) Be Ряд стандартных ОВП металлов – это последовательность, в которой металлы расположены в порядке ………………………… ОВП для электрохимических систем: ……………………
Металл является ………………… формой данных электрохимических систем, катион металла -………………… формой.
Чем меньше значение стандартного ОВП и левее стоит металл в ряду стандартных ОВП, тем ………....... восстановительная способность (химическая активность) металла.
Чем больше значение стандартного ОВП и правее стоит металл в ряду стандартных ОВП, тем …………...восстановительная способность (химическая активность) металла и ………………….. окислительная способность катионов металла. Укажите наиболее активный металл: а) Ni б) Ag в) Ca г) Fe д) Cu
Более активный металл вытесняет …………………..металл, стоящий ……………………..в ряду стандартных ОВП металлов, из раствора его соли. Составьте уравнения возможных реакций: 1) Sn + MgCl2 → 3) Al + CoCl2 →
2) Fe + CuCl2 → 4) Cu + AgNO3 →
Рассчитайте ЭДС для реакций (1-4) 1) ЭДС = 3) ЭДС =
2) ЭДС = 4) ЭДС = С водой активно взаимодействуют металлы…………………………….., с образованием …….. и ………….. Составьте уравнения возможных реакций а) Ca + H2O → б) Ni + H2O →
Алюминий, марганец при обычных условиях не взаимодействуют с водой так как ……………………… С водным раствором щелочи взаимодействуют металлы…………………….
Составьте уравнения реакций а) Zn + H2O + NaOH →
б) Ga + H2O + NaOH →
Металл IIA – подгруппы …………….. не взаимодействует с водой, так как …………………………………, но легко вытесняет водород из водного раствора щелочи
……… + NaOH + H2O →
C водными растворами кислот, окисляющими H+ (HF, HCl, HBr, HI, разбавленной H2SO4, H3PO4, RCOOH и другими) взаимодействуют металлы………………
Металлы, стоящие ………………. водорода в ряду стандартных ОВП металлов, вытесняют молекулярный водород из кислот. Металлы, стоящие ………………. водорода в ряду стандартных ОВП металлов, не вытесняют молекулярный водород из кислот. Составьте уравнения возможных реакций: 5) Fe + HCl → 7) Ag + HCl →
6) Sn + HCl → 8) Na + HCl →
|
||||
|
Последнее изменение этой страницы: 2016-07-16; просмотров: 169; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.226.180.253 (0.01 с.) |


 + 0,34 В
+ 0,34 В 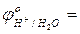 - 0,41 … 0,0 В;
- 0,41 … 0,0 В;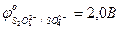
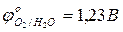 …0,82 В
…0,82 В 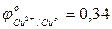 В;
В; (ионное уравнение);
(ионное уравнение); (молекулярное уравнение);
(молекулярное уравнение);


