
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опыт 7. Получение и свойства гидроксида никеля (II)Содержание книги
Поиск на нашем сайте
В четыре пробирки поместить по 2-3 капли раствора соли никеля(II) и добавить по каплям раствор гидроксида натрия до выпадения осадка гидроксида никеля(II). В первую пробирку внести несколько капель 2 н раствора соляной кислоты, во второй пробирке осадок тщательно размешать стеклянной палочкой, в третью - добавить 2-3 капли 3% - ного раствора пероксида водорода. В четвертую пробирку прибавить одну каплю бромной воды (сохранить для опыта 12). – охарактеризовать внешний вид осадка……..
- составить уравнения реакции образования гидроксида никеля(II) в молекулярной и ионной форме NiSO4 + NaOH → …
- отметить, с каким раствором - соляной кислоты или гидроксида натрия - взаимодействует гидроксид никеля (II)…………. - составить уравнение реакции гидроксида никеля (II) с соляной кислотой в молекулярной и ионной форме Ni(OH)2 + HCl → …
- отметить, изменяется ли внешний вид осадка Ni(OH)2 во второй пробирке при хранении на воздухе …………… - отметить, изменяется ли внешний вид осадка Ni(OH)2 во второй пробирке с перекисью водорода …………… - быстрое окисление гидроксида никеля (II) наблюдается в пробирке …………….. - Написать уравнение реакции окисления гидроксида никеля (II) бромной водой до гидроксида никеля (III). Ni(OH)2 + Br2 ®
- Указать окислитель…………., восстановитель…………………..; - Сравнить полученные результаты с результатами опытов по окислению гидроксида железа (II) и гидроксида кобальта (II) - Сравнить значения стандартных окислительно-восстановительных потенциалов
-Указать какой ион - Ni2+, Co2+, или Fe2+ - является более сильным восстановителем ……. -Указать, какой ион - Ni3+, Co3+, или Fe3+ - является более сильным окислителем ……. - сделать вывод о свойствах гидроксида никеля (II) Опыт 8. Свойства гидроксида никеля (III) (показательный) К осадку гидроксида никеля (III), полученному в опыте 11, прибавить несколько капель разбавленного раствора соляной кислоты. Над отверстием пробирки подержать фильтровальную бумагу, смоченную раствором йодида калия. - Отметить, какие изменения происходят в пробирке ……………… ………………………………….на фильтровальной бумаге……………… - Составить уравнение реакции, учитывая, что одним из продуктов реакции является Cl2.
Ni(OH)3 + HCl → …
- как изменилась степень окисления хлора ………………, никеля………………… - Указать окислитель…………., восстановитель…………………..; - Рассчитать ЭДС реакции: ЭДС = φок. – φвос. =
- возможно ли самопроизвольное протекание реакции при стандартных условиях… - Ni(OH)3 проявляет …………………… свойства - Вывод
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
Уфимский государственный нефтяной технический университет
Кафедра «Общая и аналитическая химия»
Дисциплина «Общая и неорганическая химия»
ОТЧЕТ По лабораторной работе №11 На тему: «Химические свойства хрома и его соединений»
Выполнил студент группы__________ ______________ Фамилия И.О. (Подпись, дата)
Принял доцент кафедры ОАХ ______________ (Подпись, дата) Цель работы: - Изучить свойства металлов VIБ – подгруппы; - Изучить свойства характеристичных соединений металлов VIБ – подгруппы. Краткая теория. 1. Положение элементов в периодической системе, свойства атомов Электронные конфигурации атомов, валентные электроны металлов VIБ- подгруппы:
Степени окисления: VIБ - подгруппа …………..……..…….
2. Свойства простых веществ – металлов: - положение в «ряду стандартных окислительно-восстановительных (электродных) потенциалов металлов» φ(Men+/Me) = - активность металлов: - пассивирование металлов…….. Составьте уравнения реакций: - взаимодействие с кислородом: а) Cr б) Mo - взаимодействие с галогенами (хлором): а) Cr б) Mo - взаимодействие с серой: а) Cr б) Mo - взаимодействие с водой термодинамически невозможно для металла………….. - взаимодействие с водой для металла………….. термодинамически возможно, однако он устойчив в воде так как……………………. - взаимодействие с водными растворами кислот, окисляющими H+ (HF, HCl, HBr, HI, разбавленной H2SO4, H3PO4, RCOOH и другими): а) Cr + HBr → б) Cr + H2SO4(разб) → - взаимодействие с концентрированной H2SO4: а) Cr + H2SO4(конц) → ………….+ S + H2O
б) Mo + H2SO4(конц) → ………….+ H2S + H2O - взаимодействие с разбавленной и концентрированной HNO3: а) Cr + HNO3(разб) → ………….+ N2O + H2O
б) Cr + HNO3(конц) → ………….+ NO2 + H2O 3. Свойства оксидов и гидроксисоединений металлов VIБ - подгруппы:
- формулы оксидов металлов VIБ - подгруппы ……………………………………….
- формулы гидроксисоединений металлов VIБ - подгруппы ……………………………
- растворимость, взаимодействие с водой оксидов и гидроксисоединений металлов VIБ - подгруппы
- диссоциация в водном растворе гидроксида хрома(III): [Cr(OH)4]- + H+
- диссоциация в водном растворе хромовой кислоты: 1 стадия К1 = 2 стадия К2 = Основные свойства проявляют оксид и гидроксид хрома…………. Амфотерные свойства проявляют оксид и гидроксид хрома…………. Кислотные свойства проявляют соединения хрома:………….
- взаимодействие оксидов и гидроксидов металлов VIБ - подгруппы с кислотами и кислотными оксидами. а) Cr2O3 + H2SO4 →
б) Cr(OH)3 + H2SO4 →
- взаимодействие оксидов и гидроксидов металлов VIБ - подгрупп с основаниями при сплавлении происходит с образованием простых солей (назовите их) и воды Cr2O3 + NaOH → NaCrO2 + H2O
Cr(OH)3 + NaOH → NaCrO2 + H2O
CrO3 + NaOH → Na2CrO4 + H2O
H2CrO4 + NaOH → Na2CrO4 + H2O
- взаимодействие оксида и гидроксида хрома(III) с водными растворами щелочей происходит с образованием комплексных солей (назовите их): Cr2O3 + NaOH + H2O → Na[Cr(OH)4]
Cr(OH)3 + NaOH → Na[Cr(OH)4] 4. Растворимость солей, гидролиз солей Плохо растворимы соли хрома(III)………….
Плохо растворимы соли хроматы:…………. Растворимый сульфат хрома(III) подвергается гидролизу по …………….., среда в растворе ……………………. Гидролиз хлорида хрома (III) усиливается при добавлении: а) NaOH б) HCl в) Mg г) при нагревании
Растворимый хромит натрия……………… и хромат натрия ……………… подвергаются гидролизу по …………….., среда в растворах ……………………. Получение Cr2S3 и Cr2(CO3)3 обменными реакциями в водном растворе ………………….., так как протекает ………………………… 5. Окислительно-восстановительные свойства соединений металлов VIБ - подгруппы Диаграмма Латимера для хрома: + 0,293
+1,33 - 0,406 - 0,913
- 0,744
- 0,165 - 1,057 - 1,35
- Используя значения ОВП, приведенных на диаграмме Латимера, охарактеризовать окислительно-восстановительные свойства соединений хрома. Укажите соединения, проявляющие а) только окислительные свойства……… б) только восстановительные свойства……. в) двойственные окислительно-восстановительные свойства……. Окислительные свойства соединений………………более выражены в …………………. среде Восстановительные свойства соединений……………более выражены в …………………. среде
|
||||||
|
Последнее изменение этой страницы: 2016-07-16; просмотров: 323; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.129.25.216 (0.009 с.) |


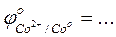

 H2O + Cr(OH)3
H2O + Cr(OH)3 




 Cr2O72- Cr3+ Cr2+ Cr0 (кислая среда)
Cr2O72- Cr3+ Cr2+ Cr0 (кислая среда)





