
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опыт 6. Различная растворимость сульфита и сульфата бария в кислотеСодержание книги
Поиск на нашем сайте
В двух пробирках получить обменной реакцией сульфит и сульфат бария, для чего взять по 3-4 капли растворов соответствующих солей Na2SO3 или Na2SO4 и BaCl2. Наблюдать образование осадков в обеих пробирках. Сравнить растворимость сульфита и сульфата бария в кислоте, добавив в обе пробирки по 1-2 капли 2 н. соляной кислоты. - Отметить происходящие изменения в пробирках
- Составить уравнение реакции получения сульфата бария в молекулярной и ионной форме BaCl2 + Na2SO4 →
- Составить уравнение реакции получения сульфита бария в молекулярной и ионной форме BaCl2 + Na2SO3 →
- Составить уравнение реакции растворения сульфита бария в кислоте в молекулярной и ионной форме BaSO3 + HCl →
-Ответить, можно ли этой реакцией различить ионы SO
Опыт 7. Восстановительные свойства тиосульфата натрия В две пробирки внести раздельно по 5-6 капель бромной и иодной воды. В обе пробирки добавить по несколько капель тиосульфата натрия до обесцвечивания растворов. - Отметить происходящие изменения в пробирках
- Составить уравнение реакции, учитывая, что бром окисляет тиосульфат до сульфата, при этом в реакции участвует вода. Выделяющаяся сера является продуктом побочной реакции. Na2S2O3 + Br2 + H2O → Na2SO4 + H2SO4 + HBr
- Указать окислитель………………….., восстановитель ………………….
- Составить уравнение реакции, учитывая, что йод окисляет тиосульфат до тетратионата Na2S4O6. Na2S2O3 + I2 → Na2S4O6 + NaI
- Указать окислитель………………….., восстановитель …………………. - указать, какие свойства проявляет тиосульфат натрия.
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
Уфимский государственный нефтяной технический университет
Кафедра «Общая и аналитическая химия»
Дисциплина «Общая и неорганическая химия»
ОТЧЕТ
по лабораторной работе № 15
На тему: «Химические свойства неметалловVА – подгруппы и их соединений (азота, фосфора и их соединений)»
Выполнил студент группы__________ ______________ Фамилия И.О. (Подпись, дата)
Принял доцент кафедры ОАХ ______________ (Подпись, дата) Цель работы: - Изучить свойства неметаллов VА – подгруппы; - Изучить свойства характеристичных соединений неметаллов VА – подгруппы. Краткая теория. 1. Положение элементов в периодической системе, свойства атомов Электронные конфигурации атомов, валентные электроны неметаллов VА- подгруппы:
Степени окисления: VА - подгруппа …………..……..…….
2. Свойства простых веществ – неметаллов VА – подгруппы: - физические свойства:
Составьте уравнения реакций: - взаимодействие с кислородом: а) N2 б) P - взаимодействие азота и фосфора с металлами: а) N2 + Mg → б) Zn + P → - азот, фосфор в воде ………………растворимы; - в водных кислых растворах кислот, окисляющими H+ (HF, HCl, HBr, HI, разбавленной H2SO4, H3PO4, RCOOH и другими) азот, фосфор …………………… - взаимодействие с концентрированной H2SO4: а) P + H2SO4(конц) → SO2 + H2O
- взаимодействие с концентрированной HNO3: б) P + HNO3(конц) → ………….+ NO2 + H2O 3. Свойства соединений с водородов и их солей: Формулы и названия соединений с водородом……………
- агрегатные состояния соединений с водородом ……………… - растворимость соединений с водородом в воде ………………. - растворы соединений с водородом в воде называют: NH3 - …………………… - Сравните основные свойства в ряду кислот: NH3 PH3 4. Свойства оксидов и кислородсодержащих кислот азота и фосфора: - формулы оксидов ……………………………………….
- составьте формулы кислородсодержащих кислот ……………………………
- назовите кислородсодержащие кислоты азота и фосфора и их соли:
- растворимость, взаимодействие с водой оксидов азота NO2 + H2O →
N2O5 + H2O → - растворимость, взаимодействие с водой оксидов фосфора P2O5 + H2O → - диссоциация в водном растворе кислородсодержащих кислот азота HNO2 →
HNO3 → Слабые кислотные свойства проявляют соединения азота:…………. Слабые кислотные свойства проявляют соединения фосфора:…………. Сильные кислотные свойства проявляют соединения азота:…………. - взаимодействие оксидов и кислот азота и фосфора с основаниями NO2 + NaOH → ……… + ……. + H2O
N2O3 + NaOH → ……….. + H2O
N2O5 + NaOH → ……….. + H2O
- Сравните кислотные свойства в ряду кислот: – HNO2 - HNO3……... - Сравните кислотные свойства в ряду кислот: – H3PO4 …………………..– HNO3 …………. ………...
5. Растворимость солей, гидролиз солей Плохо растворимы ортофосфаты…………. нитриты……………………………….нитраты…………………………. Растворимые нитриты и ортофосфаты подвергается гидролизу по …………….., среда в растворе ……………………. Растворимые соли аммония подвергаются гидролизу по …………..………….., среда в растворе ……………………. - Сравните гидролизуемость солей в ряду: K3PO4 - KNO2 – KNO3 ……...
6. Окислительно-восстановительные свойства соединений азота и фосфора - Используя значения ОВП, приведенных на диаграмме Латимера, охарактеризовать окислительно-восстановительные свойства соединений. Диаграмма Латимера для азота: а) в кислой среде
-0,86 + 0,88 -0,46 +0,76 +0,94 -3,4
+0,16 +0,73 -2,86
- Укажите соединения азота, проявляющие а) только окислительные свойства……… б) только восстановительные свойства……. в) двойственные окислительно-восстановительные свойства……. - Укажите и сравните окислительные свойства в ряду кислот: – H3PO4 ……………..– HNO2 ……..………. - HNO3……...
|
||||
|
Последнее изменение этой страницы: 2016-07-16; просмотров: 513; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.220 (0.006 с.) |

 и SO
и SO 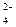 .
. б) в щелочной среде
б) в щелочной среде
 (NO2)
(NO2)
 NH3 N2H4 NH2OH
NH3 N2H4 NH2OH


