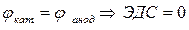Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Особенности электрохимических процессовСодержание книги
Поиск на нашем сайте
1) - пространственное разделение процессов окисления и восстановления; 2) - наличие внешней цепи (металлический проводник) и внутренней цепи (электролит) (рис. 6); 3) - первичные реакции идут на «электродах» – поверхности контакта металлического проводника и электролита; катод – электрод, на котором идет процесс восстановления; анод – электрод, на котором идет процесс окисления.
электро- лит
электроды Рис. 6. Схема электролитической ячейки
Электрохимические процессы подразделяются на две группы а) процессы, происходящие в гальванических элементах и сопровождающиеся возникновением электрической энергии за счет химических процессов; б) процессы, протекающие в элетролизерах под действием электрической энергии от внешнего источника тока, вызывающей химические реакции на электродах.
Сравнение процессов в гальванических элементах и электролиза
Гальванический элемент Гальванический элемент – устройство, в котором химическая энергия самопроизвольно протекающей окислительно-восстановительной реакции превращается в электрическую энергию. Гальванический элемент содержит два полуэлемента, между электродами которых возникает разность потенциалов. Принцип работы гальванического элемента иллюстрирует гальванический элемент Даниэля-Якоби, состоящий из цинкового и медного полуэлементов (рис. 7). В цинковом полуэлементе металлическая цинковая пластина погружена в водный раствор соли цинка, с концентрацией [Zn2+]=1 моль/л. В медном полуэлементе – металлическая медная пластина погружена в водный раствор соли меди (II) с концентрацией [Cu2+]=1 моль/л. Цинковая и медная пластины соединены металлическим проводником, растворы солей – «солевым мостиком» («электролитический ключ»).

Рис. 7. Гальванический элемент Даниэля-Якоби
До замыкания цепи на каждой из металлических пластин на границе с раствором устанавливаются равновесия: Cuo(тв.) Zno(тв.) Цинковая пластина заряжена более отрицательно, чем медная. Между ними возникает разность потенциалов. При замыкании системы в цепь равновесия на границе металл–раствор нарушаются. По внешней цепи – металлическому проводнику – избыток электронов с Zn–пластины переходит на Cu–пластину, где их концентрация меньше, так как В результате, равновесие на Zn-пластине смещается вправо, идет окисление металлического цинка. На Cu-пластине равновесие смещается влево, протекает восстановление ионов меди (II). Анод Zn(тв.) – 2e → Zn2+(р-р) (процесс окисления) Катод Cu2+(р-р) + 2e → Сuo(тв.) (процесс восстановления)
Ионное уравнение Zn(тв.) + Cu2+(р-р) → Zn2+(р-р) + Cuo(тв.) суммарной реакции Молекулярное Zn + Cu(NO3)2 → Zn(NO3)2 + Cu уравнение суммарной реакции Между растворами электролитов также возникает разность потенциалов. В цинковом полуэлементе в результате растворения цинка увеличивается концентрация ионов Zn2+, в растворе создается избыток положительно заряженных ионов. В медном полуэлементе в результате осаждения меди концентрация ионов Cu2+ уменьшается и в растворе создается избыток отрицательно заряженных ионов. По внутренней цепи – «солевому мостику» – катионы и анионы перемещаются навстречу друг другу. Таким образом, в системе возникает направленное перемещение заряженных частиц, т.е. возникает электрический ток. Электродвижущая сила – ЭДС – гальванического элемента определяется разностью потенциалов катода и анода
По мере работы гальванического элемента значения потенциалов катода и анода изменяются. Поскольку молярная концентрация ионов Cu2+ – уменьшается, в соответствии с уравнением Нернста уменьшается потенциал катода
Молярная концентрация ионов Zn2+– [Zn2+] – увеличивается, следовательно, увеличивается потенциал анода
Таким образом, по мере работы гальванического элемента ЭДС уменьшается, так как происходящие на электродах процессы приводят к выравниванию потенциалов. Система приходит в равновесие и гальванический элемент прекращает работу при условии
|
|||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-07-11; просмотров: 1450; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.32.6 (0.007 с.) |



 внешняя цепь (металлический проводник)
внешняя цепь (металлический проводник)


 внутренняя цепь
внутренняя цепь Сu2+(р-р) + 2e(на мет.);
Сu2+(р-р) + 2e(на мет.); 

 <
<  .
.
 > 0
> 0 .
.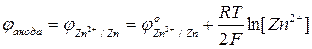 .
.